Інгібування росту пухлини нейробластоми за допомогою кетогенної дієти та/або обмеження калорій у моделі миші CD1-Nu
Рафаель Йоганнес Моршер
1 Дослідницька програма з біохімії рецепторів та метаболізму пухлин, Медичний університет Парацельса, Зальцбург, Австрія,
5 Відділ медичної генетики, Медичний університет Інсбрук, Інсбрук, Тіроль, Австрія,
Сепіде Амінзаде-Гохарі
1 Дослідницька програма з біохімії рецепторів та метаболізму пухлин, Медичний університет Парацельса, Зальцбург, Австрія,
Рене Гюнтер Фейхтінгер
1 Дослідницька програма з біохімії рецепторів та метаболізму пухлин, Медичний університет Парацельса, Зальцбург, Австрія,
Йоганнес Адальберт Майр
2 Кафедра педіатрії, Медичний університет Парацельса, Зальцбург, Австрія,
Роланд Ленг
3 Департамент дерматології, Медичний університет Парацельса, Зальцбург, Австрія,
Даніель Нойрітер
4 Кафедра патології Медичного університету Парацельса, Зальцбург, Австрія,
Вольфганг Шперль
2 Кафедра педіатрії, Медичний університет Парацельса, Зальцбург, Австрія,
Барбара Кофлер
1 Дослідницька програма з рецепторної біохімії та метаболізму пухлин, Медичний університет Парацельса, Зальцбург, Австрія,
Задумав та спроектував експерименти: BK RGF WS RJM. Виконував експерименти: RJM SAG RGF RL. Проаналізовано дані: RJM RGF JAM DN WS BK. Написав папір: RJM BK.
Пов’язані дані
Усі відповідні дані знаходяться в газеті та в допоміжних файлах.
Анотація
Вступ
Нейробластома - це злоякісний дитячий рак, що походить від клітин нервового гребеня. Характеризується загальним зменшенням окисного фосфорилювання мітохондрій. Метою цього дослідження було дослідити вплив обмеження калорій та кетогенної дієти на ріст пухлини нейробластоми та відстежувати потенційні адаптаційні механізми системи окисного фосфорилювання раку.
Методи
Ксенотрансплантати були встановлені у голих мишей CD-1 шляхом підшкірного введення двох клітинних ліній нейробластоми, що мають чіткі генетичні характеристики та терапевтичну чутливість [SH-SY5Y та SK-N-BE (2)]. Мишей рандомізували до чотирьох груп лікування, які отримували стандартну дієту, стандартну дієту з обмеженням калорій, кетогенну дієту на основі довгих ланцюгів жирних кислот або кетогенну дієту з обмеженням калорій. Відстежували ріст пухлини, виживаність, метаболічні параметри та вагу мишей. Тканину раку оцінювали на предмет індукованих дієтою змін показників проліферації та параметрів множинної системи окисного фосфорилювання (активність ферментів дихальних ланцюгів, аналіз вестерн-блот, імуногістохімія та вміст мітохондріальної ДНК).
Результати
Кетогенна дієта та/або обмеження калорій значно зменшили ріст пухлини та продовжили виживання в моделі ксенотрансплантата. Зменшення росту нейробластоми корелювало зі зниженням концентрації глюкози в крові і характеризувалось значним зниженням рівнів Ki-67 та фосфогістону H3 у групах дієти з низьким рістом пухлини. Як і в пухлинній тканині людини, ксенотрансплантати нейробластоми продемонстрували виразно низьку активність мітохондріального комплексу II у поєднанні з генералізованим низьким рівнем окисного фосфорилювання мітохондрій, підтверджуючи модель пухлини. Нейробластома не виявляла здатності пристосовувати свою окислювальну активність мітохондрій до фосфорилювання до зміни поживних речовин, спричиненої дієтичним втручанням.
Висновки
Наші дані свідчать про те, що орієнтування на метаболічні характеристики нейробластоми може відкрити новий фронт у підтримці стандартних схем терапії. Тому ми пропонуємо додатково оцінити кетогенну дієту та/або обмеження калорій як можливу допоміжну терапію для пацієнтів, які проходять лікування нейробластоми.
Вступ
Нейробластома (НБ) є найпоширенішим позачерепним твердим злоякісним захворюванням у дитячому віці. Ця пухлина периферичної нервової системи походить від примітивної симпатогонії, яка, як правило, дає початок постгангліонарним нейронам симпатичного ланцюга та мозковому мозку надниркових залоз [1]. Виходячи з біологічних та клінічних особливостей, захворювання можна класифікувати на три категорії ризику. У популяції пацієнтів із високим ризиком, незважаючи на великі зусилля щодо вдосконалення стратегій лікування, прогноз є поганим, і, за оцінками, 5-річна виживаність становить 50%. Це контрастує із загальним рівнем виживаності, що перевищує 90% у групах середнього та низького ризику, де оптимізація лікування перейшла у бік зменшення токсичності підходу мультимодальної терапії [2].
Мітохондріальний енергетичний метаболізм NB характеризується генералізованим низьким рівнем білка та рівня активності комплексів окисного фосфорилювання (OXPHOS), а також низьким числом копій генома мітохондрій (mtDNA). Однак маса мітохондрій, як визначається за допомогою таких маркерів, як активність цитратсинтази та вміст білка, залежного від напруги іонного каналу (VDAC), є подібною до маси нормальних надниркових залоз та тканин нирок [3]. Хоча механізми, що індукують цей фенотип, все ще вивчаються, дані вказують, що він є частиною метаболічного перепрограмування клітин NB, що забезпечує стан низької диференціації та високої проліферативної здатності. Показано, що зміни функції мітохондрій є центральним компонентом індукції диференціації клітинних ліній NB. Наприклад, лікування ретиноевою кислотою значно збільшує споживання основного кисню, а також дихальну здатність [4–6].
Ці спостереження відповідають перепрограмуванню метаболізму ракових клітин для збільшення утилізації глюкози, що є однією з ознак розвитку раку [7–9]. Залежність ракових клітин від анаеробного гліколізу, навіть коли є достатньо кисню для шунтування пірувату в шлях OXPHOS, широко відома як ефект Варбурга [10]. Ізольовані дефекти ферментів системи OXPHOS можуть бути безпосередньою причиною утворення раку та ефекту Варбурга, що є прикладом феохромоцитоми та парагангліоми (обидва з дефектами комплексу II) або онкоцитомами (дефекти комплексу I). Інші солідні пухлини, такі як карциноми нирок або НБ, характеризуються більш загальним зменшенням усіх комплексів OXPHOS [3, 11–18].
КД із обмеженням калорій або без нього (CR) протягом десятиліть є частиною лікування дітей з нерозв'язними нападами [34]. У педіатричній популяції КД широко переноситься без серйозних побічних ефектів і привертає увагу при лікуванні епілепсії, стійкої до терапії підлітків та дорослих [35]. Класичні схеми (наприклад, протокол Джонса Хопкінса) пропонують співвідношення вмісту їжі жирів до вуглеводів і білків 3: 1 або 4: 1 (у грамах). Зазвичай застосовуються такі пристосування до цього базового режиму, як поєднання його із змінною CR або більш ліберальні підходи, такі як модифікована дієта Аткінса [36, 37]. Зовсім недавно КД проводили оцінку щодо альтернативних показань, таких як ожиріння, синдром полікістозних яєчників та дегенеративні захворювання нервової системи [38]. Молекулярний механізм КД недостатньо вивчений, але дані вказують на багатофакторні прямі та непрямі метаболічні адаптації, включаючи посилений біогенез мітохондрій та змінений енергетичний стан клітин [36, 39].
Методи
Клітинні лінії
Для досліджень ксенотрансплантата були обрані клітинні лінії SH-SY5Y (ATCC CRL-2266) та SK-N-BE (2) (ATCC CRL-2271). SH-SY5Y - це клітинна лінія клітинної лінії TP53 дикого типу, не ампліфікована NMYC, яка не виявляє втрати гетерозиготності хромосоми 1р і чутлива до хіміотерапії. Клітинна лінія SK-N-BE (2) демонструє високу стійкість до широкого спектру хіміотерапевтичних засобів і характеризується ампліфікацією NMYC, мутацією TP53 (p.C135F) та втратою гетерозиготності хромосоми 1р [48]. Клітини вирощували в суміші мінімального ефірного середовища Eagle's Minimal Essential Medium та Ham F12 (Sigma), доповненої 10% фетальною бичачою сироваткою (PAA), глутамаксом (Gibco), незамінними амінокислотами (Sigma) та пеніциліном/стрептоміцином/амфотерицин (Sigma).
Моделі тварин та підготовка зразків
Всі експерименти in vivo проводились відповідно до протоколів, затверджених для цього дослідження Комітетом із догляду та використання тварин у Зальцбурзі (затвердження дослідження № 20901-TVG/44/7-2011). Тварин утримували у специфічних умовах, вільних від патогенів, та догляді, який відповідав австрійському Закону про експерименти над тваринами. Ксенотрансплантати були встановлені підшкірною ін'єкцією 200 мкл матригелю (BD Bioscience)/безсивороточного середовища суспензії клітин NB (2,7 × 10 7) на правий фланг 5-4-тижневих самок CD-1 оголених мишей ( Річка Чарльз). Після досягнення розміру пухлини 150 мм 3 мишей рандомізували до чотирьох груп дієтичної терапії (n = 8-11).
Обсяги пухлини вимірювали два рази на тиждень за допомогою штангенциркулів і обчислювали за формулою ширина * висота * довжина/2. Вагу тіла, рівень глюкози в крові та кетонових тіл (бета-гідроксибутират) контролювали двічі на тиждень після двогодинного періоду голодування в групах, що годували за винятком, або перед годуванням у групах з обмеженим вмістом калорій. Застосовувана методика широко використовується в клінічній рутинній діагностиці та використовує ферментативні методи для кількісної оцінки (Precision Xceed, Abbott) [49–51]. Після індукції севофлюранової анестезії мишей жертвували вивихом шийки матки в заздалегідь визначені дні (день 22 SH-SY5Y і день 33 SK-N-BE (2)) або коли були дотримані критерії припинення (стан здоров'я, виразка пухлини або об'єм 3000 мм 3) . Тканину раку швидко заморозили в рідкому азоті для вимірювання OXPHOS та визначення кількості копії мтДНК. Один зріз пухлини розміром 0,5 см кожен фіксували формаліном та вбудовували парафін для гістологічного аналізу.
Склад їжі та енергетичний вміст
Мишей годували за чотирма різними режимами: стандартна дієта ad libitum (SD), стандартна дієта з обмеженим вмістом калорій (CR-SD), кетогенна дієта на основі довгих ланцюгів жирних кислот (KD) та кетогенна дієта з обмеженим вмістом калорій (CR-KD) ). Вміст енергії, що піддається метаболізму, був таким: SD (ккал: жир 9%, білок 33% і вуглеводи 58%) і KD на основі жирних кислот з довгим ланцюгом (ккал: жир 78%, білок 14% і вуглеводи 8%) (№ V1535 -000 та No S9139-E02D; Sniff Spezialdiäten GmbH). Детальний перелік інгредієнтів наведено в Довідковій інформації (таблиця S1). Дієти були збагачені вітамінами та мінеральними добавками і дещо відрізнялись між цими двома дієтами. Щоб визначити середнє споживання калорій, 5 мишей спостерігали за годуванням у вільному режимі протягом 5-тижневого періоду (SD: середнє значення 6,22 г ± 0,96/д/миша; KD: 2,7 ± 0,4 г/д/миша). Для груп CR споживання їжі було обмежене до 2/3 відповідного споживання ad libitum. Цей ступінь CR відповідає такому в клінічних протоколах терапевтично стійкої епілепсії [35–37].
Екстракція 600г гомогенату
Збагачений мітохондріями гомогенат, отриманий диференціальним центрифугуванням, використовували для вимірювання активності ферментів та вестерн-блот-аналізу комплексів OXPHOS. Цей метод підвищує специфічність, а також використовується для оцінки спадкових метаболічних захворювань [52, 53]. Дезінтегратор тканин (Ultraturrax, IKA) використовували для гомогенізації тканини ксенотрансплантата NB (50–100 мг) у буфері для екстракції SEKT, рН 7,6 (250 мМ сахарози, 2 мМ EGTA, 40 мМ KCl, 20 мМ Tris-HCl). Потім клітинні мембрани обробляли гомогенізатором з тефлонового скла (Potter S, Braun). Центрифугування гомогенату при 600g протягом 10 хв при 4 ° C дає післяядерний супернатант (600g гомогенат), що містить фракцію мітохондрій.
Вимірювання ферментів
Для ферментативних вимірювань використовували Xenograft 600g гомогенату всіх випадків у групах SH-SY5Y (кожен n = 8-11) та репрезентативних випадків у групах SK-N-BE (2) (кожен n = 5). Діяльність усіх окремих ферментів комплексів OXPHOS I-V) та їх комбінацій (комплексів I + III та комплексів II + III) вимірювали, як описано раніше [3, 11, 54]. Крім того, вимірювали активність CS, оскільки вона є добре встановленим маркером маси мітохондрій [55]. Всі кількісні оцінки базувались на спектрофотометричних вимірах (Uvicon 922, Kontron) і проводились при 37 ° C, за винятком комплексу V, 30 ° C.
Визначення числа копії мтДНК
Для визначення кількості копії мтДНК проводили лікування протеїназою К (Roche Diagnostics) перед вилученням загальної ДНК з пухлинної тканини [58]. Кількісну ПЛР у реальному часі (iCycler, BioRad) проводили з використанням двох незалежних мітохондріальних (m.6625_6754 та m.9910_10198) та ядерних локусів ДНК (POLG та RRM2B). Потім вміст мтДНК визначали шляхом обчислення співвідношень значень Ct. Номер копії МтДНК подано як n/диплоїдний геном (послідовності пар праймерів 1–2 та 3–4 наведені в таблиці S2) [59].
Вестерн-блот-аналіз
600 г гомогенатів використовували для вестерн-блот-аналізу, як описано раніше [3]. Коротше кажучи, загалом 10 мкг білка відокремлювали на 10% акриламід/біс-акриламідних гелях і переносили в нітроцелюлозні мембрани (Amersham Biosciences) за допомогою CAPS-буфера (10 мМ 3- [циклогексиламіно] -1-пропансульфонової кислоти, рН 11; 10% метанолу). Наступні первинні антитіла були розведені в 1% реагенті, що блокує захід (Roche Diagnostics), розчиненому в TBS-T: анти-GAPDH (Гліцеральдегід-3-фосфатдегідрогеназа, 1: 10000, Тревіген), анти-NDUFS4 (NADH дегідрогеназа [убихінон]] залізо -сірковий білок 4; 1: 2000, Abcam), анти-SDHA (сукцинатдегідрогеназа [убихінон] флавопротеїнова субодиниця; 1: 5000, Abcam), анти-UQCRC2 (субодиниця комплексу цитохрому b-c1 2; 1: 1000, Sigma), анти-MTCO2 (субодиниця 2-оксидази цитохрому c; 1: 5000, Abcam), анти-ATP5A (субодиниця АТФ-синтази альфа; 1: 1000, Protein Tech), анти-SCOT (Succinyl-CoA: 3-кетокислотний кофермент А трансфераза 1; 1: 1000, Абнова). Вторинні антитіла, мічені пероксидазою хрону, використовували у розведенні 1: 1000 (Dako), а виявлення проводили за допомогою субстрату Lumi-Light POD (Roche).
Імуногістохімічне фарбування та аналіз
Комплекси OXPHOS (комплекс I-V) та індекси проліферації (Ki-67 та PHH3) оцінювали в депарафінізованих ділянках пухлини ксенотрансплантатів NB. Для імуногістохімічного фарбування використовували такі антитіла: анти-NDUFS4 (1: 1000, Abcam), анти-SDHA (1: 2000, MitoSciences), анти-UQCRC2 (1: 1500, MitoSciences), анти-MTCO2 (1: 1000, MitoSciences), анти-ATP5A (1: 2000, MitoSciences) та anti-VDAC1 (залежний від напруги білок аніон-селективного каналу 1; 1: 3000, MitoSciences), анти-Ki-67 (1: 200, Dako) та анти -PHH3 (1: 500, Cellmarque). Всі антитіла розбавляли в розчиннику антитіл Dako з фоноредукуючими компонентами (Dako). Процедури фарбування та скорингу для комплексів OXPHOS проводили, як повідомлялося раніше [17, 45]. Проліферацію оцінювали, оцінюючи частку позитивно забарвлених ядер, набираючи принаймні 500 клітин на слайд (Ki-67) або підраховуючи кількість позитивно забарвлених ядер на поле великої потужності (PHH3). Для всіх пухлин було оцінено принаймні п'ять репрезентативних областей, збільшення було в 400 разів.
Статистика
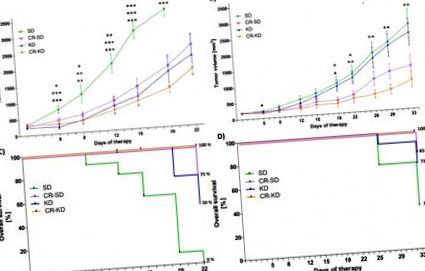
Статистичний аналіз для неперервних змінних проводили за допомогою одностороннього ANOVA (p рис. 1). У той час як клітинна лінія SH-SY5Y демонструє більш доброякісні характеристики та чутлива до хіміотерапії, клітинна лінія SK-N-BE (2) є високостійкою до широкого спектру хіміотерапевтичних засобів. Більше того, він відображає маркери поганого прогнозу, такі як ампліфікація NMYC, мутація TP53 та втрата гетерозиготності хромосоми 1р [48]. Ксенотрансплантати клітинної лінії SH-SY5Y зазнавали значного пригнічення росту у всіх трьох групах дієтичного втручання (рис. 1А). На 19 день середній об'єм пухлини в групі SD (3541 ± 219 мм 3) був значно збільшений порівняно з групою CR-SD (1884 ± 256 мм 3, p = 0,001), групою KD (1721 ± 478 мм 3, p 3 p 3 перед днем 22. Виживання мишей на SD на 22 день становило 0% порівняно з 75% на CR-SD (p Фіг. 1C). Зростання пухлини в групах дієтичних CR був суттєво пригнічений у SK-N-BE (2) ксенотрансплантати (CR-SD 1348 ± 345 мм 3, p = 0,040 та CR-KD 909 ± 240 мм 3 p = 0,004) у порівнянні з групою SD (2661 ± 418 мм 3). Ріст пухлини в KD група не суттєво змінилася (2395 ± 426 мм 3, p = 0,918) (рис. 1В). Виживання мишей з ксенотрансплантатами SK-N-BE (2) на SD на 33 день становило 36% порівняно з 83% на CR-SD (p = 0,017), 73% на KD (p = 0,09) та 100% на CR – KD (p Рис. 1).
Після встановлення пухлин на правому фланзі мишей CD-1nu мишей рандомізували в дієтичні групи, як зазначено. Об'єм пухлини вимірювали двічі на тиждень. A) Для ксенотрансплантатів SH-SY5Y на 19 день пухлини всіх груп дієти демонстрували значне пригнічення росту порівняно з групою SD (CR-SD p = 0,001, KD p 3, виразка пухлини або погіршення стану здоров’я. Дієтичні групи порівнюють з відповідний SD. * p≤0,05; ** p≤0,01; *** p≤0,001.
Дієтичне втручання індукує метаболічні адаптації
c Співвідношення глюкози в крові (BG, ммоль/л) до кетону крові (BK, ммоль/л), раніше повідомлялося як індекс кетону глюкози [60]. Кожна група n = 11. n.a .: не застосовується.
Індекси розповсюдження пропонують G0 або ранню зупинку G1 як механізм зниженого росту пухлини
Обидва типи клітин SH-SY5Y A) і SK-N-BE (2) C) демонструють постійні низькі копії мітохондріального геному (середнє значення Рис. 2, S1 та S2 Рис.). Комплексна ферментативна оцінка всіх окремих комплексів OXPHOS (I-V) та синтази лимонної кислоти (CS, що вказує на мітохондріальну масу) не показала суттєвої різниці порівняно з активністю відповідної групи SD (p> 0,05) (S1 та S2 Рис.).
Комплексний Вестерн-блот-аналіз OXPHOS та імуногістохімічне фарбування підтримують низьку ферментативну активність
Три репрезентативні зразки пухлин усіх груп дієти оцінювали на рівень складних I-V білків (рис. 4). Постійно низька ферментативна активність без суттєвих змін ферментативних рівнів підтверджується рівнями білка OXPHOS при аналізі вестерн-блот. Кількісна оцінка інтенсивності фарбування, скоригованої навантаженням, наведена на S3. Рис. Ксенотрансплантати обох типів клітин показують дуже низьку кількість CII. CI, CIII та CIV продемонстрували тенденцію до підвищення рівня білка в групі CR-KD клітинної лінії SH-SY5Y. Рівні білка CV пухлин SH-SY5Y та ДІ пухлин SK-N-BE (2) не відображали відповідних ферментативних дій. Це може відображати низьку ферментну активність, яка не пов'язана зі стабільністю білка аналізованої субодиниці.
По три зразки від кожної дієтичної групи завантажували, як зазначено вгорі (SD, CR-SD, KD та CR-KD). Репрезентативні субодиниці CI-CV були досліджені, як показано зліва. Обидва типи клітин демонструють стабільну знижену регуляцію ІСІ, при цьому інші комплекси відносно більш збережені на рівні білка. GAPDH відображається як контроль завантаження. В якості контролів (cont1 та cont2) використовували кору нирки, як описано в [3]. Кількісна оцінка інтенсивності фарбування з урахуванням навантаження наведена на S3 Рис.
Імуногістохімічний аналіз окремих комплексів OXPHOS (I-V), проведений на ксенотрансплантатах SH-SY5Y, виявив значне зменшення забарвлення комплексу I у групі CR-KD порівняно з групою SD (рис. 5; p (53K, pdf)
- Кетогенна дієта як допоміжна терапія при лікуванні пухлини порожнини рота (P05-020-19)
- Високий кров'яний тиск, спричинений кетогенною дієтою та щоденними форумами з діабету кокосової олії
- Як кетогенна дієта може впливати на склад тіла Блог KetoDiet
- Огляд Івана (Загреб, Хорватія) про приготування їжі з кето-їжі 2018 р. Основна підготовка до дієтичного кетогенного харчування
- Лист до редактора на тему «Порівняння ефективності класичної кетогенної дієти та модифікованої дієти Аткінса