Холестаз матері та метаболічні відхилення у нащадків
Папаклеовулу та його колеги демонструють, що холестаз матері під час вагітності пов'язаний із ожирінням нащадків та порушенням метаболізму як у людей, так і у мишей. Це дослідження підкріплює переважні докази критичної ролі внутрішньоутробного середовища як головного чинника, що визначає здоров’я та захворювання дорослих.
Внутрішньопечінковий холестаз вагітності (ВЧД), який діагностується за підвищеним рівнем жовчних кислот у сироватці крові у матері та пов’язаний із сверблячкою, вражає 0,5–2,0% вагітних і виникає, як правило, у третьому триместрі вагітності. 1 Папаклеовулу та ін. 2 використовували дані когорти народжень із Північної Фінляндії та мишачої моделі підвищеного рівня жовчних кислот у сироватці крові під час вагітності та показали, що в обох випадках ВЧТ у матері асоціювалася із підвищеною сприйнятливістю потомства до ожиріння та діабетичним фенотипом. Крім того, внутрішньоутробний внутрішньоклітинний показник асоціювався з підвищенням концентрації холестерину в пуповині, плоді та плаценті нащадків. Ці висновки наводять авторів на висновок, що підвищений транспорт трансплацентарного холестерину, ймовірно, сприяє метаболічним відхиленням у потомства матерів з ВЧД. 2
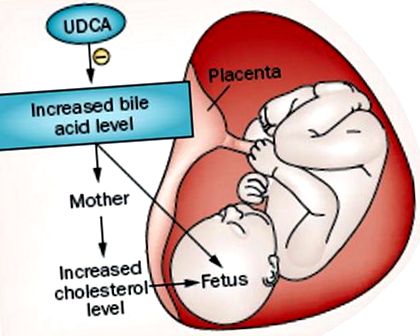
Холестаз матері та аномалії ліпідів плода. Внутрішньопечінковий холестаз вагітності у матері (ВЧД) призводить до збільшення передачі жовчних кислот від матері до плоду. Оскільки плід знижує здатність елімінувати жовчні кислоти через плаценту, жовчні кислоти накопичуються в сироватці пуповинної крові, меконії та навколоплідних водах. Крім того, результуючий підвищений рівень холестерину у матері разом із збільшенням трансплацентарного транспорту призводять до підвищення рівня холестерину у плода. Лікування урсодезоксихолевою кислотою (UDCA) знижує рівень жовчних кислот у материнській сироватці та її проходження до плоду.
Щоб зрозуміти вплив материнського холестазу на потомство, Papacleovoulou et al. 2 здійснили комплексний підхід, дослідивши тканини матері, плаценти, плоду та/або новонароджених як у людей, так і у мишей. Використовуючи дані когорти немовлят, народжених у Північній Фінляндії між 1985 і 1986 рр., Вони виявили 7808 контрольних вагітностей (в результаті 4034 немовляти чоловічої статі та 3774 жіночої статі) та 45 нелікованих вагітностей ПМС (в результаті 27 немовлят чоловічої та 18 жіночої статі); у матерів не було інших метаболічних ускладнень, таких як цукровий діабет або ожиріння. Вага при народженні та плаценті, включаючи частку передчасних пологів, був порівнянний між ВЧД та контрольною вагітністю. Однак у віці 16 років у чоловіків у дітей, які перенесли ІСП, спостерігався підвищений ІМТ та рівень інсуліну натощак, тоді як у жінок жіночої статі спостерігався порівнянний ІМТ, хоча зі збільшенням обхвату стегон і талії та зниженням рівня холестерину ЛПВЩ у порівнянні з відповідними аналогами при нормальній вагітності.
Важливо, що дослідники встановили мишачу модель материнської гіперхоланемії (підвищений рівень жовчних кислот у сироватці крові) для подальшого вивчення зв'язку між холестазом матері та сприйнятливістю нащадків до метаболічних відхилень. Миші отримували або звичайну дієту чау, або дієту, доповнену 0,5% холевою кислотою (основною печінковою жовчною кислотою) до і протягом вагітності. Після пологів усіх годуючих мишей годували нормальним харчуванням, а потомство відлучували (у віці 3 тижнів) до нормального харчування. У віці 12 тижнів потомство або продовжували нормальну дієту, або їли західну (з високим вмістом жиру) дієту протягом 6 тижнів.
На 18 день вагітності вагітним мишам з добавкою холіну підвищений рівень жовчної кислоти в сироватці крові та печінці (холестатичний фенотип) та рівень холестерину без інших відхилень. Подібно до висновків людини, не спостерігалось відмінностей у тривалості гестації або вазі народження між мишами, народженими від матерів з гіперхоланемією або без неї. Крім того, у дорослих нащадків матерів із холестазом, які харчувались нормальним харчуванням, не було виявлено порушень обміну речовин або ожиріння ні у чоловіків, ні у жінок серед 18 тижнів. Однак, коли їм кидали виклик із західною дієтою, жінки, які зазнали холестазу у жінок, виявляли ожиріння та діабетичні особливості порівняно з жінками із нормальної вагітності, які харчувались західною дієтою. Аналіз мікрочипів печінки та жирової тканини показав посилення запальної реакції. На відміну від самок мишей, самці мишей, які зазнали холестазу матері та годувались західною дієтою, не виявляли явних метаболічних відхилень.
Плацентарні дослідження на людях та мишачі моделі показали, що материнський холестаз посилює біосинтез та транспорт ліпідів у фетоплацентарній одиниці. Загальні дані свідчать про те, що холестаз матері в основному підвищує рівень холестерину у матерів, плаценти та плоду, а також те, що жіночі нащадки, які зазнали холестазу матері, мають більшу схильність до метаболічних відхилень при висококалорійній та жирній дієті. Шкідливий вплив материнського холестазу на потомство узгоджується з результатами попереднього дослідження, що демонструє стійкі змінені рівні жовчних ліпідів та секрецію жовчних кислот у щенят щурів 4-тижневого віку. 7
Для подальшого дослідження впливу холестазу матері на епігеном потомства Папаклеовулу та ін. використовував життєздатну жовту модель миші agouti (Avy), у якій варіація кольору шерсті корелюється з епігенетичними позначками. Тихий алель гіперметильований і утворює шерсть дикого типу агуті (псевдоагуті), тоді як активний алель гіпометильований і утворює повністю жовту шерсть. Криптичний промотор у проксимальному кінці Ivy IAP сприяє конститутивній позаматковій транскрипції Агуті не тільки у волосяних фолікулах, але й у всіх клітинах, що призводить до появи жовтого хутра, а також ожиріння та діабету у дорослих. Папаклеовулу та ін. показали, що миші Avy годували дієту з добавкою холевої кислоти до і протягом усього періоду виношування плоду, і при цьому породжували жіноче потомство з коричневою шерстю і чоловіче потомство з жовтою шерстю, і що колір шерсті відповідав статусу метилювання криптичного промотора IAP. 2
Незважаючи на цікаві результати, дослідження Papacleovoulou et al. має ряд обмежень. Автори припускають, що передбачуваним фактором програмування в будь-якій з моделей є рівень холестерину або жовчних кислот у плода. Рівень холестерину у матері помітно підвищується під час вагітності, відіграючи важливу роль у виробництві плаценти та плоду. 8 Механізм, за допомогою якого підвищення рівня холестерину у плода може запрограмувати метаболічне здоров'я нащадків, незрозумілий. Більше того, гени, що регулюють біосинтез холестерину та шляхи гомеостазу жовчних кислот, виглядають незмінними (профіль транскриптома) у дорослих нащадків жіночої статі, які зазнали холестазу матері та отримували західну дієту. Що стосується жовчних кислот, то дослідники повідомляють про рівень жовчної кислоти у мишей плоду в ммоль/л, тоді як нормальний або підвищений (тобто ICP) рівень людини вимірюється в мкмоль/л. 9 Таким чином, порівняно високі концентрації жовчних кислот у моделі миші піднімають важливе питання щодо того, є модель миші фізіологічною чи фармакологічною. Тим не менше, епігенетичні результати вказують шлях (и), за допомогою якого підвищений рівень жовчних кислот може змінити ключові метаболічні параметри.
У дослідженні на людях дослідники не надають даних про рівень жовчних кислот у матері та про зв’язок між тривалістю, періодом вагітності та рівнем жовчних кислот до метаболічних відхилень у нащадків. У людей хлопчики були більш сприйнятливі до метаболічних збурень, ніж дівчата, тоді як самки мишей були більш сприйнятливі, ніж миші-самці. ВЧД зазвичай відбувається в третьому триместрі; однак у моделі миші підживлення жовчі починалося ще до вагітності. Хоча лікування UDCA полегшує материнські симптоми, знижує рівень жовчних кислот у пуповинній крові та навколоплідних водах і може поліпшити результат плоду, 4 не проводилось жодних досліджень, щоб встановити, чи може терапія UDCA запобігти або змінити потенційне метаболічне програмування у людей.
Підсумовуючи, ці дослідження дають нове розуміння різноманітності потенційних внутрішньоутробних факторів, які можуть вплинути на програмування потомства. Додаткові дослідження механізмів, основи для специфічних для статі ефектів, лікування та збурення потомства (наприклад, вплив молочних жовчних кислот 10) внесуть важливий внесок у наше розуміння ефектів ВЧД та шляхів метаболічного програмування.
Виноски
Конкуруючі інтереси
Автори декларують відсутність конкуруючих інтересів.
- Вплив матері на синтетичні хімічні речовини та ожиріння у нащадків Недавні результати SpringerLink
- Ожиріння матері впливає на потомство науки
- Дієта з високим вмістом цукру у матері змінює вразливість нащадків до відновлення пошуку кокаїну
- Дієта з високим вмістом жиру у матері порушила одновуглецевий метаболічний процес та епігенетичну регуляцію в
- Ожиріння матері та діабет викликають приховані дефекти метаболізму та широкі епігенетичні зміни в