Харчування, хвороби та основні молекулярні механізми
Аамер М. Казі 1,2, Рабія Табасум 1, Фатіма Аршад 1, Айша Шаукат 1, Варда Казі 1, Мухаммед Тахір Джаваїд 1,2, Абдул Манан 2
Внески: (I) Концепція та дизайн: А. М. Казі; (II) Адміністративна підтримка: А. М. Казі; (III) Надання навчальних матеріалів або пацієнтів: А. М. Казі, Р. Табассум, В. Казі, М. Т. Джайід, А. Манан; (IV) Збір та збір даних: А. М. Казі, Ф. Аршад, А. Шаукат; (V) Аналіз та інтерпретація даних: А. М. Казі, Р. Табассум, М. Т. Джаваїд, А. Манан; (VI) Написання рукописів: Усі автори; (VII) Остаточне затвердження рукопису: Усі автори.
Анотація: Хоча низка факторів може впливати на регуляцію, точність та ефективність життєво важливих біологічних шляхів, не можна ігнорувати роль дієти/харчування. Харчування забезпечує енергією та сировиною необхідні життєві процеси. Збалансоване харчування призводить до здорового результату не тільки на системному, але й на клітинному та молекулярному рівнях. Здорова їжа також може суттєво вплинути на відновлення та оздоровлення в біологічній системі. Однак певні типи та кількість дієт також є фактором ризику для різних захворювань. Сучасна дієта, а також відсутність фізичної активності впливають на загальну динаміку захворювань. Нутрігеноміка виявила функціональну взаємодію між поживними речовинами (макроелементами та мікроелементами) та окремими геномами. Ця стаття оглядає недавню наукову літературу, щоб зрозуміти, чи і як харчування може допомогти у підтримці цілісності геному, правильному імунному нагляді та профілактиці раку.
Ключові слова: Запалення; рак; Пошкодження ДНК; поживні речовини; нутрігеноміка; нутригенетика
Отримано: 06 квітня 2019 р .; Прийнято: 07 лютого 2020 р .; Опубліковано: 15 червня 2020 р.
Вступ
Дієта не тільки необхідна для виживання живих організмів, але тип раціону та кількість дієти впливає на ефективність, точність і тривалість життя різних біологічних систем, а також загальний стан здоров’я та тривалості життя живого організму.
Старіння
Нервова система
Печінка
Поживні речовини допомагають життєво важливим клітинним процесам
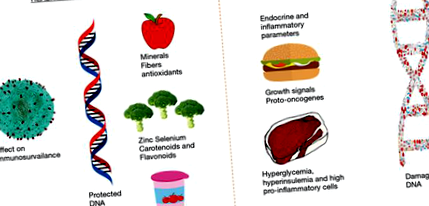
Синтез будівельних блоків необхідний для життєво важливих реакцій нашого організму. Оскільки харчування забезпечує енергією та сировиною для цих будівельних блоків, тип дієти відіграє важливу роль у життєво важливих клітинних процесах. Наприклад, вітамін А є важливою поживною речовиною для здорових очей, а кальцій необхідний для міцності кісток. Вітаміни В3, В12 та фолієва кислота в достатній кількості необхідні для синтезу ДНК (22). Нестача цих вітамінів призводить до поганого виробництва ДНК, що може вплинути на підтримку геномної цілісності, стабільності та життєздатності клітин. Багато інших поживних речовин відіграють важливу роль, наприклад, цинк важливий для формування пальцеподібної структури ДНК (23), а селен відіграє важливу роль як компонент певних генів супресорів пухлини (24,25) (рис. 1). Дефіцит фолієвої кислоти пов'язаний з низкою відхилень, включаючи генетичні пошкодження, передчасне старіння, хвороби серця та певні типи раку (26). Дефіцит вітаміну D може призвести до остеопорозу, а також пов'язаний із такими захворюваннями, як рак (27), діабет (28,29) або розсіяний склероз (30).
Вплив дієтичних факторів на запалення, пошкодження та цілісність ДНК
ДНК може пошкоджуватися різними способами, перешкоджаючи нормальній активності генів. Пошкодження може включати вільні радикали, помилку реплікації в ДНК або помилку транскрипції; старіння та зморшкувата шкіра - ознаки пошкодження ДНК. Пошкодження ДНК може відбуватися у всіх органах з різною швидкістю, що збільшує ймовірність системних відхилень (31,32).
Нестабільні молекули, такі як вільні радикали, відповідають за старіння та пошкодження ДНК. Вільні радикали утворюються в організмі як побічний продукт різних біохімічних процесів, таких як розщеплення їжі, інфекція та детоксикація небезпечних хімічних речовин. Деякі забруднюючі речовини, такі як сигаретний дим, вихлопні гази автомобілів, випаровування копіювальних машин та деякі інші вільні забруднювачі повітря. УФ-випромінювання та рентгенівські промені також відповідають за утворення вільних радикалів. Різні теорії говорять про те, що кожна клітина тіла здатна генерувати тисячі вільних радикалів. Шкода вільних радикалів з'являється лише у віці двадцяти семи років. Після цього починає з’являтися збиток вільних радикалів. Зі збільшенням кількості вільних радикалів вони накопичуються в різному положенні на ДНК. Шкода від куріння сигарет знаходиться в легенях, де може відбутися високий рівень мутації ДНК (33,34).
Мітохондрії залежать від більшості систем окисного фосфорилювання (OXPHOS) для ядерного геному, а також використовуються для підтримки та реплікації мітохондріальної ДНК (mtDNA), а також проліферації та деструкції органел (35). Коли відбувається пошкодження ДНК, це викликає різні відхилення, наприклад, відшарування та подальшу мітохондріальну аутофагію, втрату відновлення ДНК, гістопатологію та інші дегенеративні інфекції (36). Таким чином, пошкодження геному мітохондрій призводить до шкідливих стабільних змін та порушення цілісності. Тому підтримка цілісності мтДНК є основою здорового життя. Харчування може зіграти вирішальну роль у контролі цілісності мтДНК та збільшенні тривалості життя.
Недоїдання та пошкодження ДНК
Голод і недоїдання є однією з найбільш переважних проблем, з якими стикаються кілька країн. Близько 30% людей страждають від однієї або декількох форм голоду (37). Страшні наслідки недоїдання полягають у смерті, втраті працездатності та приголомшеному розумовому та фізичному зростанні. Серед дітей у розвинених країнах близько 60% із 10,9 мільйона смертей на рік визначаються відсутністю здорового харчування (38). До основних причин недоїдання належать бідність та нерівність. Планування харчування може усунути лише ті причини, які вимагають політичних та соціальних дій. Різні харчові добавки протидіють хворому здоров’ю, а також зменшують різні хронічні відхилення (39).
Зв'язок між дієтою та геномною нестабільністю свідчить про важливий або профілактичний вплив різних дієтичних факторів. Пошкодження ДНК, епігеном та рівень хромосом є основними причинами порушень розвитку та дегенерації. Сотні генів ускладнюють і підтримують геномну цілісність (40). Білок, кодований трансляцією ДНК та відновленням ДНК або детоксикацією потенційно генетичних токсинів, покладається на кофактори, необхідні для оптимальної функції, присутні в раціоні (41). Надмірну геномну нестабільність, спричинену дефіцитом мікроелементів, можна діагностувати за допомогою біомаркерів, що пошкоджують ДНК, і може оптимізувати стан харчування за рахунок зменшення рівня пошкодження геноміки та епігенома після діагностичного втручання (42).
Фолієва кислота, B-комплекс та інші мінерали в процесі синтезу та відновлення ДНК
Мікроелементи (вітаміни та мінерали) необхідні як кофактор для білка, пов’язаного із синтезом та відновленням ДНК, протидіючи окислювальному пошкодженню ДНК. Будь-який дефіцит мікроелементів, таких як фолієва кислота, B-комплекс, залізо, цинк та інші мінерали, призводить до цитотоксичного ураження або окисного пошкодження. Нестача мікроелементів може призвести до пошкодження ДНК, злоякісного росту та інших дегенеративних аномалій (43). Недостатність фолієвої кислоти спричинює накопичення урацилу в ДНК людини, що спричиняє хромосомні розриви. Такі хромосомні розриви є потужним прогностичним фактором для раку людини. Дефіцит фолієвої кислоти може бути основною причиною гострого лімфобластного лейкозу. Введення фолієвої кислоти може переломити високий рівень урацилу ДНК у людини та розриви хромосом (44). Як і дефіцит фолатів, дефіцит В12 призводить до накопичення урацилу в ДНК та хромосомних розривах. Ці два дефекти можуть зіграти синергетичну роль. Дослідження показали, що добавки В12 важливі для обмеження розривів хромосом (45). Недостатність В6 характеризується інсультом та атеросклерозом, а також пов'язана з хромосомними розривами. Добавки В6 зменшують ці ризики (46).
Ніацин (вітамін B3) допомагає усунути дефекти розриву ДНК, підтримуючи рівень нікотинаміду аденіндинуклеотиду (NAD), тим самим підтримуючи реакцію рибози плазми-АДФ на пошкодження ДНК (47). Дефіцит ніацину може погіршити пробіли та відновлення ДНК, тому очікується, що синергічна дія дефіциту фолатів та антиоксидантів спричинить пошкодження ДНК та злоякісне зростання (48). Селен необхідний для стійкості ферментів до окислювачів, а недостатня кількість селену може спричинити окисне пошкодження ДНК. Селен відіграє важливу роль у профілактиці раку (49). Дефіцит цинку є причиною раку стравоходу людини. Наслідками є збільшення окислення ДНК, розрив ДНК та збільшення хромосомних пошкоджень (50).
Ожиріння, артроз та метаболічний синдром
Зміна способу життя та впливу навколишнього середовища є основними факторами патогенезу та метаболічного синдрому. Більше того, на ожиріння та метаболічний синдром, пов’язані із запаленням, дисліпідемією та інсулінорезистентним або повністю розвиненим діабетом та підвищеним ризиком серцево-судинних розладів, також впливає генетична сприйнятливість (51). Такі метаболічні фактори можуть збільшити ризик розвитку остеоартриту, спричиненого ожирінням (52). Ожиріння переважно є природним наслідком надмірного харчування та малорухливого способу життя. Постійне ожиріння може дерегулювати метаболічні процеси і суттєво впливає на процес контролю рівня цукру в крові, артеріального тиску та ліпідів у крові, тому його називають метаболічним синдромом (53). Ожиріння також вважається фактором ризику розвитку артрозу. Це може бути пов’язано з різним в’яжучим механізмом, що веде до руйнування хряща. Незважаючи на це, останні досягнення показали, що жирові клітини створюють велику кількість елементів, званих адипокінами, які відіграють ключову роль у розвитку та прогресуванні артрозу (54).
Попкін і Доак (55) повідомили, що в ряді розвинутих країн поширеність ожиріння зросла з 2,3% до 19,6% за останні 10 десятиліть. Рівень ожиріння на Близькому Сході, острові Тихого океану, Австралії та Китаї зріс з 1980 року (56). За підтримки урядової та законодавчої роботи різні стратегії охорони здоров’я, що складаються з індивідуальних та громадських ініціатив, також допоможуть мінімізувати частоту ожиріння та порушення обміну речовин у країнах, що розвиваються.
Гіпотрофія, запалення та імунодефіцит
Мікробні захворювання клітин ініціюють провокаційну реакцію. Основне враження від хвороби опосередковується вродженими рецепторами розпізнавання образів (PRR), які містять Toll-подібний рецептор (TLR), RIG-подібні рецептори (RLR), NOD-подібні рецептори (NLR) та рецептори лектину С-типу (CLR). Цей внутрішньоклітинний сигнальний каскад, активований цими PRR, викликає експресію транскрипції для усунення патогенів та інфікованих клітин. Однак ця система аномально активується внаслідок індукції аутоімунітету та імунодефіциту (57).
Дефіцит недоїдання є причиною вторинного дефіциту, наприклад, недоїдання білка впливає на опосередкований клітинами імунітет, фагоцитоз і споживання мікроорганізмів є незмінними, але здатність фагоцитарних клітин вбивати внутрішньоклітинні організми порушується. Нестача харчування може призвести до раку, хронічних захворювань нирок, множинних травм та хронічних інфекцій. Дефіцит цинку та заліза чинить різноманітний вплив на імунітет, включаючи уповільнене зменшення шкірної гіперчутливості.
Вітамінні добавки (В6, В12), селен та мідь також важливі для імунної системи. В даний час вважається, що окислювальний стрес пов'язаний з усіма провокаційними захворюваннями (запалення суглобів, васкуліт, гломерулонефрит та респіраторні захворювання дорослих), ішемічними захворюваннями, СНІДом, емфіземою, трансплантацією органів, виразкою шлунка, високим кров'яним тиском, неврологічними розладами (хвороба Альцгеймера, хвороба Паркінсона, м’язова дистрофія) тощо (61). Окислювальний стрес виникає через порушення між антиоксидантним захистом та виробленням вільних радикалів. Вище продукування АФК в організмі може змінити структуру ДНК, що призведе до модифікації білків та ліпідів, активації індукованих факторів транскрипції та продукування прозапальних та протизапальних цитокінів (62). Антиоксидант може зменшити окислювальний стрес, безпосередньо знищуючи АФК або пригнічуючи проліферацію клітин. B-каротин запобігає канцерогенезу, спричиненому УФ. β-каротин може мати протипухлинний вплив, змінюючи метаболізм печінки збудників раку (63).
Вітаміни С допомагають запобігти раку. Його механізм може впливати на канцерогенез через його антиоксидантний характер, блокує утворення нітрозамінів, посилює імунну відповідь та прискорює процес детоксикації печінки (64). Вітаміни Е - основний антиоксидант, який збільшує рідину в організмі, вироблення антитіл, антибактеріальну інфекцію, опосередкований клітинами імунітет, Т-лімфоцити, фактор некрозу пухлини (ФНО), інгібування утворення мутагенів, відновлення мембран та блокування утворення мікроклітинних ліній. Отже, вітамін Е може використовуватися для попередження злоякісного росту та придушення канцерогенезу, стимулюючи імунну систему (65). Отже, харчування може допомогти розширити запальну реакцію до меж впливу патогенних мікроорганізмів, токсинів та пошкодження тканин. Такі дієтичні компоненти, як вітаміни, антиоксиданти, рослинні флавоноїди, пребіотики та пробіотики, можуть змінити сприйнятливість хронічного запалення і можуть допомогти в лікуванні.
Різні типи поживних речовин впливають на продуктивність ДНК. Кілька поживних речовин, таких як цинк, фолієва кислота, вітамін D, флавоноїди та каротиноїди, впливають на здоров'я ДНК. Різні вітаміни впливають на здоров’я ДНК, такі як вітамін А впливає на ріст і диференціацію клітин. Комплекс вітаміну В бере участь у відновленні, синтезі та регуляції ДНК. Іншими важливими вітамінами є вітамін С, D та Е. Такі мінерали, як цинк, хром та селен, важливі для здоров'я ДНК (66,67).
Дія дієтичних добавок на рак
Виявлено кількість генів, які спричиняють рак, і можуть бути придушені за допомогою різних механізмів. Ген p53 є одним з генів супресорів раку. Ген p53 бере участь у пригніченні ракових клітин при активації. Мутації гена p53 виявлені у понад п'ятдесяти типах раку. Іншими факторами, що беруть участь, є фолієва кислота та селен, які допомагають підтримувати нормальну активність та генетичну стабільність p53. Інший ген, GST, який кодує ферменти глутатіон-S-трансферази, також бере участь у запобіганні раку. Він діє як антиоксидант, який допомагає захистити від пошкодження вільними радикалами. Він також забезпечує захист від руйнування небезпечних хімічних речовин. Поліморфізм VDR (рецептора вітаміну D) також пов'язаний з підвищеним ризиком раку молочної залози, передміхурової залози та товстої кишки (68-70).
Певною мірою рак можна контролювати за допомогою різноманітних стилів життя та харчових добавок. Овочі та фрукти забезпечують низький ризик розвитку більшості видів раку. Трави є багатим джерелом антиоксидантів, які допомагають захистити пошкодження ДНК. Ще одним потужним антиоксидантом є глутатіонпероксидаза, а його важливим компонентом є селен. Ці молекули селену захищають ДНК від вільних радикалів. Натуральний сукцинат, форма вітаміну Е, має потужний протипухлинний ефект (71). Процеси відновлення ДНК та придушення онкогенів підтримуються вітамінами В6 та В12. Коферменти Q10 - це така, як вітамін, поживна речовина, яка діє як захисний антиоксидант. Це посилює активність імунних клітин для боротьби з раковими клітинами (72). Для лікування раку деякі лікарі, орієнтовані на харчування, використовують велику кількість вітамінів та мінералів у поєднанні з іншими звичайними медичними методами лікування. Рак шийки матки лікували за допомогою вітаміну Е, коферменту Q10, вітаміну С, бета-каротину, змішаних каротиноїдів та вітаміну А у поєднанні з медичною терапією. Ці поживні речовини не впливають на рак, але стимулюють імунну систему пацієнта для боротьби з раковими клітинами (73).
Висновок
Природні антиоксиданти в дієті відіграють вирішальну роль у багатьох метаболічних шляхах, що впливають на прогресування захворювання. Дієта на рослинній основі, фрукти та овочі, є багатим джерелом клітковини, антиоксидантів та здорових жирних кислот, що пов'язано зі зниженням ризику будь-яких розладів. Багато речовин, що містяться у фруктах та овочах, мають захисну природу для біологічної системи. Отже, цілий ефект, швидше за все, не буде зумовлений якимись окремими фітохімічними речовинами чи поживними речовинами.
Такі компоненти збалансованої дієти, як біоактивні сполуки, можуть змінити експресію гена, який може регулюватися вгору або вниз. Вживання поживних речовин вважається значним для зменшення ризику виникнення захворювання на основі генетичного профілю людини. Нутригенетика/геноміка можуть застосовуватися для маніпуляцій з персоналізованою дієтою для кожного пацієнта. Кілька досліджень повідомляють про зміну метаболізму при всіх розладах, особливо при раку, що свідчить про високе використання метаболічної енергії разом із підвищеним продукуванням АФК. Молекули їжі діють як ліганд проти кількох цілей у біологічній системі. Ці мішені можуть бути як позаклітинними, так і внутрішньоклітинними.
Подяка
Виноска
Провенанс та експертна перевірка: Ця стаття була замовлена запрошеними редакторами (Масуд А. Шаммас, П’єрфранческо Тассоне та Бісвесвар Нанді) для серії "Геномна нестабільність, клональна еволюція та онкогенез", опублікованої в Precision Cancer Medicine. Стаття надіслана на зовнішню експертну оцінку, організовану запрошеними редакторами та редакцією.
Конфлікт інтересів: Усі автори заповнили єдину форму розкриття інформації ICMJE (доступна за адресою http://dx.doi.org/10.21037/pcm.2020.02.01). Серія «Геномна нестабільність, клонова еволюція та онкогенез» була замовлена редакцією без будь-якого фінансування та спонсорської допомоги. Автори не мають заявляти про конфлікт інтересів.
Етична заява: Автори несуть відповідальність за всі аспекти роботи, забезпечуючи належне дослідження та вирішення питань, що стосуються точності або цілісності будь-якої частини роботи.
- Публічна лекція - дієта; Хвороба Вивчення взаємозв'язку між харчуванням та раком - холод
- SNR # 169 Чад Макіас - метаболізм раку; Обережність щодо кетогенних дієт; Sigma Nutrition
- Дитяча гастроентерологія та харчування Медицина Weill Cornell
- Білковий рецепт; Nutrition Precision Nutrition; s Енциклопедія їжі
- Інтерв’ю за круглим столом 3 людини, яких ви повинні послухати, частина 1 Точне харчування