Гістологічний та ультраструктурний вплив кавітації, викликаної ультразвуком, на жирову тканину шкіри людини
Даніеле Бані
З * кафедри експериментальної та клінічної медицини, секції анатомії та гістології (відділення гістології), Університет Флоренції, Флоренція, Італія; † Відділ пластичної хірургії та ‡ Відділ загальної хірургії, Відділення хірургії та трансляційної медицини, Флоренцкий університет, Флоренція, Італія.
Алессандро Кватріні Лі
З * кафедри експериментальної та клінічної медицини, секції анатомії та гістології (відділення гістології), Університет Флоренції, Флоренція, Італія; † Відділ пластичної хірургії та ‡ Відділ загальної хірургії, Відділення хірургії та трансляційної медицини, Флоренцкий університет, Флоренція, Італія.
Джанкарло Фрескі
З * кафедри експериментальної та клінічної медицини, секції анатомії та гістології (відділення гістології), Університет Флоренції, Флоренція, Італія; † Відділ пластичної хірургії та ‡ Відділ загальної хірургії, Відділення хірургії та трансляційної медицини, Флоренцкий університет, Флоренція, Італія.
Джулія Ло Руссо
З * кафедри експериментальної та клінічної медицини, секції анатомії та гістології (відділення гістології), Університет Флоренції, Флоренція, Італія; † Відділ пластичної хірургії та ‡ Відділення загальної хірургії, Кафедра хірургії та трансляційної медицини, Флоренцкий університет, Флоренція, Італія.
Анотація
Передумови:
В естетичній медицині найбільш перспективні методи неінвазивної скульптури тіла засновані на індукованій ультразвуком кавітації жиру. Ліпоредуктивні ультразвукові пристрої забезпечують клінічно значуще зменшення підшкірного жиру без значних побічних реакцій. Це дослідження має на меті оцінити гістологічні та ультраструктурні зміни, викликані ультразвуковою кавітацією на різних клітинних компонентах шкіри людини.
Методи:
Контрольні та оброблені ультразвуком зразки шкіри на повну товщину черевної порожнини та біоптати шкіри у пацієнтів, попередньо оброблених ультразвуковою кавітацією або без неї, вивчали гістологічно, морфометрично та ультраструктурно для оцінки можливих змін розміру і морфології адипоцитів. Також аналізували апоптоз адипоцитів та вивільнення тригліцеридів. Клінічну оцінку ефектів 4-тижневого ультразвукового дослідження проти фіктивних процедур проводили методом плікометрії.
Результати:
Порівняно з підробленими контрольними зразками, ультразвукова кавітація викликала статистично значуще зменшення розміру адипоцитів (Р 1) зростає попит на неінвазивні методи зменшення жиру, які є настільки ж ефективними, але при цьому комфортними та безпечними з мінімальним простоєм. Різні фізичні процедури, включаючи механічний масаж, електростимуляцію, радіочастотне випромінювання та "холодне" низькорівневе лазерне опромінення, були досліджені на предмет здатності викликати локалізоване зменшення жиру. 2–5 Однак при клінічному тестуванні більшість із них не виправдали очікувань, а деякі також порушили питання безпеки
Незважаючи на їх безсумнівну клінічну ефективність, біологічні механізми, що лежать в основі спостережуваних ліпоредуктивних ефектів, до кінця не вивчені. Було показано, що кавітація жирових клітин може спричинити вогнищеві зміни плазматичної мембрани та витік ліпідів, 15 але мало відомо про можливий шкідливий вплив ультразвуку на адипоцити, інші типи клітин жирової тканини (кровоносні судини та тучні клітини), та сусідні тканини, пересічені ультразвуковим пучком (епідерміс та дерма).
Поточне дослідження було розроблене для оцінки та кількісної оцінки гістологічних та ультраструктурних змін, викликаних ультразвуковою кавітацією на різних клітинних компонентах підшкірного жиру людини - тобто адипоцитах, клітинах судин та периваскулярних тучних клітинах - і верхніх тканинах шкіри, тобто шкірні фібробласти та епідермальні кератиноцити. З цією метою були використані зразки шкіри повної товщини ex vivo, взяті під час хірургічного втручання, та підшкірні біопсії підроблених та оброблених ультразвуком ділянок шкіри у окремих пацієнтів.
МАТЕРІАЛИ І МЕТОДИ
Це дослідження відповідало керівним принципам Гельсінської декларації із змінами, внесеними в Единбурзі, 2008 р. Його було схвалено Етичним комітетом медичного факультету Університету Флоренції, Італія. Усі випробувані дали письмову інформовану згоду на свою участь у дослідженні.
Дослідження Ex Vivo
Для морфометричного аналізу розміру адипоцитів цифрові мікрофотографії напівтинових зрізів товщиною 2 мкм були зроблені під світловим мікроскопом (Microstar IV, Райхерт, Зеефельд, Німеччина), оснащеному відеокамерою з високою роздільною здатністю Eurekam-9 та програмним забезпеченням (BEL Engineering, Monza, Італія). З кожного зразка було зібрано 10 випадково обраних мікрофотографій, кожна відповідала тестовій площі 65 700 мкм 2. Площу поверхні поперечних розрізів вакуолей ліпідів адипоцитів вимірювали за допомогою програми аналізу зображень ImageJ 1.33 (http://rsb.info.nih.gov/ij), після встановлення відповідного порогу, щоб включати лише осміофільні ліпідні вакуолі адипоцитів. Вакуолярні профілі ≤ 1000 мкм 2, що відповідають полярним перерізам, були виключені. Дані були представлені як середні значення (± SEM) контрольної та обробленої груп.
Для просвічувальної електронної мікроскопії надтонкі зрізи фарбували водним уранілацетатом та лужним субнітратом вісмуту, переглядали та фотографували під просвічуючим електронним мікроскопом JEM 1010 (Jeol, Токіо, Японія), оснащеному цифровою камерою MegaView III із високою роздільною здатністю та програмним забезпеченням для зображень (Jeol ). Різні компоненти підшкірної жирової тканини, тобто адипоцити, мікросудини крові та інтерстиціальна стома, у контрольних та оброблених ультразвуком зразках були ретельно досліджені та порівняні.
Вимірювання вивільнення тригліцеридів проводили в невеликих обсягах кондиціонованого середовища, взятого через 1, 15, 30 та 60 хвилин після ультразвукової або фіктивної обробки шкірних експлантів (n = 3). З цією метою було використано аналіз TRIG (ADVIA Chemistry, Bayer, CH). Значення, в мг/дл, нормалізували до маси зразка шкіри і виражали як мкг/мг тканини (волога вага), вважаючи Р ≤ 0,05 як значущу.
Дослідження in vivo
Статистичний аналіз
Проаналізовані кількісні параметри статистично аналізували, приймаючи окремих пацієнтів як одиниці вибірки (n = 3). Для морфометрії адипоцитів та аналізу TUNEL статистичну значимість відмінностей між групами оцінювали за допомогою непарного t-критерію Стьюдента. Криві часових показників рівнів тригліцеридів у кондиціонованому середовищі контрольних та оброблених ультразвуком зразків та плікометричних вимірювань дослідження in vivo порівнювали за допомогою двостороннього дисперсійного аналізу. В обох випадках використовувалося статистичне програмне забезпечення Graph Pad Prism 4.03 (GraphPad, Сан-Дієго, Каліфорнія). Значення P ≤ 0,05 вважалося значущим.
РЕЗУЛЬТАТИ
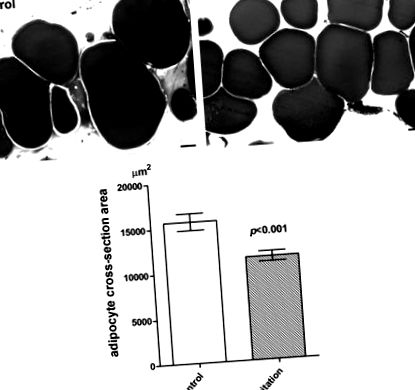
Візуальне дослідження напівтинових зрізів та морфометричний аналіз підшкірної жирової тканини шкірних експлантатів ex vivo (рис. 1) показали, що ультразвукова кавітація викликала помітне, статистично значуще зменшення (-23%) розміру вакуолей ліпідів в адипоцитах (контроль: 15 654) ± 942 мкм 2; кавітація: 11 423 ± 558 мкм 2; P Рис. 2). У пацієнтів 1 і 2 (біопсії брали через 1 день після останнього застосування УЗД) лікування спричинило значне зменшення (-26%) розміру вакуолей ліпідних адипоцитів (контроль: 11 908 ± 373 мкм 2; кавітація: 8637 ± 530 µm 2; P 2; кавітація: 6323 ± 200 мкм 2; P Рис. 3), не показали суттєвих відмінностей у співвідношенні ядерного мічення/немаркування між контрольною та досліджуваною ділянками жирової тканини (контроль: 0,09 ± 0,01; кавітація: 0,11 ± 0,03; об'єднані значення від 3 пацієнтів).
Гістологічні та морфометричні знахідки підшкірних адипоцитів із шкірних експлантів ex vivo. Ультразвукова кавітація спричиняє статистично значуще зменшення середньої площі поперечного перерізу ліпідних вакуолей, пов’язану із загальним об’ємом адипоцитів (t-тест Стьюдента, n = 3 біопсії на експериментальну групу). Фіксація/фарбування OsO4 та протизабарвлення толуїдиновим синім. Стовпчики = 10 мкм.
Гістологічні та морфометричні дані підшкірних адипоцитів з контрольних або попередньо оброблених ультразвуком біоптатів шкіри живота, взятих у зазначений час після лікування. Ультразвукова кавітація спричиняє статистично значуще зменшення середньої площі поперечного перерізу ліпідних вакуолей, пов’язану із загальним об’ємом адипоцитів (t-тест Стьюдента, n = 10 мікроскопічних полів за біопсію). Відмінностей між контрольними зразками у 2 пацієнтів не спостерігалось. Фіксація/фарбування OsO4 та протизабарвлення толуїдиновим синім. Стовпчики = 10 мкм.
Аналіз TUNEL, проведений для виявлення апоптотичних адипоцитів у підшкірних біопсіях з обробленої штучно або ультразвуком шкіри живота. Стрілки вказують на апоптотичні ядра. Ніяких відмінностей між 2 групами не спостерігалось і не вимірювалось. Стовпчики = 10 мкм.
Ультраструктурний аналіз жирової тканини з оброблених фальшивими експлантатами шкіри ex vivo продемонстрував нормальні адипоцити, показавши велику осміофільну ліпідну вакуолю з периферійним електронно-просвічуючим краєм, прилеглим до тонкого цитоплазматичного шару, що містить мізерні органели, мікровезикули піноцитозу та дрібні крапельки ліпідів (рис. 4А). Клітини були оточені суцільною базальною мембраною. Інтерстиціальна сполучна тканина складалася з пухкого, просвічуючого електроном матриксу, що містив тонкі пучки колагенових волокон. Мікросудини крові, переважно капіляри, також демонстрували нормальний вигляд (рис. 4Б): ендотеліальні клітини демонстрували неушкоджені плазматичні мембрани, містили численні мікровезикули транцитозу і поєднувались сполучними комплексами, утворюючи суцільний ендотелій; вони були оточені фундаментною мембраною, де містилися перицити. Нормальні особливості адипоцитів і кровоносних капілярів також спостерігались у біопсіях жирової тканини, взятих з оброблених підроблених ділянок 3 пацієнтів, які брали участь у дослідженні (не показано).
Репрезентативні зображення просвічувальної електронної мікроскопії жирової тканини з підроблених експлантатів шкіри ex vivo. A, Адипоцити мають нормальні риси. B, контрольний інтерстицій жирової тканини також демонструє нормальну морфологію. BM, базальна мембрана; Е, еритроцити; ЕС, ендотеліальна клітина; L, вакуолі ліпідів; ПК, перицит; пм, плазматична мембрана; pv, везикула піноцитозу. Стовпчики = 1 мкм.
І навпаки, підшкірна жирова тканина ультразвукових оброблених експлантатів шкіри ex vivo демонструвала помітні відмінності порівняно з підробленими зразками. Зокрема, у багатьох адипоцитів були виявлені своєрідні відхилення, що полягали у скупченні мікровезикул та вогнищевих розривах периферичного ободу цитоплазми (рис. 5). Такі розриви, як правило, обмежувались невеликими ділянками клітинної поверхні, діаметром приблизно 0,5–1,5 мкм, але достатньо великими, щоб забезпечити витік крапель тригліцеридів із внутрішньої цитоплазматичної вакуолі у позаклітинний простір. Слід зазначити, що ознак загибелі адипоцитів або залишків клітин не спостерігалося. Інтерстиціальна строма складалася з пухкого, просвічуючого електроном матриксу, що містив тонкі пучки колагенових волокон. Часто траплялися невеликі крапельки ліпідів (рис. 5). Мікросудини крові, головним чином капіляри, мали нормальний вигляд (рис. 6): ендотеліальні клітини демонстрували неушкоджені плазматичні мембрани, містили численні мікровезикули транцитозу і з'єднувались з'єднувальними комплексами, утворюючи суцільний ендотелій, і були оточені суцільною базальною мембраною, що містить деякі перицити . Внутрішньосудинні еритроцити також мали нормальні риси. Периваскулярні тучні клітини не виявляли ознак активації та виділення гранул (не показано).
Репрезентативні зображення електронної мікроскопії жирової тканини з оброблених ультразвуком експлантів шкіри ex vivo. Верхні панелі: Показані два сусідні адипоцити. BM, підвальні мембрани; Cy, цитоплазма; L, вакуолі ліпідів; pv, везикули піноцитозу. Наконечники стріл на вставці (b) спрямовані на 2 ділянки, що містять мікровезикулярні скупчення, в яких цитоплазма, здається, ось-ось розірветься. Центральна та нижня панелі: Аномальні адипоцити, що зазнають вивільнення ліпідів. L, вакуолі ліпідів; LD, краплі ліпідів у позаклітинному матриксі. Зірочки позначають вогнищеві цитоплазматичні розриви, що дозволяють витік крапель тригліцеридів в інтерстицій. Стовпчики = 1 мкм.
Репрезентативні зображення електронної мікроскопії жирової тканини з оброблених ультразвуком експлантів шкіри ex vivo. Ендотеліальні клітини (ЕК) мікросудин крові мають нормальні риси. BM, базальна мембрана; Cy, цитоплазма адипоцитів; Е, еритроцити; jc, сполучний комплекс; L, вакуолі ліпідів; pv, везикули піноцитозу. Стовпчики = 1 мкм.
Аналіз вивільнення тригліцеридів у кондиційованому середовищі шкірних експлантатів ex vivo показав збільшення часу як підроблених, так і ультразвукових зразків (рис. 7). Слід зазначити, що кавітація індукувала значно більший викид тригліцеридів у порівнянні з контролем, з піком через 15 хвилин (P Рис. 8). Ці особливості ніколи не були виявлені в штучно оброблених адипоцитах і узгоджуються з помітним зменшенням об'єму клітин, імовірно пов'язаним з розрядом тригліцеридів. Відповідно до цієї знахідки, в стромі жирової тканини поблизу кровоносних судин часто зустрічаються рідкі краплі ліпідів (рис. 8).
Репрезентативні зображення електронної мікроскопії жирової тканини з попередньо оброблених ультразвуком (1 д) ділянок шкіри живота. A, Адипоцит, що демонструє неправильні звивисті профілі та безліч крапель ліпідів (деякі з яких позначені зірочками), скупчені в цитоплазматичній ободі. B, Інтерстицій жирової тканини, що показує нормальні мікросудини крові та вільні крапельки ліпідів (стрілки) поблизу. BM, базальна мембрана; Cy, цитоплазма адипоцитів; ЕК, ендотеліальні клітини; L, вакуолі ліпідів. Стовпчики = 1 мкм.
Оцінка маси підшкірної жирової тканини методом плікометрії показала пов'язане з часом зменшення виміряних значень в оброблених ультразвуком ділянках шкіри живота порівняно з відповідними контрольними зонами (рис. 9).
Відсоткові зміни товщини підроблених та ультразвуком оброблених шкірних складок живота, виміряні методом плікометрії протягом 4 тижневих процедур та через 1 тиждень після останньої обробки (+1). Статистично значуще зменшення, пов’язане з часом, спостерігається на ділянках шкіри, оброблених ультразвуком, порівняно з контрольованими підробленими. Двосторонній дисперсійний аналіз та посттест Бонферроні: n = 3, * P 2 Контурний ультразвуковий пристрій може суттєво зменшити підшкірний жир та розмір жирових клітин, що підтверджує попередні клінічні спостереження за вираженим ліпоредуктивним ефектом цієї методики. 8,14 Це дослідження також надає побічні докази механізму дії ультразвуків на адипоцити. Гістоморфометричні дані вказують на те, що вплив повної товщини шкірних експлантів на 2 короткі ультразвукові цикли (по 6 с) з енергією, подібною до енергії, що використовується в клінічних цілях, призвів до статистично значущого зменшення підшкірних адипоцитів (-23%, Р 15 З іншого боку, цілісність судинних компонентів жирової тканини може сприяти видаленню інтерстиціальних крапель жиру та передбачуваних прозапальних медіаторів, що вивільняються з адипоцитів, можливо, шляхом лімфодренажу.
Вищезазначені гістоморфометричні та ультраструктурні спостереження добре поєднуються з результатами аналізу тригліцеридів у середовищі інкубації шкірних експлантів ex vivo, вказуючи, що індукована ультразвуком кавітація викликає статистично значуще вивільнення тригліцеридів з жирової тканини в інтерстиціальну рідину, як повідомлялося раніше . 15,16
Наведені результати відповідають даним попередніх досліджень свиней in vivo як з контуром I, так і з контуром Med 2, в яких було показано, що кавітація, індукована ультразвуком, викликає селективне зменшення жирових клітин без пошкодження шкіри, судин, нервів або сполучної тканини. 7,15 Подібно до цих висновків, повідомлялося, що лікування ультразвуком викликало утворення множинних дрібних пор в адипоцитах, дозволяючи диспергувати тригліцериди в інтерстиціальному просторі та лімфатичних судинах. 7,15 Можна уявити, що тригліцериди можуть потім абсорбуватися і метаболізуватися ендогенними ліпазами до гліцерину та вільних жирних кислот і включатися в загальний пул ліпопротеїдів. Слід зазначити, що вміст ліпідів у сироватці крові не змінювався на 8,12,15 або незначно підвищувався, але все ще знаходився в межах норми 14 у експериментальних тварин та у пацієнтів, які піддавались ліпоредуктивному ультразвуковому лікуванню, що забезпечило значну безпеку цієї процедури з метаболічної точки зору. На відміну від попереднього звіту, 16, ми не спостерігали жодних ознак розладу колагенової мережі жирової тканини або індукції апоптозу адипоцитів, але ця невідповідність обґрунтована внаслідок набагато більш тривалого (10 хв) впливу зразків шкіри на ультразвуки, прийняті в зазначеного дослідження. 16
ВИСНОВКИ
На закінчення, це дослідження ще більше посилює сучасний погляд на те, що неінвазивна черезшкірна ультразвукова кавітація, одна з найбільш затребуваних пластичних та естетичних хірургічних процедур, є перспективною технологією локального зменшення жиру. Узагальненню значення нашого дослідження заважає той факт, що ми зарахували обмежену кількість пацієнтів; однак, послідовність спостережуваних висновків підтверджує думку, що Med 2 Contour завдяки своїй унікальній конструкції, що дає слабо сфокусоване ультразвукове поле в підшкірно-жировій прокладці, може бути ефективним та безпечним інструментом для ліпоредуктивних цілей.
ПОДЯКИ
Ми вдячні доктору Морено Налдоні, MSEE, за те, що люб’язно надали пристрій Med 2 Contour, та доктору Анні Паолі Челлай, д.е.н., за вмілу допомогу в аналізі тригліцеридів.
Виноски
Розкриття інформації: Автори не мають фінансового інтересу заявляти щодо змісту цієї статті. Збір за обробку статей був сплачений General Project Ltd., Монтеспертолі, Італія.
- Наноматеріали Безкоштовні повнотекстові ефекти постійного магнітного поля на швидкість розповсюдження людини
- Шкіра людини ранить головну і сніжну загрозу для громадського здоров'я та економіки
- Мезотерапія Омолодження шкіри Клініка лазера та шкіри
- Побічні ефекти Meta Boost - один на один
- Навчальний курс з мезотерапії-KT Навчальні курси по догляду за шкірою