Епідеміологічна характеристика бруцельозу людини та характер сприйнятливості до мікробів Brucella melitensis в Лізі Хінган Автономного району Внутрішня Монголія, Китай
Хай-Тао Юань
1 Центр Ліги Хінган з контролю та профілактики захворювань, Уланхот, 137400 Китай
Чен-Лін Ван
2 Державна ключова лабораторія з профілактики та контролю інфекційних хвороб, Національний інститут контролю та профілактики інфекційних хвороб, Китайський центр контролю та профілактики захворювань, Пекін, 102206 Китай
Лі-На Лю
3 Народна лікарня Ліги Хінган, Уланхот, 137400 Китай
Ден Ван
1 Центр Ліги Хінган з контролю та профілактики захворювань, Уланхот, 137400 Китай
Ден Лі
2 Державна ключова лабораторія з профілактики та контролю інфекційних хвороб, Національний інститут контролю та профілактики інфекційних хвороб, Китайський центр контролю та профілактики захворювань, Пекін, 102206 Китай
Чжень-Цзюнь Лі
1 Центр Ліги Хінган з контролю та профілактики захворювань, Уланхот, 137400 Китай
Чжи-Го Лю
1 Центр Ліги Хінган з контролю та профілактики захворювань, Уланхот, 137400 Китай
Пов’язані дані
Набори даних, що підтверджують результати цієї статті, включені до статті та її додаткових файлів.
Анотація
Передумови
Ліга Хінган розташована на північному сході Внутрішньої Монголії, автономному районі, історично ендемічному районі бруцельозу тварин і людини. У цьому дослідженні були проаналізовані епідеміологічні характеристики бруцельозу людини та досліджено генотиповий профіль та антимікробну сприйнятливість штамів Brucella melitensis, виділених від людей у Лізі Хінгана.
Методи
Характеристики епідемії були описані з використанням числа випадків, співвідношення складових та показника. 418 зразків крові людини було зібрано та перевірено бактеріологічно, а підозрілі колонії були виділені та ідентифіковані за допомогою звичайних методів біотипування, системи ідентифікації мікробів VITEK 2.0 та AMOS (Brucella abortus, B. melitensis, B. ovis та B. suis) -PCR. Згодом усі штами генотипували, використовуючи аналізи повторного аналізу з повторним аналізом множинних локусів (MLVA), і метод антимікробної сприйнятливості штамів Brucella до 10 найбільш часто використовуваних антибіотиків визначали методом мікророзведення.
Результати
Всього з 2004 по 2019 рік було зареєстровано 22 848 випадків захворювання на бруцельоз людини із середньорічною захворюваністю 87,2/100 000. Рівень захворюваності у розвинених районах тваринництва (Хорцин Юйі Цянькі [161,2/100 000] та Хорцин Юй Чжунці [112,1/100 000]) були значно вищими, ніж у лісових районах (Arxan [19,2/100 000]) (χ 2 = 32,561, P 2 = 299,97, P Ключові слова: Бруцельоз, Епідеміологічна характеристика, Brucella melitensis, Генотипування, Сприйнятливість до антимікробних препаратів, Ліга Хінгган, Автономний регіон Внутрішня Монголія
Передумови
Бруцельоз, спричинений бактеріями роду Brucella, є поширеною зоонозною хворобою з високим соціально-економічним та економічним навантаженням [1]. Хвороба може передаватися з водойм тварин, таких як велика рогата худоба, вівці та свині, людям, в основному, через безпосередній контакт із зараженими тваринами та споживання зараженої їжі. Симптоми інфекції включають аборти, безпліддя, зниження продуктивності та кульгавість у тварин [2]. Однак у людей хвороба може проявлятися як хвилеподібна лихоманка з артралгією, іноді пов’язана з хронічними та важкими ускладненнями, такими як орхіт, спондиліт та артрит [3, 4]. Люди, особливо ті, хто займається тваринництвом, забоєм та торгівлею худобою, мають більший ризик розвитку бруцельозу.
Методи
Визначення справи та джерело даних
Розподіл віку, статі та роду занять
Ідентифікація штаму та характеристики генотипування B. melitensis
Загалом було виділено та ідентифіковано 54 штами бруцел на основі традиційних методів біотипування, з яких 13 - B. melitensis bv. 1, а решта 41 штам був B. melitensis bv. 3 (Таблиця (Таблиця1). 1). Усі штами були позитивними щодо ProA, GlyA, TyrA, URE та ELLM (таблиця S3). На основі AMOS-PCR спостерігали смугу 731 bp у 54 штамів бруцел. Географічний розподіл 54 штамів показано на рис. Рис. 1b 1 b та Таблиці S4.
Таблиця 1
Характеристики біотипування ізолятів видів бруцел у цьому дослідженні
| BA | 1 | + | + | + | - | + | - | - | CL | CL | CL | B. abortus 544 |
| БМ | 1 | - | - | + | + | - | + | - | NL | CL | NL | B. melitensis16M |
| BS | 1 | - | ++ | - | + | + | - | - | NL | CL | CL | B. suis 1330 |
| Випробувані штами | 13 | - | - | + | + | - | + | - | NL | CL | NL | B. melitensis bv. 1 |
| 41 | - | - | + | + | + | + | - | NL | CL | NL | B. melitensis bv. 3 |
Опис даних:
№, кількість перевірених штамів
BF Базовий фуксин при 20 мкг/мл (1/50 000, мас./Об.), ТГ Тіонін при 20 мкг./Мл (1/50 000, мас./Об.)
Фаги, Tb Тбілісі, BK2 Берклі тип 2, Wb Weybridge;
CL Конфлюентний лізис, NL Без лізису;
+, позитивний (аглютинація сироватки позитивна)
-, негативний (негативна аглютинація в сироватці крові)
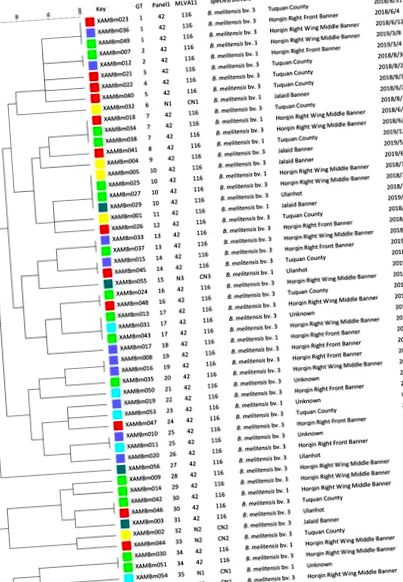
На основі восьми локусів VNTR штами були розділені на чотири генотипи панелі 1, включаючи 42 та N1 – N3; 89% (48/54) штамів були генотипом 42 панелі 1 (рис. (Рис. 2 2 та таблиця S1). Аналогічно ці штами були згруповані у чотири генотипи MLVA-11 (116 та CN1 – CN3); 89% (48/54) штамів були генотипом MLVA-11 116, а решта три нові генотипи - CN1 – CN3 (рис. (Рис. 2 2 та таблиця S1). На основі 16 локусів VNTR штами були згруповані в 37 генотипи (GT1–37) із 80–100% генетичною схожістю, з яких 12 були спільними генотипами, а 25 - одиночними. Загалом 10 (GT1, 2, 7,10, 13, 14, 16, 17, 25 та 30) з 12 спільних генотипів відповідали 25 штамам з двох до трьох різних областей, які були виділені в однаковий час (рис. (Рис. 2, 2).
Дендрограма, заснована на аналізі генотипування MLVA-16 (метод UPGMA), що показує взаємозв'язок між 54 ізолятами B. melitensis. У стовпцях вказані ідентифікаційні номери, генотипи MLVA-16 (GT), генотипи панелі 1 та генотипи MLVA-11 (панелі 1 та 2A), види біовар, їх географічне розташування та рік ізоляції штамів
Схема сприйнятливості протимікробних препаратів для штамів 25 B. melitensis
Діапазон MIC та значення MIC50 та MIC90 для штамів 25 B. melitensis наведені в таблиці Таблиця 2. 2. Всі 25 перевірених ізолятів були сприйнятливі до доксицикліну (MIC90, 0,1 мкг/мл) і тетрацикліну (MIC90, 0,5 мкг/мл), гентаміцину (MIC90, 1 мкг/мл), ципрофлоксацину (MIC90, 1 мкг/мл), офлоксацину (MIC90, 1 мкг/мл), моксифлоксацин (MIC90, 1 мкг/мл) та стрептоміцин (MIC90, 2 мкг/мл). Крім того, 84% (21/25) штамів були сприйнятливими до рифампініну, а 16% (4/25) штамів виявляли проміжну сприйнятливість. Значення MIC котримоксазолу коливались від 1/19 до 4/76 мкг/мл (MIC90, 4/76 мкг/мл), при цьому 20% (5/25) штамів виявляли стійкість до котримоксазолу. Всі 25 штамів були стійкими до азитроміцину (MIC90, 64 мкг/мл). Не було виявлено зв'язку між типом біовару та профілем сприйнятливості тестованих штамів B. melitensis.
Таблиця 2
Діапазон MIC, MIC50 та MIC90 з 10 антимікробних засобів проти 25 штамів B. melitensis
| Доксициклін | 0,12–0,24 | 0,12 | 0,12 | 25 (100) | 0 | 0 | ≤ 1 | - | - |
| Тетрациклін | 0,25–1 | 0,25 | 0,5 | 25 (100) | 0 | 0 | ≤ 1 | - | - |
| Гентаміцин | 0,5–1 | 0,5 | 1.0 | 25 (100) | 0 | 0 | ≤ 4 | - | - |
| Ципрофлоксацин | 0,5–1 | 0,5 | 1.0 | 25 (100) | 0 | 0 | ≤ 1 | - | - |
| Офлоксацин | 1.0 | 1.0 | 1.0 | 25 (100) | 0 | 0 | ≤ 2 | - | - |
| Моксифлоксацин | 1.0 | 1.0 | 1.0 | 25 (100) | 0 | 0 | ≤ 1 | - | - |
| Стрептоміцин | 2–4 | 2.0 | 4.0 | 25 (100) | 0 | 0 | ≤ 8 | - | - |
| Рифампін | 0,08–3,2 | 0,5 | 1.0 | 21 (84) | 4 (16) | 0 | ≤ 1 | 2 | ≥ 4 |
| Котрімоксазол | 1/19–4/76 | 2/38 | 4/76 | 20 (80) | 0 | 5 (20) | ≤ 2/38 | - | - |
| Азитроміцин | 16–64 | 64 | 64 | 0 | 0 | 25 (100) | ≤ 4 | - | - |
Примітка: S сприйнятливий, I середня сприйнятливість, стійкий до R, 1 кількість ізолятів
† 50 і 90%, MIC, при якому інгібуються 50 і 90% ізолятів. -: Не визначено
Котрімоксазол: триметоприм/сульфаметоксазол (відображається лише частина триметоприму у співвідношенні лікарського засобу 1/19)
Граничні значення для повільно зростаючих бактерій згідно з CLSI, зареєстровані для Haemophilus spp. були надані
Обговорення
Більше того, Ліга Хінган є розвиненою сферою тваринництва, і велика кількість антибіотиків, що використовуються в селекційній галузі, може збільшити ризик того, що штами Бруцелла стануть менш чутливими до різних антибіотиків. Оскільки в багатьох частинах світу повідомляється про підвищення стійкості до рифампіну та котримоксазолу, ми пропонуємо періодичні переоцінки чутливості штаму до тих антибіотиків, які найчастіше використовуються в лікуванні. Це сприятиме ранньому виявленню будь-якої стійкості до наркотиків, особливо в районах ендемічності.
Наше дослідження мало кілька обмежень. По-перше, епідеміологічні дані збирали за допомогою пасивного нагляду за охороною здоров’я. Таким чином, на дані може вплинути недостатня кількість звітів, нерозуміння хворобою лікаря та лабораторні помилкові діагностики. По-друге, чутливість 25 штамів B. melitensis до 10 антибіотиків перевіряли in vitro. Хоча різноманітність цих антимікробних засобів виявилося активним, необхідне подальше дослідження чутливості до антибіотиків у більшості штамів. Нарешті, в цьому дослідженні не було виділено штамів тварин. Дослідження генетично пов'язаних штамів між людьми та тваринами можуть пояснити епідеміологію бруцельозу.
Висновки
Як правило, рівень захворюваності на бруцельоз людини в досліджуваному регіоні демонстрував зростаючу тенденцію з 2004 по 2019 роки, хоча він зменшувався між 2012 і 2016 роками. B. melitensis, особливо biovar 3, був етіологічним агентом, який найчастіше був виділений від людей у цьому регіоні. Це свідчило про те, що вівці були основною причиною бруцельозу людини. Більше того, генотипування MLVA показало, що спалах людського бруцельозу обумовлений єдиним джерелом зараження. Ці дані свідчать про те, що запуск комплексних стратегій профілактики та боротьби з цим регіоном, особливо обмеження пересування заражених овець, є терміновим.
- Прикордонна ідентифікація та характеристика антитіл людини, вироблених з жирових тканин
- Frontiers Gut Microbiota як відсутня ланка між поживними речовинами та рисами мікробіології людини
- Жирні кислоти - це ключові поживні речовини, що відрізняються за біохімічними та метаболічними характеристиками
- Вплив годування дієтою з низьким вмістом вітаміну А на тушку та виробничі характеристики бичків із
- Повна стаття Кукурудза - Потенційне джерело харчування та здоров'я людини Огляд