Екстракт рослинних ліків активує АМФ-активовану білкову кіназу у щурів із ожирінням, що викликаються дієтою
1 Лабораторія клінічної біології та фармакогеноміки та Центр клінічних досліджень та геноміки, Інститут східної медицини, Університет Кюн Хі, 26 Kyungheedae-ro, Dongdaemun-gu, Сеул 130-701, Республіка Корея
2 Департамент превентивної медицини, Коледж східної медицини, Університет Кюн Хі, 26 Kyungheedae-ro, Dongdaemun-gu, Сеул 130-701, Республіка Корея
Анотація
1. Вступ
Ожиріння через нерівновагу споживання та витрати енергії досягло масштабів епідемії в деяких частинах світу. Окрім вищої маси жиру та маси тіла [1], ожиріння пов'язане з вищим ризиком таких проблем зі здоров'ям, як серцево-судинні захворювання, інсулінорезистентність та цукровий діабет, гіперліпідемія, артроз, багато форм раку та психологічний стрес [2, 3].
OB-1 складається з Сперма Benincasae, Laminaria japonica Арешон., Піні Фоліум, Молі Фоліум, Цитрус аврантій Лінн., І Трава ефедри (Materia medica, ISBN: 8985897373). Сперма Benincasae є сечогінним засобом, який застосовувався для виведення токсинів та набряків з організму з ранніх часів. Laminaria japonica Areschon повідомлялося, що він має ефект проти ожиріння [4]. Відомо, що Піні Фоліум збільшує обмін ліпідів у сироватці крові та Молі Фоліум пригнічує ожиріння. Також повідомлялося, що Citrus aurantium Linn збільшує базальний рівень метаболізму, діє як діуретик та зменшує активність ліпази [5]. Трава ефедри - добре відомий препарат проти ожиріння, що зменшує вагу тіла [6].
Індуковані ожирінням зміни тканини адипоцитів призводять до зміни експресії або функції таких важливих ендокринних гормонів, як лептин і адипонектин. Рівень лептину натощак надзвичайно підвищений в адипоцитах у людей із ожирінням, і експресія його генів значно підвищується у щурів з ожирінням, спричиненим дієтою [1, 7]. На відміну від лептину, адипонектин відновлюється в тканині адипоцитів у людей із ожирінням [8].
AMPK відомий як ключова молекула, яка регулює енергетичний баланс, масу тіла, споживання їжі та метаболічний баланс ліпідів та глюкози. Активація AMPK переключає клітини з споживання АТФ на активні процеси продукування АТФ, такі як окислення жирних кислот та глюкози. З цих причин AMPK став предметом багатьох останніх досліджень як терапевтична мішень метаболічних захворювань [9–11].
2. Методи та матеріали
2.1. Підготовка OB-1
Шість трав, Насіння Benincasae, Laminaria japonica Areschon, Pini Folium, Moli Folium, Citrus aurantium Linn, і Трава ефедри, були придбані в Omniherb (Кьонг Бук, Корея) і занурені в 1 л 80% етанолу, а потім оброблені ультразвуком протягом 30 хв. Отриманий екстракт фільтрували через скляний фільтр за допомогою вакуумного насоса. Ротаційний вакуумний випарник (Eyela, Японія) був використаний для концентрування рідкого екстракту при 45 ° C. Потім концентрований екстракт ліофілізували і відновлювали у фізіологічному розчині при робочій концентрації. OB-1 готується з цих шести екстрактів трав у співвідношенні 1: 1: 1: 1: 1: 1.
2.2. Експериментальний дизайн
Чотири тижні самців щурів Wistar вагою 140-160 г були придбані у Central Laboratory Animal, Inc. (Сеул, Республіка Корея). Тварин обстежували згідно з Керівництвом для експериментів на тваринах під редакцією Корейської академії медичних наук. По чотири щури утримувались у клітці під час 12: 12-годинного циклу світло-темрява, вологості 50% та
° С Поживні компоненти та співвідношення складу контрольної та високожирної дієти вказані в таблиці 1 [1, 12]. Щурів годували стандартною лабораторною чау-чау (Purina Co .; Республіка Корея) і протягом 7 днів акліматизували до навколишнього середовища перед початком експерименту. Після акліматизації контрольна група (
) отримували стандартну лабораторну дієту чау (контрольна дієта) та групу з високим вмістом жиру (
) отримували дієту, описану в таблиці 1. Поживний компонент контрольної дієти (3,665 ккал/г) становив 65% вуглеводів, 20% білків і 4,5% ліпідів. Дієта з високим вмістом жиру (4,058 ккал/г) являла собою суміш, що містить дуже смачну людську їжу (печиво, сир, ковбаса, чіпси, шоколад та мигдаль) у пропорції 2: 2: 2: 2: 1: 1 та рівна кількість (у грамах) контрольної лабораторної дієти чау. Ця дієта з високим вмістом жиру містила 32%, 12% та 31% енергії у вигляді вуглеводів, білків та жирів відповідно. Тварин зважували на початку експерименту та щотижня після цього. Після 5 тижнів годування щурів як контрольної, так і дієти з високим вмістом жиру, кожна група була випадковим чином розділена на групи, оброблені фізіологічним розчином або групи OB-1. Щурів годували зазначеною дієтою, обробляючи фізіологічним розчином або 40 мг/100 г OB-1 щодня протягом 5 тижнів. Щурів забивали анестезією через 10 тижнів після початку дієтичного лікування.
2.3. Зразки органів
Зразки жирової тканини епідидиму та печінки енуклеювали від щурів і промивали в холодному сольовому розчині. Зразки адипоцитів епідидиму негайно зберігали в морозильній камері -70 ° C для подальшого виділення мРНК. Зразки печінки фіксували на ніч у 10% нейтральному буферному формаліні (NBF) для підготовки до гістологічного фарбування. Потім фіксовані зразки печінки замочували у 30% сахарозі (Sigma; Сент-Луїс, Міссурі, США), поки зразки печінки не опускалися на дно пляшки. Після видалення надлишкової рідини із зразків їх зберігали при -70 ° C.
2.4. Аналіз RT-PCR
2.5. Імуноблот-аналіз
Тканини гомогенізували в буфері, що містив 50 мМ трис-HCl, рН 7,4, 5 мМ EDTA, 150 мМ NaCl, 0,1% додецилсульфату натрію (SDS), 1% Triton X-100 та коктейль інгібітора протеази (104 мМ AEBSF, 0,08 мМ Апротинін, 2 мМ лейпептину, 4 мМ бестатину, 1,5 мМ пепстатину А та 1,4 мМ Е-64) на льоду. Гомогенізовану тканину інкубували протягом 30 хв на льоду з наступним центрифугуванням при 14000 об/хв протягом 30 хв при 4 ° С. Супернатант використовували для проведення аналізу Бредфорда (Bio-rad) для визначення концентрації білка. Потім 50 μг загального білка відокремлювали на 10% відновлювальних поліакриламідних гелях і переносили в мембрани. Імуноблот-аналіз проводили з використанням антитіл до фосфо-AMPK (Cell Signaling Technology; Beverly, MA, USA) або α-антитіла до тубуліну та імунореактивні білки були виявлені за допомогою хемілюмінесценції.
2.6. Виділення жирових клітин з адипоцитів
Жирові клітини виділяли обробкою колагеназою відповідно до методу, описаного раніше [13]. Коротко, зразки жирової тканини епідидиму подрібнювали при кімнатній температурі та інкубували з 1,5 г/л колагенази в 10 мл бікарбонату Кребса-Рінгера (KRB; 10 нМ HEPES, 6 мМ глюкози та 30 г/л бичачого сироваткового альбуміну, рН 7,4, попередньо загазований 95% O2/5% CO2) протягом 30 хв при 37 ° C на водяній бані, що струшується. Потім адипоцити візуалізували за допомогою мікроскопії та фотографували.
2.7. Морфологія печінки
Описані вище фіксовані зразки печінки вбудовували в сполуку оптичної температури різання (OCT) і 10 μМ крізів вирізали на кріостаті. Зрізи тканин фарбували олійно-червоним O (Sigma) для візуалізації нейтральних ліпідів, а ядра контрастували гематоксиліном (Gill №2; Sigma). Oil Red O розчинили в 99% -ному ізопропанолі, залишили на ніч при кімнатній температурі та відфільтрували за допомогою фільтрувального паперу Whatman No. 2 (ватман; Великобританія). Цей маточний розчин змішували з дистильованою водою (2: 3) і повторно фільтрували за допомогою фільтрувального паперу Whatman No. 2 перед використанням. Скла, що містять розсічену тканину печінки, промивали ізопропанолом протягом 10 хв і фарбували робочим розчином Oil Red O протягом 15 хв. Потім предметне скло знебарвлювали 70% ізопропанолом протягом 3 хв, промивали дистильованою водою протягом 5 хв і фарбували гематоксиліном протягом 30 сек. Забарвлені предметні стекла проводили остаточне промивання дистильованою водою, сушили на повітрі і монтували гліцериновим желе.
2.8. Тест на відкритому полі
Щоб визначити, чи лікування OB-1 підвищувало рівень активності щурів, ми проводили моніторинг та порівнювали кількість відвідувань, вирощування та догляд групи, яка отримувала OB-1, із групою фізіологічного розчину на відкритій арені. Ми використовували манеж розміром 75 см × 75 см зі стінами висотою 30 см, побудований із п’яти шматків щільного паперу та позначений поперечною смугою через дно на відстані 15 см. Відеокамеру розмістили на 250 см над ареною і за допомогою неї реєстрували 10 хв активності на щура. Відстежувались випадки трьох видів діяльності (кількість відвідувань, вирощування та догляд).
2.9. Статистичний аналіз
Статистичний аналіз проводили за допомогою віконного SPSS (версія 12.0). Всі кількісні дані були проаналізовані незалежними
-тести на різницю між двома засобами та односторонню ANOVA на різницю між чотирма способами.
значення) були значно перевищеними порівняно з контролем стандартних лабораторних щурів з дієтичного чау () через п’ять тижнів (
, Фігура 1). Потім половину кожної індукованої HFD та контрольної групи випадковим чином класифікували і вводили з OB-1 та фізіологічним розчином протягом додаткових п’яти тижнів, як HFD_OB-1, HFD_saline, Con_OB-1 та Con_saline, відповідно. Лікування OB-1 у щурів, індукованих HFD, показало зниження маси тіла приблизно на 3,1% через 10 тижнів, але не суттєве (
). Крім того, не було різниці у споживанні їжі між групами лікування OB-1 та фізіологічним розчином. Як і група HFD, не було різниці між OB-1 та фізіологічним розчином контролів маси тіла.
) була індукована дієтою з високим вмістом жиру протягом п’яти тижнів порівняно з контролем (
). (b) Після підкласифікації кожної групи фітотерапію (OB-1) та фізіологічний розчин лікували протягом додаткових п’яти тижнів. Кожні дані представляють середнє значення ± S.E.M. *
3.2. Підвищена активність рухів у випробуванні на відкритому полі за допомогою OB-1
Для оцінки впливу OB-1 на загальний рівень активності щурів щурів кожної групи піддавали випробуванню на відкритому грунті для оцінки їх рівня активності. Протягом 10 хв їм дозволялося вільно кочувати, контролювали відвідування, вирощування та догляд за щурами. Цікаво, що лікування OB-1 у щурів, індукованих HFD, суттєво підвищувало активність рухів порівняно з групою HFD_saline (Рисунок 2).
) контролювали для вимірювання рівня активності. Кожні дані представляють середнє значення ± S.E.M. *
3.3. Вплив OB-1 на адипоцити та накопичення ліпідів
Щоб спостерігати, чи впливає OB-1 на морфологію клітин, клітини білих адипоцитів спочатку виділяли з щурів кожної групи, а потім порівнювали за допомогою мікроскопії. Показано, що епідидимальні білі адипоцити від індукованих HFD щурів порівняно з контролем, яких годували стандартною дієтою чау, тоді як розмір адипоцитів у щурів, яким вводили OB-1, із ожирінням, спричиненим HFD, було відновлено (рис.3 ( а)). Оскільки ожиріння пов'язане з накопиченням ліпідів у печінці, тканини печінки з кожної групи збирали, а потім фарбували маслом Red O, барвником, специфічним для фарбування ліпідів, і фарбували ядра гематоксиліном. Мікроскопічне спостереження показало, що краплі ліпідів в тканинах печінки у щурів, спричинених ожирінням, не вводили OB-1 (HFD_saline), тоді як у групи з групи лікування OB-1 не було крапель ліпідів, подібних до контрольних зразків (рис. 3 (b)), що вказує що лікування OB-1 може модулювати утворення крапель ліпідів у тканинах печінки.
3.4. Вплив OB-1 на експресію мРНК лептину та адипонектину
На основі змін в адипоцитах та тканинах печінки після обробок OB-1 було досліджено, чи може експресія генів лептину та адипонектину регулюватися OB-1. Хоча рівень транскрипції лептину в білих адипоцитах епідидиму у щурів, індукованих HFD, був значно підвищений у порівнянні з контролем, не було різниці між OB-1 та фізіологічним розчином (рис. 4 (а)). У випадку адипонектину кожна група не зазнала суттєвих змін (рис. 4 (b)). Ці результати вказують на те, що OB-1 не впливає на експресію як лептину, так і адипонектину.
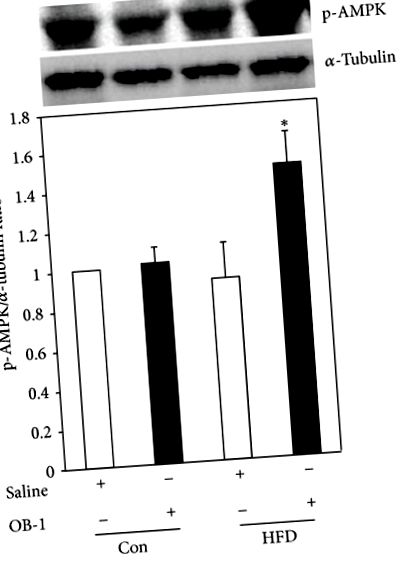
3.5. Стимулюючий вплив OB-1 на фосфорилювання AMPK
Оскільки AMPK відіграє ключову роль в енергетичному метаболізмі всередині клітин, далі було досліджено, чи впливає OB-1 на активність AMPK в тканинах печінки від щурів. Не було відмінностей у експресії білка AMPK серед контрольних груп та групи, що вводила фізіологічний розчин із ожирінням, спричиненим HFD. Однак фосфорилювання AMPK було значно збільшено в групі, якій вводили OB-1, порівняно з групою ожирінням, що отримувала фізіологічний розчин, а також контролем (рис.5).
4. Обговорення
AMPK відіграє важливу функцію в підтримці енергетичного балансу в клітинах. Також печінка є центром енергетичного обміну та гомеостазу глюкози. Для контролю енергетичного гомеостазу активація AMPK зменшує глюконеогенез та ліпогенез, тоді як збільшує окислення жиру та засвоєння глюкози шляхом включення шляхів генерування АТФ та відключення шляхів споживання АТФ [9, 18, 19]. У цьому дослідженні також було показано, що лікування OB-1 негативно корелює із накопиченням крапель ліпідів у тканині печінки, припускаючи, що OB-1 може інгібувати накопичення ліпідів, блокуючи шлях, пов’язаний з ліпідним обміном. На підтвердження цієї ідеї OB-1 позитивно регулював активність AMPK у тканині печінки групи, яка отримувала OB-1 із ожирінням, спричиненим HFD. Отже, OB-1 може негативно регулювати ліпідний обмін або глюконеогенез, активуючи AMPK. Однак це необхідно для детального з'ясування основних молекулярних механізмів.
Згідно з нашими результатами відкритих польових випробувань [20], щури, яким вводили OB-1 з ожирінням, спричиненим HFD, продемонстрували підвищену активність по догляду та вирощуванню порівняно з контрольною групою, обробленою фізіологічним розчином. Хоча щури з ожирінням, яким вводили OB-1, не показали значного зменшення маси тіла порівняно з групою ожирінням, обробленою фізіологічним розчином, ці посилені рухи дозволяють припустити, що активація AMPK та пов'язані з цим механізми можуть контролювати не масу тіла або споживання їжі, а енергетичний обмін [10, 21]. Цей посилений енергетичний метаболізм за допомогою OB-1 може зменшити приблизно на 3,1% зменшення маси тіла щурів у цьому дослідженні, але не суттєво і може збільшити активність рухів.
Лептин та адипонектин як гормони, що походять від адипоцитів, відіграють ключову роль у ожирінні та енергетичному гомеостазі [22, 23]. Оскільки лептин регулює запаси жиру в організмі через його вплив на споживання їжі та енергетичний обмін, лептин є важливою молекулою в процесі ожиріння [24]. Нещодавно повідомлялося, що існує значна кореляція між експресією лептину та розміром адипоцитів [25]. Крім того, існує кореляція між експресією адипонектину, який є адипокіном, який спеціально секретується адипоцитами, та розміром адипоцитів при ожирінні [26, 27]. На підставі цих фактів оцінювали експресію лептину та адипонектину, але не виявили суттєвих змін у експресії мРНК генів обробкою OB-1. Однак було показано, що розмір адипоцитів у щурів, яким вводили OB-1 з індукованим HFD ожирінням, порівняно із збільшеними адипоцитами щурів, спричинених ожирінням, що свідчить про те, що інші сигнали можуть брати участь у експресії та регуляції адипоцитів при лікуванні OB-1. Повідомлялося, що ФНП експресується в людських адипоцитах, а рівень ФНП позитивно корелює із ожирінням [28]. Це свідчить про те, що передача сигналів TNF може брати участь у експресії та регуляції адипоцитів при лікуванні OB-1.
Фізичні вправи та скорочення корелюють із підвищеним фосфорилюванням AMPK у скелетних м’язах людини чи щурів [29, 30]. Таким чином, наші висновки про те, що введення OB-1 збільшило фосфорилювання AMPK, дозволяють припустити, що компоненти з шести рослинних рослин можуть стимулювати механізм фізичних рухів та фізичних вправ завдяки активації AMPK та/або залучених до нього регуляторів. На закінчення, це дослідження показало, що лікування OB-1 індукованим HFD щурами із ожирінням значно збільшувало фосфорилювання AMPK та зменшувало збільшені розміри адипоцитів від ожиріння та накопичення ліпідів, спричиненого HFD. Тому припускають, що ці ефекти OB-1, особливо пов’язані з активацією AMPK, можуть змінити метаболічні процеси. Наші висновки потребують майбутніх досліджень на рівнях молекулярного механізму, щоб зрозуміти, як рослинний екстракт OB-1 або його компоненти модулюють метаболічні процеси.
Подяка
Ця робота була підтримана частково грантом Корейського науково-технічного фонду (KOSEF), що фінансується урядом Кореї (MEST) (№ 2009-0063466), а частково грантом Проекту досліджень та розробок традиційної корейської медицини, Міністерства охорони здоров'я та соціального забезпечення, Республіка Корея (B110043).
Список літератури
- Екстракт трав ALS-L1023 з лікарської рослини Melissa officinalis полегшує вісцеральне ожиріння та інсулін
- Вплив білка казеїну до сну на метаболізм жиру у чоловіків із ожирінням - PubMed
- Чому дієта для важких атлетів містить багато білка
- Потреба в харчових білках кочевого сома, Mystus nemurus (Cuvier & Valenciennes),
- Правда про велосипедистів та білок АКТИВНИЙ