Ефекти втручання у спосіб життя на N-оксид триметиламіну плазми у дорослих із ожирінням
Меліса Л. Еріксон
1 Лабораторія інтегративної фізіології та молекулярної медицини, Біомедичний дослідницький центр Пеннінгтона, Університет штату Луїзіана, Батон-Руж, LA 70808, США; [email protected]
Стівен К. Малін
2 Департамент кінезіології, Університет Вірджинії, Шарлоттсвілль, штат Вірджинія 22903, США; ude.ainigriv@n6mks
Зененг Ван
3 Відділ клітинної та молекулярної медицини НДІ Лернера, клініка Клівленда, Клівленд, штат Огайо 44106, США; gro.fcc@2zgnaw (Z.W.); gro.fcc@5mnworb (J.M.B.); gro.fcc@2nezah (S.L.H.)
Дж. Марк Браун
3 Відділ клітинної та молекулярної медицини, Науково-дослідний інститут Лернера, клініка Клівленда, Клівленд, штат Огайо 44106, США; gro.fcc@2zgnaw (Z.W.); gro.fcc@5mnworb (J.M.B.); gro.fcc@2nezah (S.L.H.)
Стенлі Л.Хейзен
3 Відділ клітинної та молекулярної медицини, Науково-дослідний інститут Лернера, клініка Клівленда, Клівленд, штат Огайо 44106, США; gro.fcc@2zgnaw (Z.W.); gro.fcc@5mnworb (J.M.B.); gro.fcc@2nezah (S.L.H.)
Джон П. Кірван
1 Лабораторія інтегративної фізіології та молекулярної медицини, Біомедичний дослідницький центр Пеннінгтона, Університет штату Луїзіана, Батон-Руж, LA 70808, США; [email protected]
Пов’язані дані
Анотація
Накопичувальні докази, що пов'язують N-оксид триметиламіну (ТМАО) із ризиком серцево-судинних захворювань (ССЗ), викликали інтерес до розробки терапевтичних стратегій для зменшення його виробництва. Ми порівняли два підходи до втручання у спосіб життя: гіпокалорійна та евкалорійна дієта, поєднана з фізичними вправами, на рівні ТМАО щодо факторів ризику ССЗ. Шістнадцять дорослих із ожирінням (66,1 ± 4,4 року, ІМТ (індекс маси тіла): 35,9 ± 5,3 кг/м 2, глюкоза натще: 106 ± 16 мг/дл, 2-годинний ППГ (глюкоза після їжі): 168 ± 37 мг/дл) були випадковим чином призначені на 12 тижнів фізичних вправ (5 днів на тиждень, 80–85% HRmax (максимальна частота серцевих скорочень)) плюс або гіпокалорічна (HYPO) (-500 ккал), або евкалорічна (ЄС) дієта. Результати включали TMAO в плазмі крові, метаболізм глюкози (пероральний тест на толерантність до глюкози (OGTT) та еуглікемічно-гіперинсулінемічні затискачі для швидкості утилізації глюкози (GDR)), фізичне навантаження (VO2max, максимальне споживання кисню), ожиріння живота (сканування комп’ютерної томографії), холестерин та тригліцериди. Результати показали, що склад тіла (маса тіла, підшкірне ожиріння), чутливість до інсуліну, VO2max та холестерин покращилися (p Ключові слова: N-оксид триметиламіну, ожиріння, обмеження калорій, фактори ризику серцево-судинних захворювань, мікробіом кишечника, фізичні вправи, втручання у спосіб життя
1. Вступ
N-оксид триметиламіну (ТМАО) був визначений за допомогою нецільових метаболомічних досліджень як невелика молекула, присутня в системному кровообігу людини, що сприяє серцево-судинним захворюванням [1]. Зовсім недавно TMAO був причетний до патогенезу ожиріння [2], резистентності до інсуліну [3,4,5,6] та ниркової хвороби [7,8]. Проспективні клінічні дослідження показали, що ТМАО передбачає несприятливі серцево-судинні події, включаючи інфаркт міокарда, інсульт та смерть [9]. Крім того, кілька недавніх мета-аналізів клінічних досліджень для ТМАО підтверджують, що рівні циркуляції крові передбачають як серцево-судинні захворювання, так і ризики смертності, причому кожне підвищення рівня ТМАО на 10 мкМ асоціюється із приблизно 7,6% збільшенням відносного ризику смертності від усіх причин [ 10,11,12]. Багато досліджень як на моделях тварин, так і на клінічних спостереженнях свідчать про те, що мікробіотично-залежний шлях TMAO кишечника є важливим учасником розвитку серцево-судинних та метаболічних захворювань [1].
Біосинтез ТМАО унікальний серед традиційних факторів ризику серцево-судинних захворювань тим, що його вироблення залежить від мікробного метаболізму кишечника. Основні попередники ТМАО походять з харчових джерел фосфатидилхоліну, холіну та L-карнітину. Потрапляючи в шлунково-кишковий тракт, мікроби кишечника допомагають катаболізму цих сполук, що призводить до утворення триметиламіну (ТМА) як побічного продукту метаболізму. ТМА швидко всмоктується в портальну циркуляцію та окислюється печінковими ферментами, особливо флавінмонооксигеназою 3 (FMO3), що призводить до виробництва ТМАО [1,13]. ТМАО знову потрапляє в системний кровообіг і сприяє активації ендогенних клітин піни макрофагів, які беруть участь у розвитку атеросклерозу [1,11,14,15].
2. Матеріали та методи
2.1. Вивчати дизайн
Це був пост-hoc аналіз зразків, зібраних із раніше проведених рандомізованих контрольованих досліджень, що вивчали вплив втручань у спосіб життя на кардіометаболічні фактори ризику [28,29]. У нас були зразки плазми до та після втручання для шістнадцяти дорослих із ожирінням (вік: 66,1 ± 4,4 року; ІМТ (індекс маси тіла): 35,9 ± 5,3 кг/м 2). Учасники були випадковим чином призначені або на 12-тижневу еукалорійну (ЄС) дієту в поєднанні з фізичними вправами, або на гіпокалорійну (HYPO) дієту в поєднанні з фізичними вправами. Антропометричні та метаболічні дані збирали до і після евкалоричного або гіпокалорійного втручання. Під час фаз тестування учасники звітували у відділ клінічних досліджень протягом 3-денного періоду метаболічного контролю. У цей період за діяльністю та харчуванням ретельно стежили. Як було описано раніше, учасникам була надана дієта для підтримання ваги з наступним складом макроелементів (55% вуглеводів, 35% жиру та 10% білка). Щоденне споживання калорій обчислювали як швидкість метаболізму в спокої × 1,3 [29]. Процедури метаболічного тестування проводили після приблизно 12-годинного голодування протягом ночі.
2.2. Учасники
Учасники мали стабільність ваги (1,15 та/або вольова втома. Тренування здійснювались із частотою 5 днів на тиждень, протягом 50–60 хв, на біговій доріжці або велоергометрі. Первинні вправи виконувались з інтенсивністю між 60–65% HRmax. Інтенсивність поступово збільшували протягом сеансів, так що до 4-го тижня учасники підтримували інтенсивність 80–85% HRmax. VO2max і HRmax повторно тестували з кроком у 4 тижні (вихідні, 4, 8 та 12 тижнів) з метою моніторингу покращення фізичної форми та регулювання інтенсивності тренувань. Усі сеанси вправ контролював фізіолог фізичних вправ. Під час усіх тренувань використовували полярні монітори серцевого ритму, щоб підтвердити відповідність інтенсивності тренувань. до оцінок після тестування.
Дієта: Учасникам групи евкалорій було рекомендовано не змінювати споживання енергії, тоді як учасникам групи гіпокалорій було рекомендовано зменшувати щоденні калорії на 500 ккал. Щоб полегшити дефіцит калорій, учасники щотижня зустрічались з дієтологом. Витрати енергії оцінювали за рівнянням Гарріса – Бенедикта, використовуючи коефіцієнт активності 1,3 [30]. Дотримання дієти контролювали за допомогою 3-денних відкликань їжі, які були завершені до втручання, а також на 1, 3, 6, 9 і 12 тижнів. Вагу тіла контролювали щотижня для підтвердження відповідності.
2.4. Склад тіла
Вимірювання зросту та ваги проводилось приблизно через 12 годин голодування, і учасники повинні були носити стандартне лікарняне плаття. Висоту вимірювали за допомогою стадіометра, а масу тіла - за каліброваною шкалою. Повідомляється в середньому про три вимірювання як для зросту, так і для ваги. ІМТ розраховували за цими даними. Ожиріння живота вимірювали за допомогою комп’ютеризованої осьової томографії (КТ) (сканер Picker PQ6000; Marconi/Picker Highland Heights, OH, США). Зображення поперечного перерізу були зроблені в області L4 живота. Регіони інтересів включали підшкірні та вісцеральні депо.
2.5. Вимірювання TMAO
Зразки крові натще збирали у пробірки ЕДТА, обробляли для виділення плазми та заморожували при -80 ° C до аналізу. Рівні ТМАО вимірювали за допомогою рідинної хроматографії із стабільним ізотопним розведенням за допомогою тандемної мас-спектрометрії за допомогою потрійного квадрупольного мас-спектрометра 8050 (Shimadzu Scientific Instruments, Колумбія, США), як описано раніше [1,31]. Аналіз TMAO показав хорошу між- та внутрішньоденну стабільність (CV 98,5%) та стабільність у циклах заморожування-відтавання (CV циклу 2/хв -1), як описано раніше [32,33]. Безперервну інфузію інсуліну проводили протягом 120 хв за допомогою катетера, розміщеного в антекубітальній вені. Одночасно вводили глюкозу (декстроза 20%), тоді як контралатеральну руку нагрівали до 60 ° C з метою артеріалізації крові. Глюкозу в плазмі крові оцінювали кожні п’ять хвилин, і це значення використовували для визначення наступних швидкостей інфузії глюкози. Повідомлялося про швидкість утилізації глюкози (ГДР) протягом 90–120 хв збільшення часу затискача для визначення чутливості до інсуліну.
2.7. Статистичний аналіз
Таблиця 1
Характеристики учасників до та після втручання у спосіб життя.
| Вік (роки) | 67 ± 5 | - | - | 65 ± 4 | - | - |
| Секс (М/Ж) | 2/5 | - | - | 3/6 | - | - |
| Вага тіла (кг) | 100 ± 16 | 91 ± 14 | 2) | 35 ± 5 | 32 ± 5 | Таблиця 1. Хоча статистично не відрізнялося, процентне зниження маси тіла, як правило, було більшим у групі гіпокалорій та евкалорів (HYPO: -7,8 ± 1,1% порівняно з ЄС: -5,7 ± 2,6%; p = 0,06). |
3.2. Концентрації ТМАО
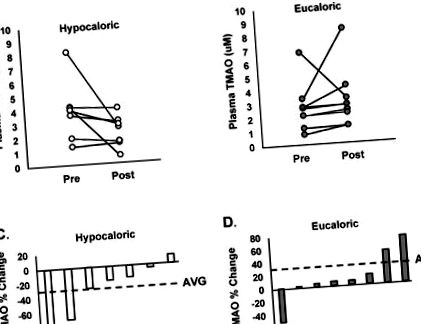
Базові рівні TMAO не відрізнялись між гіпокалорійними та евкалорійними групами (HYPO: 3,2 ± 1,9 порівняно з ЄС: 2,7 ± 1,7 мкМ; p = 0,260). У відповідь на втручання абсолютні рівні ТМАО не суттєво змінилися в межах гіпокалорійного (до: 3,8 ± 2,2 порівняно з пост: 2,2 ± 1,3 мкМ; р = 0,136) або евкалорійного (до: 2,7 ± 1,7 проти пост: 3,2 ± 2,3 мкМ; р = 0,537) групи. Однак на малюнку 1 показані індивідуальні зміни концентрацій ТМАО у плазмі після втручання в гіпокалорію (рис. 1 А) та еукалорію (рис. 1 Б), і показані значні зміни. Хоча зміна абсолютних рівнів TMAO не суттєво відрізнялося між групами (F = 2,421, p = 0,132), середній відсоток зміни TMAO суттєво відрізнявся між групами (ЄС: 32 ± 0,6% проти HYPO: −31 ± 0,4 %, p = 0,04, малюнок 1 C, D).
(A) Індивідуальні зміни концентрації ТМАО (триметиламіну N-оксиду) у плазмі до і після 12 тижнів гіпокалорійної дієти в поєднанні з контрольованими фізичними вправами. (B) Індивідуальні зміни концентрації ТМАО у плазмі до і після 12 тижнів евкалорієвої дієти в поєднанні з контрольованими фізичними вправами. (C.) Індивідуальна зміна концентрації ТМАО у плазмі після 12 тижнів гіпокалорійної дієти в поєднанні з контрольованими фізичними вправами. Середнє значення групи позначається горизонтальною пунктирною лінією. (D) Індивідуальна процентна зміна концентрації ТМАО у плазмі крові після 12 тижнів евкалорієвої дієти в поєднанні з контрольованими фізичними вправами. Середнє значення групи позначається горизонтальною пунктирною лінією.
3.3. Метаболізм глюкози
Пероральний тест на толерантність до глюкози: Глюкоза натще була значно знижена в гіпокалорійній групі, тоді як евкалорична група залишалася незмінною, як показано в таблиці 1. Реакції глюкози-AUC180 хв спрямовувались на зменшення гіпокалорійної групи (попередньо: 24,555 ± 2549 проти пост: 21,608 ± 2352 мг/дл × 180 хв; р = 0,071) і залишалися незмінними в евкалоричній групі (попередньо: 25,821 ± 6127 проти пост: 24 064 ± 3696 мг/дл × 180 хв; р = 0,173). Як показано в Таблиці 1, інсулін натще має тенденцію до зменшення в обох групах. Відповіді AUC180 хв на інсулін мали тенденцію до зниження як гіпокалорійної (до: 10 432 ± 4577 проти пост: 6 469 ± 1870 мкМ/мл × 180 хв; р = 0,079), так і еукалорійної (до: 15 162 ± 9912 проти посту: 11 520 ± 7236 мкУ/мл × 180 хв; р = 0,075), хоча цей ефект не був статистично значущим.
Евглікемічно-гіперинсулінемічний затискач: периферична чутливість до інсуліну, оцінена за швидкістю утилізації глюкози, значно покращилася як у гіпокалорійній, так і в евкалоричній групах, як показано на малюнку 2 А. Величина поліпшення не відрізнялася між групами (HYPO: 83,6% порівняно з ЄС: 59,6%; p = 0,41).
Вісцеральний жировий склад жиру значно зменшився в евкалоричній групі (до: 174,9 ± 118 проти посади: 138,9 ± 98 см 2; р = 0,025), тоді як група гіпокалорій не змінилася (до: 255,7 ± 96 проти пост: 232 ± 67 см 2; р = 0,434). Відносне зменшення не відрізнялося між групами (HYPO: -6,1% проти -16,3%; p = 0,156).
3.5. Ліпідний профіль
У групі з гіпокалорією значно знизився рівень холестерину, тоді як група еукалорію мала тенденцію до значного зниження, як показано в таблиці 1. Відносне зменшення не відрізнялося між групами (HYPO: 9,2% проти ЄС: 7,5%; p = 0,752). Крім того, тригліцериди були значно знижені в евкалорійній, але не гіпокалорійній групі, як показано в таблиці 1. Відносне зменшення не відрізнялося між групами (HYPO: -5,7% порівняно з ЄС: -19,6%; p = 0,233).
3.6. Кореляційний аналіз
Абсолютний вихідний рівень VO2max суттєво корелював з базовим рівнем ТМАО, як показано на малюнку 3 А, (r = 0,67, p = 0,004). Зміна TMAO після втручання у спосіб життя була зворотно корельована з базовою вісцеральною жировою тканиною (r = -0,63, p = 0,0094), а після статистичного контролю базових рівнів TMAO становила r = -0,54 (зміна F = 8,433, p = 0,012). Жоден інший базовий фактор не був пов'язаний з базовим TMAO (таблиця S1). Крім того, зміна ТМАО після втручання у спосіб життя корелювало з вихідним НДР (90–120 хв мг/кг/хв) (r = 0,58, p = 0,002), а після статистичного контролю рівня вихідних TMAO було r = 0,52 (зміна F = 7,483, р> 0,05). Кореляції зі зміною ТМАО та будь-яким складом тіла або результатом метаболізму не спостерігалось (Таблиця S2).
(A) Кореляція між вихідним TMAO у плазмі (мкМ) та вихідним VO2max (L/хв) (r = 0,67, p = 0,004). (B) Кореляція між вихідною логарифмічно трансформованою вісцеральною жировою тканиною (ПДВ) та процентною зміною ТМАО після втручання у спосіб життя (r = −0,63, p = 0,009). (C.) Кореляція між початковим рівнем утилізації глюкози та процентною зміною ТМАО після втручання у спосіб життя (НДР (рівень утилізації глюкози): r = 0,58, p = 0,003).
4. Обговорення
Ці висновки відповідають виробничому шляху TMAO. Можна стверджувати, що опосередкована користь гіпокалорійної дієти, використана в цьому дослідженні, призвела до зменшення абсолютних рівнів харчових попередників, частково пояснюючи спостережувані зміни в ТМАО. Циркулюючі рівні ТМАО чутливі до змін за допомогою маніпуляцій з харчовими попередниками, оскільки цей підхід раніше використовувався як експериментальний маневр, описаний як виклик фосфатидилхоліну [9]. Результати цієї проблеми свідчать про підвищення рівня ТМАО у плазмі після прийому двох великих яєць, зварених круто, у поєднанні з міченим дейтерієм фосфатидилхоліном [9]. У цьому документі ми послідовно показуємо потенційний зв’язок між внеском їжі в рівень ТМАО у людей. Невідомо, чи зумовлені зміни ТМАО негативним енергетичним балансом, або абсолютним зменшенням харчових попередників, пов’язаним із дотриманням протоколу обмеження калорій, і для вирішення цих питань знадобляться більш масштабні випробування із суворим контролем дієти.
Завдяки цьому пост-хок аналізу ми виявили, що обмеження калорій, спричинене дієтою, в поєднанні з контрольованими фізичними вправами може бути більш ефективним для зменшення циркулюючого ТМАО, порівняно з фізичними вправами, поєднаними з еукалорійною дієтою. Це може свідчити про те, що рівні TMAO більш піддаються зміні через обмеження калорій, спричинених дієтою, порівняно з ефектом фізичних вправ. Однак ми спостерігали, що поліпшення стану здоров’я відбувалося за відсутності значного зниження ТМАО, припускаючи, що фізичні вправи діють, зокрема, шляхом, незалежним від ТМАО, у дорослих із ожирінням, резистентних до інсуліну. Для підтвердження наших висновків будуть потрібні рандомізовані контрольовані дослідження з більшими розмірами зразків. Подальші дослідження також повинні бути спрямовані на те, щоб зменшити вплив негативного енергетичного балансу проти зменшення абсолютних рівнів ТМАО в харчових попередниках для сприяння корисним змінам рівня ТМАО та зменшення ризику серцево-метаболічних захворювань.
- Наслідки харчового втручання у дорослих із надмірною вагою або ожирінням - MedCrave онлайн
- Діти матерів із ожирінням піддаються більшому ризику ранньої серцевої смерті, як дорослі - ScienceDaily
- Вплив споживання фруктів на індекс маси тіла та втрату ваги у вибірці із надмірною вагою та ожирінням
- Депресивні симптоми у людей із надмірною вагою та ожирінням у літніх людей Тест гіпотези «веселий жир» -
- Вплив системи постійного моніторингу глюкози в режимі реального часу на дорослих із надмірною вагою або ожирінням