Дванадцять тижнів лікування емпагліфлозином у пацієнтів із серцевою недостатністю та зменшеним викидом
Дослідити вплив інгібітора ко-транспортера-2-натрію глюкози емпагліфлозину на N-кінцевий натрійуретичний пептид про-b-типу (NT-proBNP) у пацієнтів із серцевою недостатністю (СН) та зниженою фракцією викиду (HFrEF).
Методи та результати
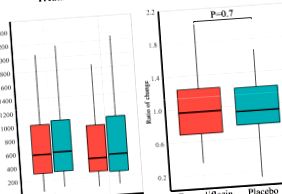
Empire HF було ініційованим слідчим, багатоцентровим, подвійним сліпим, плацебо-контрольованим, рандомізованим дослідженням. Пацієнтам із слабо симптоматичним HFrEF, середнім (стандартне відхилення (SD)) віком 64 (11) років, 85% чоловіків та середньою фракцією викиду лівого шлуночка 29% (8), на рекомендованій терапії СН, було призначено приймати емпагліфлозин 10 мг один раз щодня або плацебо протягом 12 тижнів. Первинною кінцевою точкою була різниця між групами у зміні NT-proBNP від вихідного рівня до 12 тижнів. Загалом 95 пацієнтів було призначено емпагліфлозину та 95 - плацебо. Суттєвої різниці у зміні NT-proBNP з емпагліфлозином у порівнянні з плацебо не спостерігалось [Емпагліфлозин: вихідний рівень, медіана (інтерквартильний діапазон (IQR)) 582 (304-1020) пг/мл, 12 тижнів, 478 (281-961) пг/мл; Плацебо: вихідне значення, 605 (322-1070) пг/мл, 12 тижнів, 520 (267-1075) пг/мл, скориговане співвідношення зміни емпагліфлозину/плацебо 0,98; 95% довірчий інтервал (ДІ) 0,82-1,11, Р = 0,7]. Крім того, суттєвої різниці в вимірюваному акселерометром добовому рівні активності не спостерігалося [скоригована середня різниця змін, емпагліфлозин проти плацебо, -26,0 кількість акселерометра; 95% ДІ -88,0 до 36,0, Р = 0,4] або анкета кардіоміопатії Канзас-Сіті Загальний підсумковий бал [скоригована середня різниця змін, емпагліфлозин проти плацебо 0,8; 95% ДІ від 2,3 до 3,9, Р = 0,6].
Висновок
У пацієнтів із низьким ризиком HFrEF із слабкими симптомами та на рекомендованій терапії СН, емпагліфлозин не змінює NT-proBNP через 12 тижнів. Крім того, не спостерігалося змін у рівні щоденної активності чи стані здоров'я.
Графічний реферат
- Завантажити: Завантажити зображення з високою роздільною здатністю (149 КБ)
- Завантажити: Завантажте повнорозмірне зображення
Попередній стаття у випуску Далі стаття у випуску
Clinicaltrialsregister.eu, номер EudraCT 2017-001341-27.
Повний протокол випробування доступний за номером 10.
- Ліки від діабету типу 2 для дорослих Ліки від серцевої недостатності для дорослих FARXIGA® (дапагліфлозин)
- Роль адипонектину в патогенезі та лікуванні неалкогольної жирової хвороби печінки -
- Дослідження показують, що препарат Belviq для схуднення здається безпечним для серця. Пошта Денвера
- РОЛЬ МНОГОФАКТОРІАЛЬНОГО ПІДХОДУ ДО ЛІКУВАННЯ ОЖИРІННЯ В ІП Ingenta Connect
- Препарат для схуднення Belviq - перший без серцевих ризиків, зазначає дослідження - The Boston Globe