Дієта та завдана шкода
Предмети
Тривалість життя збільшується, а старіння затримується через довічне обмеження дієти. Дослідження в Природний обмін речовин показує, що ці переваги зменшуються, коли в літньому віці починають обмежувати дієту внаслідок розвитку негнучкої харчової пам'яті в білій жировій тканині.
Модуляція старіння за допомогою харчування, особливо помірного (
20–40%) обмеження в харчуванні (ДР) представляє значний інтерес як засіб для покращення здоров’я організму. Старіння є провідним фактором ризику хронічних захворювань та інвалідності, і ДР затримує початок ряду вікових станів, від кардіометаболічних захворювань до раку та нейродегенерації, а також гальмує сам процес старіння 1. Більшість досліджень досліджували ефекти DR, що зберігається протягом усього життя. Але чи можна позбавитись користі від обмеження дієти протягом усього життя, перейшовши на менш жорстку дієту пізніше в житті? Або практикуючий АД після надмірного харчування може виправити заподіяну шкоду? Так і ні, мабуть, у мишей, принаймні. У цьому випуску Природний обмін речовин, Hahn та співавт. 2 повідомляють, що перехід мишей на пізньому етапі життя з DR на необмежену годівлю спричиняє швидке збільшення їх вікової смертності. На відміну від цього, користь від виживання старих мишей від переходу з необмеженого годування на АД є слабкою та повільною.
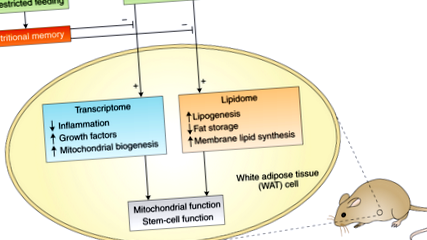
У попередньому дослідженні Mair et al. 3 повідомлялося, що фруктові мухи, які перейшли на АД, демонструють негайне зниження ризику смерті до рівня, який спостерігається у мух, що піддаються тривалому АД. І навпаки, мухи, переведені з ДР на контрольну дієту, швидко припускають такий самий вищий ризик смертності, як їхні довготривалі ситі аналоги. Немає жодної пам’яті про збитки, набуті протягом життя надлишків, а також накопичених показників утриманості. До цього часу на мишах не проводилося жодного еквівалентного дослідження. Hahn та співавт. 2 показують, що у мишей, на відміну від мух, справді існує "харчова пам'ять", яка закладена протягом усього періоду згодовування та обмежує переваги переходу на ДР у літньому віці (рис. 1).
Дієтичні обмеження впливають на транскриптом і ліпідом ВАТ, що призводить до поліпшення функції мітохондрій та збереження стовбурових клітин. Прижиттєве згодовування створює «поживну пам’ять», яка погіршує ці корисні реакції на обмеження в харчуванні, тим самим потенційно сприяючи відсутності переваг смертності, що спостерігаються у мишей, переведених з необробленого вигодовування на обмеження в пожилому віці.
Ця харчова пам'ять укладена в транскриптом і ліпідом білої жирової тканини (WAT). Що таке WAT у літньому віці, що заважає йому реагувати на пізню зміну DR? Стійкі до перемикання генні шляхи включають такі, які, як відомо, беруть участь у старінні, такі як функція мітохондрій та біогенез, запалення, шляхи фактора росту та ліпідний обмін. Подібним чином, Hahn et al. виявили, що ліпід WAT у старих мишей після необмеженого годування стійкий до DR-індукованого переходу від зберігання ліпідів у тригліцеридах до синтезу ліпідів мембран, включаючи кардіоліпін, ключовий ліпід у мембранах мітохондрій.
Незрозуміло, як відсутність основної вигоди для смертності при переході на пізній термін життя до ДР пов’язана з негнучким старим ВАТ. Що цікаво, Hahn et al. спостерігали, що миші, які зберігають свою масу тіла та жирові відкладення після переходу на ДР, частіше отримують користь від смертності, ніж миші, які втрачають вагу та жир. Було б цікаво визначити, чи можуть транскриптом WAT та ліпідом цих мишей більш чутливо реагувати на DR, ніж миші, які втрачають масу тіла і не отримують ніяких переваг щодо смертності. Така знахідка забезпечить певну підтримку причинно-наслідкової ролі пам’яті харчування WAT щодо смертності.
Старіння спричинене мережею взаємодіючих біологічних процесів, які були класифіковані як «ознаки» старіння 4. Ці процеси, від геномної нестабільності та стирання теломер до запалення та виснаження стовбурових клітин, впливають на всі тканини у всіх старіючих організмах. Ці ефекти, як правило, вважаються незворотними, а втручання при старінні, такі як ДР, в основному затримують, а не лікують чи зворотні. Відсутність будь-якого серйозного ефекту від переходу на пізню добу на DR може просто відображати, що незворотні руйнування старіння вже зробили своє для всієї миші у віці до 24 місяців: шкода вже завдана.
Але новини не обов’язково всі погані. Hahn та співавт. виявили, що навіть незважаючи на те, що миші, які в старості перейшли на необмежену дієту, швидко втратили більшу частину користі від смертності від DR, вони все ж були в кращому стані, ніж миші, які все своє життя мали необмежений доступ до їжі.
Які уроки можна отримати для старіння людини? Здоров’я в літньому віці, безсумнівно, є наслідком поведінки протягом усього життя. Таким чином, підтримка здорового способу життя за допомогою харчування та фізичних вправ є пошуком на все життя, і його не слід розглядати лише в середньому віці, після того як проблеми, пов’язані зі старінням, для більшості людей стає неможливо ігнорувати.
Дані Hahn et al. вкажіть, що принаймні для мишей одним із способів здорового старіння є збереження АР протягом усього життя. Але чи існують інші варіанти, які є більш перекладними для людей? Деякі дослідження пропонують титрування харчування для різних фаз життя. 5,6 Інші дієтичні втручання, пов'язані з більш тривалим терміном життя, включають періодичне голодування 7, дієти з низьким вмістом білка, дієти з низьким відношенням білка до вуглеводів 8 та дієти з баланс амінокислот, що відповідає екзомам, або обмежений вміст амінокислот, таких як метіонін та амінокислоти з розгалуженим ланцюгом 9,10. Чи може перехід на такі дієти в середньому та старшому віці мати якісь переваги, ще слід вивчити.
Список літератури
Нікколі, Т. і Партрідж, Л. Curr. Біол. 22, R741 – R752 (2012).
Mair, W., Goymer, P., Pletcher, S. D. & Partridge, L. Наука 301, 1731–1733 (2003).
Лопес-Отін, К., Бласко, М.А., Партрідж, Л., Серрано, М. & Кромер, Г. Клітинка 153, 1194–1217 (2013).
Старший, А. М. та ін. Proc. Р. Соц. Лонд. B 286, 20190393 (2019).
Левін, М. Є. та співавт. Cell Metab. 19, 407–417 (2014).
Ді Франческо, А., Ді Германіо, К., Берньє, М. і де Кабо, Р. Наука 362, 770–775 (2018).
Солон-Бієт, С. М. та співавт. Cell Metab. 19, 418–430 (2014).
Пайпер, М. Д. В. та співавт. Cell Metab. 25, 610–621 (2017).
Солон-Бієт, С. М. та співавт. Нат. Метаб. 1, 532–545 (2019).
- Дієтичне рішення HunterFarmer У вас є метаболізм мисливця чи фермера Знайдіть досягнення своєї
- Жінка може мати постійну шкоду мозку після звіту про дієту з фруктовим соком
- Чудо метаболізму - 3 жирних пташенята на дієтичному співтоваристві для схуднення
- Дуже низькокалорійна дієта скасовує T2DM у щурів Ендокринологія
- Популярна кето-дієта може завдати шкоди травній системі