Дефіцит фактора росту фібробластів 21 посилює індуковану ожирінням атрофічну реакцію скелетних м’язів
Анотація
Передумови
Запалення скелетних м'язів, спричинене ожирінням, є головним фактором втрати/атрофії скелетних м'язів і пов'язане з метаболічними ускладненнями, такими як резистентність до інсуліну. Відомо, що фактор росту фібробластів 21 (FGF21) є важливим метаболічним регулятором із протизапальними властивостями. Однак вплив FGF21 на атрофію скелетних м’язів незрозумілий. У цьому дослідженні ми досліджували вплив дефіциту FGF21 на спричинене ожирінням запалення скелетних м’язів та атрофію у мишей.
Результати
Експресія атрофічних факторів (MuRF1 та Atrogin-1) регулювалася на рівні мРНК та/або білка в скелетних м'язах дефіцитних FGF21 мишей із ожирінням порівняно з контрольними мишами із ожирінням дикого типу. Це супроводжувалось підвищенням рівня запальних цитокінів (TNFα та MCP-1) та зменшенням фосфорилювання AMPK. Лікування FGF21 помітно пригнічувало TNFα-опосередковану запальну та атрофічну реакції в культивованих міотрубках, а дії FGF21 притуплялися сполукою С інгібітора AMPK.
Висновок
Ці дані свідчать про те, що дефіцит FGF21 посилює спричинене ожирінням запалення та атрофічні реакції скелетних м’язів ожирілих мишей, а FGF21 може захищати опосередковану запаленням атрофію через шлях AMPK.
Передумови
Ожиріння тісно пов'язане з втратою/атрофією маси скелетних м'язів, що називається саркопенією, що сприяє слабкості/фізичній ваді [1, 2] та метаболічним ускладненням, таким як резистентність до інсуліну та діабет 2 типу [3]. Індуковане ожирінням запалення скелетних м’язів, що характеризується підвищеним рівнем запальних цитокінів, таких як фактор некрозу пухлини α (TNFα) та інтерлейкін-6 (IL-6), сприяє дисбалансу в синтезі та деградації м’язових білків, що призводить до атрофії м’язів [4]. Зокрема, відомо, що система убиквітин-протеасома, основний шлях деградації білка, є критично важливою для втрати м’язів: система розкладає м’язові білки на дрібні пептиди, включаючи F-box м’язової атрофії (MAFbx, званий атрогін-1) та МІЖНИЙ РІНГ палець 1 (MuRF1) через аденозинтрифосфат-залежні ферментативні реакції [5,6,7]. Відомо, що TNFα безпосередньо індукує шлях убіквітин-протеасоми шляхом активації ядерного фактора-каппа B (NF-κB) у скелетних м’язах [8, 9]. Однак молекули, що беруть участь в індукованій ожирінням атрофії скелетних м’язів, залишаються невловимими.
У цьому дослідженні ми демонструємо, що дефіцит FGF21 посилює індуковану ожирінням атрофічну реакцію та запалення скелетних м’язів мишей, які отримували HFD. Крім того, лікування FGF21 захищає індуковані TNFα атрофічні відповіді в м’язових клітинах, і це було скасовано інгібітором АМФ-активованої протеїнкінази (AMPK).
Матеріали і методи
Культура клітин та лікування
Лінія клітин миобластів миші C2C12 (5 × 10 5 клітин/мл) вирощували при 37 ° C у 5% СО2 в DMEM (Life Technologies, Grand Island, NY, USA), що містить 10% FBS (Life Technologies) і 1% пеніциліну -стрептоміцин (Life Technologies). При впадінні 95–100% середовище замінювали середовищем для диференціювання [DMEM плюс 2% кінської сироватки (Life Technologies)], яке змінювали через 2 дні. Щоб вивчити вплив FGF21 на індуковану TNFα атрофію м’язів, диференційовані міотрубки обробляли протягом 24 годин 100 нг/мл TNFα (Pepro Tech), rmFGF21 (Creative Biomart, Shirley, NY, USA) або обох препаратів у комбінації. Для вивчення зв'язку між ефектом FGF21 на індуковану TNFα атрофію м’язів та AMPK, міотрубки C2C12 обробляли rmFGF21, 20 мкМ сполукою C (інгібітор AMPK, Sigma) та/або 0,5 мМ 5-аміноімідазол-4-карбоксамід-рибонуклеотид ( AICAR, активатор AMPK, Sigma).
Експеримент на тваринах
Мишей з дефіцитом FGF21 (FGF21 нокаутом/KO) на фоні C57BL/6 було придбано в лабораторії Джексона (Бар-Харбор, штат Мексика, США) і виведено в конкретному приміщенні, що не містить патогенів, в Ульсанському університеті. Самців мишей з дефіцитом FGF21 та їх дикого типу (WT) у віці 7 тижнів індивідуально утримували у пластикових клітках із 12-годинним темним циклом світло: 12 годин. Щоб вивчити вплив FGF21 на атрофію скелетних м’язів при ожирінні, мишей протягом 12 тижнів годували дієтою з високим вмістом жиру (HFD) (60% калорій у вигляді жиру від сала та соєвої олії; Research Diets, Нью-Брансвік, Нью-Джерсі, США). і отримали вільний доступ до їжі та води. Тварин приносили в жертву задушенням СО2, а їх м’язи розтинали. Усі догляди за тваринами та процедури проводились відповідно до протоколів та керівних принципів, затверджених Комітетом з догляду та використання тварин Ульсану (LNY-16-020).
Активність NF-κB
Активність зв'язування ДНК NF-κB оцінювали за допомогою набору TransF NF-κB p65 (Active Motif, Rixensart, Бельгія). Зразки тканинних гомогенатів або міотрубок, нормалізованих за вмістом білка, інкубували з іммобілізованими олігонуклеотидами, що містять сайт зв'язування консенсусом NF-κB. Активність зв'язування ДНК аналізували за допомогою антитіл, специфічних для субодиниць NF-κB, відповідно до інструкцій виробника (Active Motif).
ПЛР-аналіз у реальному часі
Загальну РНК екстрагували з міотрубок або зразків м’язової тканини за допомогою триреагенту (Life Technologies, Карлсбад, Каліфорнія, США). Два аліквоти загальної РНК у мікрограмах були зворотно транскрибовані в кДНК з використанням зворотної транскриптази M-MLV (Promega, Madison, WI, USA). ПЛР-ампліфікацію в реальному часі кДНК проводили за допомогою набору SYBR premix Ex Taq (TaKaRa Bio Inc., Фостер, Каліфорнія, США) за допомогою кісток Therm Cycler (TaKaRa Bio Inc., Otsu, Siga, Japan). Всі реакції проводили за однаковою схемою: 95 ° C протягом 10 с, 45 циклів при 95 ° C протягом 5 с і 60 ° C протягом 30 с. Результати аналізували за допомогою програмного забезпечення Real Time System TP800 (TaKaRa Bio Inc.), і всі значення нормалізували до рівнів гена ведення домашнього господарства, β-актину. Праймери, використані в аналізі, наведені в таблиці 1.
Вестерн-блот-аналіз
Тканини і клітини гомогенізували в буфері для лізису, що містив 150 мМ NaCl, 50 мМ Tris-HCl, 1 мМ EDTA, 50 мМ NaF, 10 мМ Na4P2O7, 1% IGEPAL, 2 мМ Na3VO4, 0,25% інгібітора протеази та 1% інгібітора фосфатази. коктейль. Гомогенати центрифугували при 12000 g протягом 20 хв при 4 ° C. Зразки, що містять 10
100 мкг загальних білків піддавали Вестерн-блот-аналізу з використанням поліклональних антитіл, специфічних до MuRF1 (1: 1000, # sc-32,920, Santa Cruz Biotechnology, Санта-Крус, Каліфорнія, США), Atrogin-1 (1: 1000, # AP2041, ECM Biosciences, Версаль, Кентуккі, США), фосфорильований-еукаріотичний фактор інгібування 2 α (eIF2α, 1: 1000, # 3597, Cell Signaling Technology, Danvers, MA, USA), eIF2α (1: 1000, # 9722, Cell Signaling), фосфорильована протеїнкіназа РНК-подібна ендоплазматична сітка кіназа (PERK, 1: 1000, # 12814, Signalway Antibody, College Park, MD, USA), PERK (1: 1000, # 3192, Cell Signaling), фосфорильована-AMPK (1: 1000, # 2531, Cell Signaling), AMPK (1: 1000, # 2332, Cell Signaling) та α-тубулін (1: 5000, ab7291, Abcam, Cambridge, MA, USA). Білкові смуги були виявлені за допомогою посиленого набору хемілюмінесценції (PerkinElmer, Waltham, MA, USA) та оцінювались за допомогою ImageQuant LAS4000 (GE Healthcare). Інтенсивність білка визначали кількісно за допомогою денситометрії за допомогою програмного забезпечення Image J.
Гістологічний аналіз
Тканини скелетних м’язів (квадрицепси) фіксували на ніч при кімнатній температурі у 10% формальдегіді та вкладали у парафін. Тканини розрізали (товщиною 8 мкм), фарбували гематоксилін-еозином (H&E), насаджували на предметне скло. Пофарбовані зрізи спостерігали за мікроскопом Axio-Star Plus (Carl Zeiss, Геттінген, Німеччина). Діаметри м’язових волокон визначали за допомогою мікроскопа AxioVision. Чотири мікроскопічні поля для зразків були підраховані при збільшенні в 200 разів.
Статистичний аналіз
Результати представлені як середнє значення ± SEM значень, отриманих в результаті повторних експериментів. Усі експерименти повторювали 3–4 рази. Статистичний аналіз проводили за допомогою t-критерію Стьюдента або одностороннього ANOVA (дисперсійний аналіз) з подальшим тестом багаторазового порівняння Ньюмана-Кілза з програмним забезпеченням Prism 5.0 (Graphic Pad, Сан-Дієго, Каліфорнія, США). Відмінності вважалися значними при P
Результати
Нокаут FGF21 індукує атрофічні реакції в скелетних м’язах мишей, що харчуються HFD
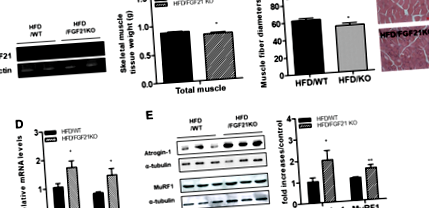
У цьому дослідженні ми розглянули, чи не викликає відсутність FGF21 атрофічну відповідь скелетних м’язів, спричинену ожирінням. Ми вперше підтвердили, що мРНК FGF21 відсутня в скелетних м’язах мишей з дефіцитом FGF21 (рис. 1а). Вага тіла мишей з дефіцитом FGF21, яким давали HFD, не відрізнялася від маси мишей WT, що годувались HFD (HFD/WT: 44,75 ± 1,65 г, HFD/FGF KO: 45,61 ± 1,09 г). Ваги скелетної м’язової тканини були нижчими у мишей з дефіцитом FGF21, що годувались HFD, ніж у мишей, які годували HFD (рис. 1b). Гістологічне дослідження поперечних зрізів чотириголового м’яза показало, що середній діаметр м’язового волокна був меншим у мишей з дефіцитом FGF21, що годувались HFD, ніж у мишей WT, які годували HFD (рис. 1c). Далі ми визначили атрофічні відповіді скелетних м’язів мишей з дефіцитом WT та FGF21, які годували HFD. Як показано на рис. 1г, рівні транскриптів атрофічних генів, таких як MuRF1 та Атрогін-1, регулювались у скелетних м’язах у мишей з дефіцитом FGF21, що годувались HFD, порівняно з мишами WT, що годувались HFD. Вестерн-блот-аналіз показав, що рівні атрофічних білків (MuRF1 та Atrogin-1) були збільшені у мишей з дефіцитом FGF21, що годувались HFD, порівняно з мишами WT, що годувались HFD (рис. 1д).
Нокаут FGF21 викликає запалення та стрес ендоплазматичної сітки (ER) в скелетних м’язах мишей, що харчуються HFD
Далі ми визначили вплив дефіциту FGF21 на запальні реакції у мишей із ожирінням HFD. Рівні експресії запальних цитокінів помітно підвищувались у скелетних м’язах у мишей з дефіцитом FGF21, що годувались HFD, порівняно з мишами WT, що годувались HFD (рис. 2а). Згодом ми підтвердили, що сигнальна молекула запалення, оцінена за активністю субодиниці NF-κB p65, посилюється в скелетних м'язах мишей з дефіцитом FGF21, що харчуються HFD (рис. 2b). Поряд з цим ми спостерігали рівні кількох маркерів стресу ER (p-eIF2α та p-PERK) та експресію мРНК гомологічного білка, що зв’язує CCAAT-енхансер, (CHOP), які були збільшені в скелетних м’язах FGF21-, що харчується HFD- дефіцитних мишей у порівнянні з мишами WT, що харчуються HFD (рис. 2c-d).
Вплив FGF21 на індуковані TNFα атрофічні відповіді в міотрубах
Продукція TNFα підвищена при запальних станах, спричинених ожирінням, і сприймається як головний медіатор атрофії м’язів. Тут ми спочатку дослідили вплив лікування FGF21 на індуковану TNFα атрофію м’язів у міотрубках C2C12, проаналізувавши зміни морфологічного вигляду міотрубок C2C12, оброблених TNFα. Лікування TNFα значно зменшило діаметр міотрубки (рис. 3a), тоді як лікування FGF21 повністю відновило індуковане TNFα зменшення діаметра міотрубки (рис. 3a). Згодом ми дослідили, чи не змінює FGF21 експресію Atrogin-1 та MuRF1, які є маркерами атрофії м'язів. Для цього міотрубки обробляли TNFα, а атрофічні маркери визначали за допомогою RT-PCR та/або вестерн-блот-аналізу. Лікування FGF21 значно знижувало рівень транскрипції Atrogin-1 та MuRF1 (рис. 3b), а також знижувало рівні експресії білків Atrogin-1 та MuRF1 у міотрубах C2C12, оброблених TNFα (рис. 3c і d). Потім ми вивчили, чи впливала терапія FGF21 на стимульованих TNFα міотрубках C2C12 на стрес ER та сигнальні шляхи NF-κB. Лікування FGF21 оброблених TNFα міотрубок C2C12 призвело до зниження фосфорилювання eIF2α (рис. 3д) та інактивації NF-κB (рис. 3е).
rmFGF21 активований AMPK у клітинах C2C12 та скелетних м’язах ожиріних мишей, що харчуються HFD
Щоб підтвердити, чи вплив FGF21 на індуковану ожирінням атрофію скелетних м’язів пов’язаний з AMPK, ми досліджували фосфорилювання AMPK методом Вестерн-блот. Дефіцит FGF21 суттєво зменшив фосфорилювання AMPK у м’язах мишей, що харчуються HFD (рис. 4а). Інкубація міотрубок C2C12 з rmFGF21 призвела до дозозалежного збільшення фосфорилювання AMPK (рис. 4b). Крім того, ми дослідили, чи відповідає AMPK за опосередкування ефекту rmFGF21. З'єднання С інгібітора AMPK пригнічувало інгібуючу дію rmFGF21 на індуковані TNFα атрофічні відповіді в міотрубах (рис. 4в). Цей результат вказує на те, що дія FGF21 опосередковується за допомогою активації AMPK.
Обговорення
Висновок
На закінчення ми демонструємо, що дефіцит FGF21 посилює спричинене ожирінням запалення скелетних м'язів та атрофію у мишей із ожирінням, що харчуються HFD, що супроводжується активацією NF-κB та придушенням фосфорилювання AMPK. Лікування FGF21 у м’язових клітинах захищає від індукованих TNFα атрофічних реакцій через шлях AMPK. FGF21 може бути потенційною мішенню у боротьбі з атрофією скелетних м'язів, пов'язаної з ожирінням.
Наявність даних та матеріалів
Усі дані, отримані або проаналізовані під час цього дослідження, включені в цю опубліковану статтю.
- Межі адаптуються до холоду Роль ендогенного фактора росту фібробластів 21 у
- Дефіцит гормону росту у дорослих Причини, симптоми та лікування
- Вплив харчового дефіциту міді на активність фактора згортання плазми у чоловіків та жінок
- Ефективність росту та ознаки туші, відповіді на зерно сухих дистиляторів з розчинним живленням
- Вплив бромокриптину на реакції інсуліну, гормону росту та пролактину на аргінін при ожирінні