Інгібування ферментів
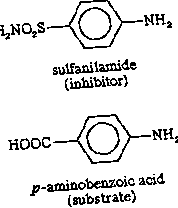
Деякі молекули, дуже схожі на субстрат для ферменту, можуть бути пов'язані з активним центром, але не можуть реагувати. Такі молекули покривають активний центр і тим самим перешкоджають прив'язуванню фактичного субстрату до місця. Це пригнічення дії ферменту має конкурентний характер, оскільки молекула інгібітора фактично конкурує з субстратом для активного центру. Наприклад, інгібітор сульфаніламід досить схожий на субстрат (р-амінобензойна кислота) ферменту, який бере участь у метаболізмі фолієвої кислоти, і він зв'язується з ферментом, але не може реагувати. Він покриває активний центр і запобігає зв’язуванню р-амінобензойної кислоти. Цей фермент важливий для деяких хвороботворних бактерій, але не є важливим для людини; Тому велика кількість сульфаніламіду вбиває мікроорганізм, але не шкодить людині. Такі інгібітори, як сульфаніламід, називаються антиметаболітами. Сульфаніламід та подібні сполуки, які вбивають збудника, не завдаючи шкоди своєму господареві, широко застосовуються в хіміотерапії.
Деякі інгібітори запобігають або блокують ферментативну дію, реагуючи з групами в активному центрі. Наприклад, нервово-газовий діізопропілфторфосфат реагує із серином в активному центрі ацетилхолінестерази, утворюючи ковалентний зв’язок. Молекула нервового газу, що бере участь у формуванні зв’язку, перешкоджає активному центру зв’язувати субстрат, ацетилхолін, тим самим блокуючи каталіз та нервову дію. Йодооцтова кислота так само блокує ключовий фермент у дії м’язів, утворюючи об’ємну групу на амінокислоті цистеїн, яка знаходиться в активному центрі ферменту. Цей процес називається незворотним гальмуванням.
Деякі інгібітори модифікують амінокислоти, крім активних, що призводять до втрати ферментативної активності. Інгібітор викликає зміни форми активного центру. Однак деякі амінокислоти, крім активних, можуть бути модифіковані, не впливаючи на структуру активного центру; у цих випадках ферментативна дія не позначається.
Такі хімічні речовини змінюють паралельні природні мутації. Спадкові захворювання часто виникають внаслідок зміни амінокислоти в активному центрі ферменту, що робить фермент дефектним. У деяких випадках зміна амінокислоти змінює форму активного центру настільки, що він більше не може реагувати; такі захворювання, як правило, смертельні. Однак в інших утворюється частково неповноцінний фермент, і людина може бути дуже хвора, але здатна жити.
Вплив температури
Ферменти функціонують найбільш ефективно у фізіологічному діапазоні температур. Оскільки ферменти є молекулами білка, вони можуть руйнуватися при високих температурах. Прикладом такого руйнування, що називається денатурацією білка, є згортання молока при його кип’ятінні. Підвищення температури має два впливи на фермент: по-перше, швидкість реакції дещо зростає, оскільки швидкість хімічних реакцій має тенденцію до збільшення з підвищенням температури; і, по-друге, фермент денатурований. Підвищення температури, таким чином, збільшує швидкість метаболізму лише в обмежених межах. Якщо температура стає занадто високою, денатурація ферментів руйнує життя. Низькі температури також змінюють форму ферментів. При ферментах, чутливих до холоду, зміна спричиняє втрату активності. Тому надмірна кількість холоду та тепла шкодить ферментам.
Ступінь кислотності або основного розчину, який виражається як рН, також впливає на ферменти. Коли кислотність розчину змінюється - тобто рН змінюється - настає точка оптимальної кислотності, при якій фермент діє найбільш ефективно. Хоча цей оптимум рН змінюється залежно від температури і на нього впливають інші складові розчину, що містить фермент, він є характерною властивістю ферментів. Оскільки ферменти чутливі до змін кислотності, більшість живих систем сильно забуферовані; тобто вони мають механізми, які дозволяють підтримувати постійну кислотність. Цей рівень кислотності, або рН, становить близько 7 у більшості організмів. Деякі бактерії функціонують в помірно кислих або основних умовах; а травний фермент пепсин діє в кислому середовищі шлунка.
Гнучкість ферменту та алостеричний контроль
Теорія наведеної придатності
Гіпотеза замка ключа (див. Вище Природа реакцій, що каталізуються ферментами) не повністю враховує ферментативну дію; тобто певні властивості ферментів неможливо пояснити простим взаємозв’язком між ферментом та субстратом, запропонованим гіпотезою блокування ключа. Теорія, що називається теорією індукованого прилягання, зберігає ідею замка ключа на припасування підкладки до активної ділянки, але крім того постулює, що підкладка повинна робити більше, ніж просто вписуватися у вже сформовану форму активної ділянки. Швидше, згідно з теорією, зв’язування субстрату з ферментом повинно спричинити зміну форми ферменту, що призводить до належного вирівнювання каталітичних груп на його поверхні. Ця концепція була порівняна з припасом руки в рукавичці, рука (субстрат) викликає зміну форми рукавички (ферменту). Хоча деякі ферменти, здається, функціонують згідно з давньою гіпотезою замка ключа, найбільш очевидно, вони функціонують згідно з теорією індукованої придатності.
Як правило, субстрат наближається до поверхні ферменту і викликає зміну його форми, що призводить до правильного вирівнювання каталітичних груп. Наприклад, у випадку травного ферменту карбоксипептидази, зв’язування субстрату змушує молекулу тирозину в активному центрі рухатися на цілих 15 ангстрем. Каталітичні групи в активному центрі реагують із субстратом, утворюючи продукти. Продукти відокремлюються від поверхні ферменту, і фермент здатний повторювати послідовність. Несубстратні молекули, які занадто об’ємні або занадто малі, змінюють форму ферменту, так що відбувається невідповідність каталітичних груп; такі молекули не здатні реагувати, навіть якщо їх привертає активний центр.
Теорія індукованої придатності пояснює ряд аномальних властивостей ферментів. Прикладом є "неконкурентне інгібування", коли сполука пригнічує реакцію ферменту, але не перешкоджає зв'язуванню субстрату. У цьому випадку сполука інгібітора притягує зв'язуючу групу, так що каталітична група знаходиться занадто далеко від субстрату, щоб реагувати. Сайт, в якому інгібітор зв'язується з ферментом, не є активним центром і називається алостеричним сайтом. Інгібітор змінює форму активного центру, щоб запобігти каталізу, не перешкоджаючи зв'язуванню субстрату.
Інгібітор також може спотворювати активний центр, впливаючи на основну групу зв'язування; в результаті фермент вже не може залучати субстрат. Так звана молекула-активатор впливає на активний центр, так що молекула, що не є субстратом, правильно вирівняна і, отже, може реагувати з ферментом. Такі активатори можуть впливати як на зв'язуючі, так і на каталітичні групи в активному центрі.
Гнучкість ферменту надзвичайно важлива, оскільки вона забезпечує механізм регулювання ферментативної активності. Орієнтація в активному центрі може бути порушена зв'язуванням інгібітора в іншому місці, крім активного. Більше того, фермент може активуватися молекулами, які викликають належне вирівнювання активного центру для субстрату, який сам по собі не може викликати це вирівнювання.
Як уже згадувалося вище, ділянки, які пов'язують інгібітори та активатори, називаються алостеричними, щоб відрізнити їх від активних. Алостеричні ділянки насправді є регуляторними ділянками, здатними активувати або пригнічувати ферментативну активність, впливаючи на форму ферменту. Коли активатор або інгібітор дисоціює від ферменту, він повертається до своєї нормальної форми. Таким чином, гнучкість білкової структури дозволяє працювати просту, оборотну систему управління, подібну до термостата.
Види алостеричного контролю
Алостеричний контроль може діяти різними способами; два приклади служать для ілюстрації деяких загальних ефектів. Шлях, що складається з десяти ферментів, бере участь у синтезі амінокислоти гістидину. Коли клітина містить достатню кількість гістидину, синтез припиняється - відповідний економічний рух клітини. Синтез зупиняється інгібуванням першого ферменту на шляху продуктом, гістидином. Інгібування ферменту продуктом називається інгібуванням зворотного зв'язку; тобто продукт, що видаляється з початкового ферменту на багато етапів, блокує його дію. Інгібування зворотного зв’язку відбувається у багатьох шляхах у всьому живому.
Алостеричний контроль також можна досягти за допомогою активаторів. Гормон адреналін (адреналін) діє таким чином. Коли потрібна енергія, адреналін вивільняється і активує аллостеричною активацією фермент аденилциклаза. Цей фермент каталізує реакцію, в якій сполука циклічний аденозинмонофосфат (циклічний АМФ) утворюється з АТФ. Циклічний АМФ, у свою чергу, діє як алостеричний активатор ферментів, що прискорюють метаболізм вуглеводів, виробляючи енергію. Цей тип алостеричної регуляції також широко поширений в біологічних системах. Таким чином, комбінація алостеричної активації та гальмування дозволяє виробляти енергію або матеріали, коли вони потрібні, і зупиняє виробництво, коли запас достатній.
Алостеричний контроль - це швидкий метод регулювання продуктів, постійно необхідних живим істотам. Проте деякі клітини не потребують певних ферментів, і клітині було б марно їх синтезувати. У цьому випадку певні молекули, звані репресорами, перешкоджають синтезу непотрібних ферментів. Репресори - це білки, які зв'язуються з ДНК і перешкоджають першому кроку в процесі, що призводить до синтезу білка. Якщо до клітин, яким потрібен фермент, додають певні метаболіти, відбувається синтез ферменту, тобто він індукується. Додавання галактози до середовища росту, що містить бактерії кишкової палички, наприклад, індукує синтез ферменту бета-галактозидази. Таким чином, бактерії можуть синтезувати цей фермент, що метаболізує галактозу, коли він необхідний, і запобігати його синтезу, коли цього немає. Спосіб індукування або репресії синтезу ферментів у системах ссавців менш зрозумілий, але вважається подібним.
Різні типи клітин у складних організмах мають різні ферменти, хоча вони мають однаковий вміст ДНК. Насправді синтезовані ферменти є тими, які необхідні в конкретній клітині і змінюються не тільки для різних типів клітин, наприклад, нервових, м’язових, очних та шкірних клітин, але й для різних видів.
У ферменті, що складається з декількох субодиниць, або ланцюгів, зміна форми однієї ланцюга в результаті впливу або молекули субстрату, або алостеричних інгібіторів або активаторів може змінити форму сусідньої ланцюга. В результаті зв’язування другої молекули субстрату відбувається інакше, ніж зв’язування першої, а третя відрізняється від другої. Це явище, зване кооперативністю, характерне для алостеричних ферментів. Кооперативність відображається сигмовидною кривою порівняно з гіперболічною кривою Майкеліса – Ментена. Фермент з декількох субодиниць, який виявляє кооперативність, набагато чутливіший до механізмів управління, ніж фермент однієї субодиниці, а отже, і одного активного центру.
Перший приклад кооперативності спостерігався в гемоглобіні, який не є ферментом, але багато в чому поводиться як один. Поглинання кисню в легенях і його відкладення в тканинах набагато ефективніше, оскільки субодиниці гемоглобіну демонструють позитивну кооперативність, так звану, оскільки перша молекула субстрату полегшує зв’язування наступної.
Негативна кооперативність, при якій зв’язування однієї молекули полегшує зв’язування наступної, також відбувається у живих істотах. Негативна кооперативність робить фермент менш чутливим до коливань концентрацій метаболітів і може бути важливим для ферментів, які повинні бути присутніми в клітині на відносно постійних рівнях активності.
Деякі ферменти - це тісно пов'язані сукупності кількох ферментних одиниць; наприклад, піруватдегідрогеназна система містить п’ять різних ферментів, має загальну молекулярну масу 4 000 000 і складається з чотирьох різних типів ланцюгів. Очевидно, ферменти в клітинах можуть бути організовані шляхом утворення складних одиниць, всмоктування на клітинній стінці або шляхом виділення мембранами в спеціальних відділеннях. Оскільки шлях передбачає поетапну модифікацію хімічних сполук, агрегації ферментів у даному шляху полегшують їх функцію, подібну до промислової конвеєрної лінії.
- Багате білком і клітковиною, вівсяне молоко допомагає при схудненні; Ще кращі непереносимі люди до лактози можуть
- Purina ONE® Ідеальна вага Високобілковий сухий корм для котів Purina
- NOLA Харчування; Рішення для схуднення, ТОВ Відкрийте для себе ідеальний білковий протокол схуднення на NOLA
- Ознаки того, що ваш запас молока падає, і що робити Білковий порошок для грудного вигодовування молочного пилу
- Королівська спортивна білкова матриця 5 фунтів