Атиповий антипсихотичний оланзапін спричиняє збільшення ваги, орієнтуючись на рецептор серотоніну 2С
Калеб С. Лорд
1 Відділ досліджень гіпоталамуса, Департамент внутрішніх хвороб, і
Стівен Вайлер
1 Відділ досліджень гіпоталамуса, Департамент внутрішніх хвороб, і
Ронг Ван
1 Відділ досліджень гіпоталамуса, Департамент внутрішніх хвороб, і
Карлос М. Касторена
1 Відділ досліджень гіпоталамуса, Департамент внутрішніх хвороб, і
Ньюаз Ахмед
1 Відділ досліджень гіпоталамуса, Департамент внутрішніх хвороб, і
Діас Метью
1 Відділ досліджень гіпоталамуса, Департамент внутрішніх хвороб, і
Сіанн Лі
1 Відділ досліджень гіпоталамуса, Департамент внутрішніх хвороб, і
Чень Лю
1 Відділ досліджень гіпоталамуса, Департамент внутрішніх хвороб, і
2 Кафедра нейронауки, і
Джоель К. Ельмвіст
1 Відділ досліджень гіпоталамуса, Департамент внутрішніх хвороб, і
3 Кафедра фармакології, Південно-західний медичний центр UT, Даллас, штат Техас, США.
Пов’язані дані
Анотація
Атипові антипсихотичні засоби, такі як оланзапін, часто викликають надмірне збільшення ваги та діабет 2 типу. Однак механізми, що лежать в основі цих метаболічних збурень, викликаних наркотиками, залишаються недостатньо вивченими. Тут ми використовували експериментальну модель, яка відтворює гіперфагію та ожиріння, спричинені оланзапіном, у самок мишей C57BL/6. Ми виявили, що лікування оланзапіном різко збільшило споживання їжі, порушило толерантність до глюкози та змінило фізичну активність та витрати енергії у мишей. Крім того, індукована оланзапіном гіперфагія та збільшення ваги були притуплені у мишей, у яких відсутній рецептор серотоніну 2С (HTR2C). Нарешті, ми показали, що лікування HTR2C-специфічним агоністом лоркасерином пригнічувало індуковану оланзапіном гіперфагію та збільшення ваги. Лікування лоркасерином також покращило толерантність до глюкози у мишей, що годувались оланзапіном. У сукупності наші дослідження показують, що оланзапін чинить деякі свої несприятливі метаболічні ефекти через антагонізм HTR2C.
Вступ
Атипові антипсихотики (ААТП) - це антипсихотики другого покоління, які в даний час використовуються для лікування різних психічних станів, включаючи шизофренію, біполярний розлад, депресію та аутизм (1). Незважаючи на задокументовану ефективність та низький ризик розвитку екстрапірамідних симптомів, більшість AATP пов'язані з побічними ефектами метаболізму, викликаними наркотиками, включаючи надмірне збільшення ваги, дисліпідемію та діабет 2 типу (2). Примітно, що у пацієнтів із шизофренією тривалість життя зменшується, а метаболічний синдром, пов’язаний з ожирінням, є основною причиною смерті (2). Більше того, частота діабету серед споживачів AATP у 4 рази вища, ніж у контрольних груп за віком, расою та статтю (3). У той час як захворюваність на ожиріння та діабет 2 типу, як правило, вимагає років для розгортання серед загальної популяції, ці стани проявляються гостро (протягом декількох місяців) після лікування AATP (4). Швидкий початок захворювання свідчить про чітку етіологію, що лежить в основі AATP-індукованого метаболічного синдрому, який залишається недостатньо вивченим.
Результати і обговорення
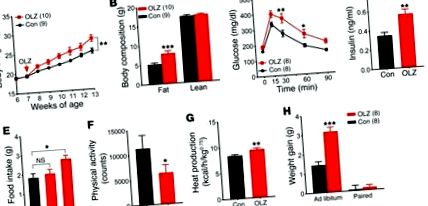
(A) Вага тіла. (B) Склад тіла. (C.) GTT. (D) Рівень інсуліну в плазмі крові. (Е-G) Метаболічний аналіз клітини (n = 6) споживання їжі (Е), фізична активність (F), а також виробництво тепла (G). (H) Збільшення ваги у мишей ad libitum - та на пару, що годувались. Результати відображаються як середнє значення ± SEM. * P Малюнок 2А). На відміну від мишей WT, миші Htr2c-нуль, що годувались оланзапіном, мали масу тіла та склад тіла, порівнянні з тими, яких годували контрольною дієтою (рис. 2, А та В). Крім того, лікування оланзапіном не суттєво змінило толерантність до глюкози або рівень інсуліну в плазмі крові натще у Htr2c-нульових мишей (рис. 2, С та D). Потім ми повторили аналіз метаболічної клітини у мишей Htr2c-null і виявили, що гіперфагія не розвинулася у мишей Htr2c-null після гострого впливу оланзапіну (рис. 2E та додатковий малюнок 3A). Навпаки, вплив оланзапіну на фізичну активність та витрати енергії зберігався у цих мишей. Подібно до мишей WT, Htr2c-нульові миші демонстрували знижену активність (рис. 2F) та збільшення виробництва тепла (рис. 2G), споживання O2 та вироблення CO2 (додатковий малюнок 3, B – D) після переходу на дієту. У сукупності наші висновки свідчать про те, що вплив оланзапіну на споживання їжі та збільшення ваги вимагає Htr2c, тоді як його вплив на фізичну активність та витрати енергії, ймовірно, включає додаткові рецептори. Відповідно до цього спостереження, Чи та його колеги нещодавно повідомили, що концентрат меланіну (МСН) необхідний для придушення оланзапіну рухової активності (21).
(A) Вага тіла. (B) Склад тіла. (C.) GTT. (D) Рівень інсуліну в плазмі крові. (Е-G) Метаболічний аналіз клітини (n = 6) споживання їжі (Е), фізична активність (F), а також виробництво тепла (G). Результати відображаються як середнє значення ± SEM. * P Малюнок 3B). Потім ми обробляли мишей лоркасерином, затвердженим FDA агоністом HTR2C або транспортним засобом протягом 7 днів, одночасно годуючи дієту оланзапіном (рис. 3А). Ми використовували анорексигенну дозу (10 мг/кг), яка пригнічувала споживання їжі у мишей, що голодували протягом ночі (Додаткова фігура 4). Ми вимірювали споживання їжі та масу тіла щодня під час лікування, а також через 2 тижні після останньої дози лоркасерину або транспортного засобу (Малюнок 3А). Характерно, що гіперфагія була очевидна у мишей, що годувались оланзапіном, але була послаблена лікуванням лоркасерином (рис. 3С). Відповідно до зменшення споживання їжі, ми виявили, що лоркасерин різко пригнічував набір ваги у мишей, що годувались оланзапіном (Рисунок 3D). Важливо, що ми спостерігали значне поліпшення толерантності до глюкози (день 8, малюнок 3F). Проте ослаблення набору ваги та поліпшення толерантності до глюкози не зберігалися після припинення лікування лоркасерином (рис. 3, Е та G, 22 день).
(A) Схема проекту експерименту. Самки мишей C57BL/6 (n = 16) спочатку годували дієтою оланзапіну протягом 6 тижнів, щоб вони набрали значно більше ваги, ніж ті, що годували контрольну дієту (n = 8). Потім їх розділили на 2 групи з однаковим числом і протягом 7 днів обробляли або носієм (VEH), або лоркасерином (LOR). Після медикаментозного лікування мишей ще 2 тижні годували дієтою оланзапіну. (B) Вага тіла. (C.) Щоденне споживання їжі. (D) Збільшення ваги під час лікування транспортним засобом або лоркасерином. (Е) Маса тіла до і після лікування наркотиками. (F і G) GTT. Результати відображаються як середнє значення ± SEM. * P (294K, pdf)
Подяка
Автори висловлюють подяку працівникам Південно-Західного метаболічного ядра фенотипування. Ми вдячні NIH за підтримку (R01 DK088423 та R37 DK053301 - JKE; R01 DK114036 - CL; T32> DK007307 - SCW; та F32 DK103449 - CCL). Ми дякуємо Американській кардіологічній асоціації за підтримку (16BGIA27260023 та 16SDG27260001 для CL). Цю роботу також підтримав стартовий фонд досліджень від Південно-західного медичного центру UT (до CL).
- Цільова політика щодо профілактики ожиріння Визначення критичного віку для збільшення ваги у жінок
- Безробіття, пов’язане із збільшенням ваги - причини - ожиріння
- Чому фізичних вправ недостатньо для запобігання набору ваги HuffPost Life
- На думку експертів, несподівана дієтична помилка, яка спричиняє збільшення ваги в карантині
- Використовуйте цей калькулятор збільшення ваги, щоб набрати вагу - здоров’я сім’ї