Артрофіброз: багатогранна імунологічна проблема
Артрофіброз після тотальної ендопротезування суглоба (TJA) - це ускладнення, яке може виникнути після заміни суглоба. Для запобігання артрофіброзу нам потрібно більше знати про складні причини.
Вільно рухливі суглоби класифікуються як «діартрози» і включають усі синовіальні суглоби тіла, напр. плече, лікоть, стегно, коліно та щиколотка, щоб назвати найбільші. Їх структурний та функціональний розвиток під час росту та старіння людини досить складний і характеризується різноманітними клітинними діями, реакціями та взаємодіями клітинного та позаклітинного матриксу. Усі ці суглоби можуть розвинути артрофіброз, фіброзну суглобову хворобу, пов’язану із симптомами зменшеного обсягу рухів (ПЗП), а також, можливо, болем та набряками після різних форм та ступенів травми, хірургічного втручання або інфекції.
У цій короткій оглядовій статті ми зупинимось на асептичному (безінфекційному) артрофіброзі після тотальної ендопротезування суглобів (TJA), зокрема після тотальної ендопротезування коліна (TKA). Але згідно з сучасними даними та досвідом, симптоми, макроскопічні ознаки, гендерні відмінності, патогенез та запальні фактори стосуються всіх раніше згаданих синовіальних суглобів та захворювань. 1, 2
Показання до ендопротезування колінного суглоба в більшості випадків ґрунтуються на зростаючій нерухомості пацієнта внаслідок запущеного остеоартриту (ОА) ураженого колінного суглоба. 3 Рішення пацієнта щодо протезування колінного суглоба за рекомендацією лікуючого хірурга-ортопеда служить меті відновити безболісну рухливість.
Це тим більше протверезіє, коли ця мета не досягнута післяопераційно на етапі реабілітації та далі, незважаючи на правильно встановлений протез та інший без ускладнень внутрішньо- та післяопераційний курс. Беручи до уваги дуже добрі наукові та соціально-економічні докази великого успіху сучасного ендопротезування, виникає питання щодо частоти постпротезного артрофіброзу та їх причини.
У цьому контексті прикро, що ендопротезні реєстри не фіксують це ускладнення як специфічне ускладнення після первинної TJA (наприклад, TKA), але що артрофіброз як такий реєструється лише тоді, коли видається необхідною ревізійна операція. 4 Іноді все ще стверджують, що це ускладнення є рідкісним, але недавня література оцінює показники артрофіброзу, наприклад, ТКА, від 0,2% до 10% .5 Але реальна частота нелікованого артроброзу невідома, 6 - обставина, яка вкрай незадовільна для кожного зацікавленого пацієнта. Наприклад, якщо уражений колінний суглоб, навіть втрата розгинання на 5 ° може призвести до проблем з ходьбою, а дефіцит згинання (згинання менше 90 °) може призвести до значної інвалідності при сидінні, підйомі по сходах, заходженні та виїхати з машини і їхати. Крім того, ці пацієнти страждають від болю, втрати рухливості та активності на роботі та у вільний час, стану, як до ендопротезування, або, можливо, навіть гіршої ситуації. 7
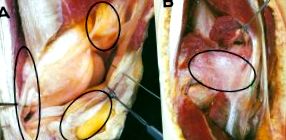
Ця ситуація є стресовою та неприйнятною для партнерських відносин між пацієнтом, хірургом-ортопедом у приватній практиці та лікуючим хірургом. Це неминуче призводить до питання про можливі причини постпротезного артрофіброзу. Простіше кажучи, це фіброз і, отже, патологічне розростання сполучної тканини в різних відділах та оточуючих суглобах та стабілізуючих структурах капсулолігаментного комплексу. Це показано наочно для колінного суглоба, щоб проілюструвати складність анатомії та потенційно уражених областей (див. Рис. 1).
Патогенез та запальні ключові гравці TJA-індукованого артрофіброзу
Багато вчених досі припускають, що артрофіброз, як і інші фібрози органів, такі як печінка або легені, дотримується загального основного механізму запалення. Але Ашер та ін. подивіться на це більш диференційовано, оскільки клітинна структура та спеціалізація клітин цих органів повністю відрізняється від слизової оболонки суглоба, капсули та сполучної тканини.6 Хоча, як видається, у всіх тканинах задіяний ключовий клітинний актор, який називається фібробластом, біологічний тип клітин, який синтезує позаклітинний матрикс (ЕКМ), такий як колагени, і виробляє структурний каркас (строму) для тканин тварин, слід зазначити, що фібробласт легеневих каркасів - це не те саме, що фібробласт слизової оболонки тощо8. Крім того, інші ключові гравці - це гістіоцити, локалізовані (тканиноспецифічні) клітини, які роблять фагоцитоз або презентацію антигену.
Гістіоцити - це повністю диференційовані ефекторні клітини вродженої імунної системи (ІС), отримані з моноцитів/макрофагів або Лангерганса/дендритних клітин. 9 Ці та інші клітини ІС, такі як лімфоцити (адаптивна ІС) та тучні клітини, іншого типу клітин, розташованих у сполучній тканині та слизовій оболонці та важливих як для вродженого, так і для адаптивного імунітету, реагують на зовнішні подразники, такі як фізичний (наприклад, механічний) стрес та чужорідний матеріал/біоматеріал (наприклад, колінний протез, кістковий цемент) і викликають надзвичайно складні молекулярні та клітинні реакції, які, з одного боку, можуть призвести до утворення стороннього тіла, викликаного запаленням, а з іншого - до утворення міофібробластів.
Нарешті, всі згадані вище імунні клітини вкрай складно взаємодіють із тканиноспецифічними та пристосованими до функції/фібробластами та впливають на їх місцеву поведінку та профіль молекулярної експресії, секрецію, формування сполучної тканини, реконструкцію та, нарешті, рубцеву тканину/виготовлення спайок. 6 Скорочення цієї рубцевої тканини або спайок призводять до макроскопічного та клінічного явища ПЗП та основного імунологічно викликаного запалення до болю та набряку (див. Рис. 2).
Якщо врахувати ці кореляції, які лише поступово розкриваються і розуміються у всій їх складності, то поширена в даний час ідея про те, що фібробласт - це те саме, що фібробласт, виглядає дуже наївною.
Які фактори ризику розвитку артрофіброзу після ТЯ?
Зважаючи на виявлену проблему, виникає питання про те, які загальні та специфічні для пацієнта фактори ризику існують. В даний час не існує встановленої методики визначення ризику розвитку постпротезного артрофіброзу. Тим не менше, існує безліч ознак того, які фактори можуть зіграти свою роль. Тип та ступінь існуючого ОА та занадто ранні показання для протезування колінного суглоба можуть бути причиною післяопераційного атрофіброзу, оскільки хірургічне втручання виконується при субхронічному запаленні. Крім того, попередні тупі, а також поверхнево-деструктивні пошкодження колінного суглоба при консервативному та особливо хірургічному лікуванні можуть значно збільшити ризик.
З метою відстрочки остаточного протезного відновлення коліна в певних випадках застосовується ортопедична корекційна операція, така як репозиційна остеотомія з тимчасовим введенням стороннього матеріалу (пластини та гвинтів). Це означає, що в ідеалі ТКА передують дві операції, що відкриває імунологічний шлях для можливого постпротезного артрофіброзу. Іншими попередніми операціями можуть бути діагностичні та терапевтичні артроскопії колінного суглоба з ушкодженими пошкодженнями або без них (наприклад, меніска або зв’язки), які можуть підготувати імунні клітини, розташовані в синовіальній мембрані суглобової капсули, тощо для подальшого перевищення запальної реакції.
Факторами, характерними для пацієнта, є запальні ревматичні захворювання, аутоімунні захворювання, такі як діабет I типу, а також метаболічний або віковий діабет II типу. Іншими факторами ризику можуть бути генетичні схильності до мутацій імунної системи або генів, які беруть участь, наприклад, в обміні колагену. Нарешті, але не менш важливо, слід також згадати гендерні відмінності. Деякі дослідження вказують на те, що у жінок артрофіброз розвивається у 2,5-2,8 рази частіше, ніж у чоловіків, хоча ці дослідження стосуються лише артрофіброзу плечового суглоба (заморожене плече) та заміщення АКЛ в колінному суглобі. 10-12 Дані про ситуацію після первинного протезування колінного суглоба наразі відсутні.
Рис. 2 На лівій фігурі показано фронтальний вид ендопротеза коліна. Справа схематично показані основні клітинні гравці, які беруть участь у формуванні артрофіброзу
Сучасні методи лікування та майбутні підходи
Серед різних терапевтичних варіантів, які в даний час використовуються та обговорюються для уникнення або усунення постпротезного артрофіброзу, слід розрізняти немедикаментозні процедури та процедури на основі лікарських препаратів або дієт. Нефармакологічні процедури включають ранню фізіотерапевтично контрольовану мобілізацію та фізичні процедури з використанням апаратів безперервного пасивного руху (CPM), як відразу після операції, так і інвазивних методів, таких як хірургічний лізис та видалення спайок або маніпуляції під наркозом (MUA), часто поєднуються з артроскопічним контрольованим артролізом., після виявленого артрофіброзу. 13
Наразі медикаментозне лікування по суті обмежується післяопераційним введенням нестероїдних протизапальних препаратів (НПЗЗ). Щодо призначення інших протизапальних препаратів та так званих біопрепаратів, таких як антитіла проти трансформуючого фактора росту-ß (TGF-ß), інтерлейкіну-1 (IL-1) або фактора некрозу пухлини-α (TNF-α), Дані та докази дуже заплутані, і тому не будуть тут обговорюватися далі.
Це також стосується певних дієтичних форм, таких як дієта, що містить омега-3 жирні кислоти, або прийом так званих харчових добавок, таких як антиоксиданти, а також екзотичних ідей, таких як внутрішньосуглобові ін'єкції колагенази, методи мобілізації м'яких тканин та низькі доза опромінення перед операцією.
На наш погляд, повідомлення цієї статті полягає в тому, що можна буде уникнути постпротезного артрофіброзу наскільки це можливо. Це вимагає всебічного розуміння запалення та іммунології імплантатів, кращих діагностичних параметрів і, на основі цього, безпечної та обгрунтованої фармакологічної терапії для конкретного пацієнта та консервативної терапії, що не стосується лікарських засобів.
Список літератури
- Chen AF et al. ‘Артрофіброз та великі рубці на суглобах’. Дослідження сполучної тканини. 2019; 60 (1): 21-28.
- Krenn V, Morawietz L, Perino G, et al. «Переглянута гістопатологічна консенсусна класифікація патології, пов’язаної з імплантацією суглобів». Pathol Res Pract. 2014; 210 (12): 779-786
- Gademan MG, Hofstede SN, Vliet Vlieland TP, Nelissen RG, Marang-van de Mheen PJ. «Критерії вказівки на повне ендопротезування кульшового суглоба та коліна при остеоартрозі: огляд сучасного стану». BMC опорно-руховий апарат. 2016; 17 (1): 463
- Калсон Н.С. та ін. „Міжнародний консенсус щодо визначення та класифікації фіброзу колінного суглоба“. Bone Joint J. 2016; 98-B: 1479–1488
- Намба Р.С. та ін. „Фактори ризику загальної асептичної ендопротезування колінного суглоба“. J Артропласт. 2013; 28: 122–127
- Ашер К.М., Чжу С., Мавропаліас Г., Карріно Дж., Чжао Дж., Сю Дж. ‘Патологічні механізми та терапевтичні перспективи артрофіброзу’. Кістка Res. 2019; 7: 9
- Scholtes SA, Khoo-Summers L, Damico KJ. «Презентація та лікування артрофрозу коліна: звіт про випадок». Практика фізичної теорії. 2017; 33: 815–824
- Лінч доктор медичних наук, Ватт ФМ. «Неоднорідність фібробластів: наслідки для захворювання людини». J Clin Invest. 2018; 128 (1): 26–35
- Gordon S, Plüddemann A. ‘Тканинні макрофаги: неоднорідність та функції’. BMC Biol. 2017 р .; 15: 53
- White D, Choi H, Peloquin C, Zhu Y, Zhang Y. ‘Світська тенденція адгезивного капсуліту’. Догляд за артритом Res. 2011; 63: 1571-1575
- Сандерс Т.Л. та співавт. «Процедурне втручання при артрофрозі після реконструкції АКЛ: тенденції протягом двох десятиліть». Колінний хірургічний травматичний артроск. 2017; 25: 532–537
- Nwachukwu, BU та ін. „Артрофроз” після реконструкції передньої хрестоподібної зв’язки у дітей та підлітків. J Педіатр Ортоп. 2011; 31: 811–817
- Pujol N, Boisrenoult P, Beau fi ls P. ‘Посттравматична скутість коліна: хірургічні методи’. Orthop Traumatol Surg Res. 2015; 101: 179–186
Співавтори
Д-р Йохен Салбер (доктор медичних наук)
Старший лікар-хірург
Завідувач кафедри
Експериментальна хірургія
Кафедра хірургії
Університетський медичний центр Knappschaftskrankenhaus Bochum -
Лікарня RUHR-університету в Бохумі
+49 234 32 21819
[email protected]
www.kk-bochum.de
www.researchgate.net/lab/Jochen-Salber-Lab
Зверніть увагу, ця стаття також з’явиться у третьому виданні нашого нова щоквартальна публікація.
- Чи є конкурси на їжу гарною ідеєю в країні з проблемою ваги Deseret News
- Уникання проблемних продуктів харчування з віком
- Барбі покладається на вагу - це проблема HCPLive
- Я страждаю ожирінням Ось як дізнатись, чи ваш ІМТ є проблемою Ожиріння The Guardian
- Досягнення проблеми здорового схуднення за допомогою примхливих дієт; Кенегеніка