20-гідроксиекдизон зменшує вагу та гіперглікемію на моделі мишей, що спричинені ожирінням
Пабло Кізельштейн
1 Біотехнологічний центр, Університет Рутгерса, Нью-Брансвік, Нью-Джерсі; та 2 Пеннінгтонський центр біомедичних досліджень, Батон-Руж, штат Луїзіана
Дмитро Говорко
1 Біотехнологічний центр, Університет Рутгерса, Нью-Брансвік, Нью-Джерсі; та 2 Пеннінгтонський центр біомедичних досліджень, Батон-Руж, штат Луїзіана
Славко Комарницький
1 Біотехнологічний центр, Університет Рутгерса, Нью-Брансвік, штат Нью-Джерсі; та 2 Пеннінгтонський центр біомедичних досліджень, Батон-Руж, штат Луїзіана
Аліса Еванс
1 Біотехнологічний центр, Університет Рутгерса, Нью-Брансвік, Нью-Джерсі; та 2 Пеннінгтонський центр біомедичних досліджень, Батон-Руж, штат Луїзіана
Чжун Ван
1 Біотехнологічний центр, Університет Рутгерса, Нью-Брансвік, штат Нью-Джерсі; та 2 Пеннінгтонський центр біомедичних досліджень, Батон-Руж, штат Луїзіана
Вільям Т. Чефалу
1 Біотехнологічний центр, Університет Рутгерса, Нью-Брансвік, Нью-Джерсі; та 2 Пеннінгтонський центр біомедичних досліджень, Батон-Руж, штат Луїзіана
Ілля Раскін
1 Біотехнологічний центр, Університет Рутгерса, Нью-Брансвік, Нью-Джерсі; та 2 Пеннінгтонський центр біомедичних досліджень, Батон-Руж, штат Луїзіана
Анотація
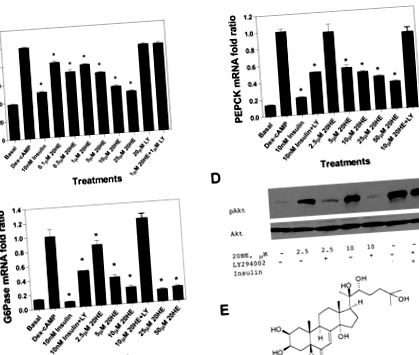
Стероїдний гормон 20-гідроксиекдизон (20HE) є важливою сигнальною молекулою, яка модулює реакцію на линьку у комах і може функціонувати як передбачуваний анаболічний фактор у хребетних тварин, хоча 20HE-рецепторів ссавців не виявлено. Тут ми показуємо, що в культурі клітин H4IIE лікування 20HE знижувало експресію фосфоенолпіруват-карбоксикінази (PEPCK) та глюкозо-6-фосфатази (G6Pase), зменшувало вироблення глюкози та індукувало фосфорилювання Akt2, чутливе до інгібітора фосфоїнозитид-3-кінази LY- 294002. Щоденне пероральне введення 20HE (10 мг/кг протягом 13 тижнів) покращувало ожиріння та резистентність до інсуліну у мишей C57BL/6J, які харчувалися дієтою з високим вмістом жиру, і призводило до значного зменшення приросту маси тіла та маси жиру в порівнянні з нелікованими тваринами, як було показано подвійний енергетичний рентгенівський аналіз абсорбціометрії. Крім того, рівень інсуліну в плазмі та толерантність до глюкози значно знижувались при лікуванні 20HE. Ці зміни супроводжувались зниженою печінковою експресією PEPCK та G6Pase та збільшеною продукцією адипонектину у вісцеральній жировій тканині. Ці дослідження демонструють проти ожиріння та протидіабетичні ефекти 20HE і починають з'ясовувати його передбачувані клітинні мішені як in vitro, так і in vivo.
екдистероїди - це полігідроксильовані стероїди, присутні в рослинах і безхребетних. На сьогодні структурно охарактеризовано близько 120 екдистероїдів (18). Хімічна структура екдистероїдів заснована на скелеті холестерину С-27; однак вони відрізняються від стероїдів хребетних своєю полярністю та громіздкістю. Один із найпоширеніших і найпоширеніших екдистероїдів, 20-гідроксиекдизон (20HE), є у багатьох рослинах, включаючи широко культивовані види, такі як Spinacia oleracea (шпинат) (29). У комах екдистероїди переважно беруть участь у регуляції линьки та метаморфози, тоді як у рослин вони можуть сприяти стримуванню безхребетних хижаків (9).
Мало відомостей про фізіологічну роль екдистероїдів у хребетних тварин. Окрім анаболічного ефекту (7, 8), повідомляється, що екдистероїди мають імуномодулюючі (7), гепатопротекторні (30), антиаритмічні (21) та знижуючі холестерин властивості (26). Є також кілька підтверджуючих доказів того, що 20HE впливає на метаболізм глюкози in vivo. Попередня обробка 20HE знижує гіперглікемію, пов'язану з введенням глюкагону або алоксану (25). Більше того, багатий екдистероїдами екстракт Ajuga turkestanica, який вводили перорально (5 мг/кг), був більш ефективним у зменшенні гіперглікемії на моделі діабету, викликаного алоксаном, у щурів, ніж контрольний препарат маніліл, не викликаючи гіпоглікемічного ефекту у нормальних тварин (22).
Важливим аспектом екдистероїдів є їх низька токсичність для ссавців. Середня летальна доза (LD50) 20HE у гризунів становить 6,4 г/кг маси тіла (для внутрішньочеревної ін'єкції) і становить> 9 г/кг маси тіла при пероральному застосуванні (25).
МАТЕРІАЛИ І МЕТОДИ
Хімікати.
Екдистерон був придбаний у Bosche Scientific (Нью-Брансвік, Нью-Джерсі). Дексаметазон, 8- (4-хлорфенілтіо) -cAMP (цАМФ), лактат натрію та піруват натрію були придбані у Sigma Chemicals (Сент-Луїс, Міссурі). Людський інсулін (гумулін) був придбаний у Eli Lilly (штат Індіанаполіс, Індіана), а з'єднання C - у EMD Biosciences (Сан-Дієго, Каліфорнія); фосфо-Akt2 та Akt2 кролячі mAb були придбані у Cell Signaling Technology (Danvers, MA). Всі інші хімічні речовини, включаючи середовища для клітинних культур, отримували з Invitrogen (Карлсбад, Каліфорнія). Реагенти та ферменти, що використовуються для RT-PCR, були отримані від Stratagene (La Jolla, CA) та Applied Biosystems (Foster City, CA). Клітинна лінія H4IIE (CRL-1548) була отримана з американської колекції типових культур (Манассас, Вірджинія).
Культура клітин та лікування.
Клітини гепатоми H4IIE культивували на 24-лункових планшетах для культури тканин (Greiner Bio One, Monroe, NC) і вирощували майже до місця злиття в модифікованому середовищем Орла Дульбекко, що містить 2,5% (об./Об.) Сироватки новонародженого теляти і 2,5% (об./Об.) ) плодова теляча сироватка. Клітини обробляли протягом 8 год 500 нМ дексаметазону та 0,1 мМ 8-CTP-cAMP (Dex-cAMP) для індукції експресії гена фосфоенолпіруваткарбоксикінази (PEPCK) та глюкози-6-фосфатази (G6Pase) разом з різними концентраціями 20HE або 10 нМ інсуліну. Для кожної обробки виділяли три лунки, включаючи негативний контроль (необроблені клітини). Для інгібуючих аналізів клітини попередньо обробляли протягом 30 хв або 20 мкМ LY-294002, або 40 мкМ сполуки С, як зазначено, промивали забуференним фосфатом сольовим розчином і інкубували протягом додаткових 7 годин з Dex-цАМФ разом з різними концентраціями 20HE, або 10 нМ інсуліну.
Аналіз виробництва глюкози.
Клітини гепатоми щурів H4IIE голодували протягом ночі в буфері вироблення глюкози (безглюкозне модифіковане есенціальне середовище Дульбекко, рН 7,4, що містить 20 мМ лактату натрію та 2 мМ пірувату натрію без фенолового червоного) і обробляли протягом 8 годин Dex-cAMP в наявність або відсутність 10 нМ інсуліну або різних концентрацій 20НЕ протягом 8 год. В кінці інкубації брали 0,5 мл середовища для вимірювання концентрації глюкози в культуральному середовищі за допомогою набору для аналізу глюкози Amplex Red (Invitrogen). Виправлення кількості клітин проводили на основі концентрації білка, виміряної за допомогою набору для аналізу білка BCA (Pierce Biotechnology, Rockford, IL).
Загальна екстракція, очищення та синтез кДНК РНК.
Загальну РНК екстрагували з клітин H4IIE або рідких консервованих азотом мишачих тканин за допомогою реагенту Trizol (Invitrogen), дотримуючись інструкцій виробника. Кількісно визначали РНК спектрофотометрично шляхом вимірювання поглинання при 260 і 280 нм із використанням системи NanoDrop (NanoDrop Technologies, Wilmington, DE). Якість РНК оцінювали шляхом поділу в гель-електрофорезі. Щоб видалити будь-які сліди забруднення ДНК, РНК потім обробляли ДНКазою I (Invitrogen) відповідно до вказівок виробника. КДНК синтезували, використовуючи 2,5 мкг РНК для кожного зразка, використовуючи зворотну транскриптазу Stratascript (Stratagene) відповідно до протоколу виробника.
Кількісний ПЛР-аналіз клітин гепатоми щурів H4IIE.
qPCR аналіз мишачих тканин.
Аналіз активності AMPKα1 та -α2.
Активність AMPK оцінювали, як описано раніше (12). Коротко, AMPK імунопреципітували з 200 мкг клітинного лізату H4IIE з використанням анти-AMPKα1 (Біотехнологія штату Нью-Йорк, Лейк-Плейсід, Нью-Йорк) або -α2 (Санта Круз Біотехнологія, Санта Круз, Каліфорнія) антитіл у 500 мкл буфера А (50 мМ Трис · HCl, pH 7,4, 150 мМ NaCl, 50 мМ NaF, 5 мМ пірофосфату натрію, 1 мМ ЕДТА, 1 мМ EGTA, 1 мМ DTT, 0,1 мМ бензамідину, 1 мМ фенілметилсульфонілфториду, 5 мкг/мл апроптину) при 4 ° C 2 год. Імунокомплекси промивали буфером А три рази, буфером В, що містив 0,5 М NaCl і 62,5 мМ NaF, один раз, а потім реакційним буфером (50 мМ HEPES, рН 7,4, 1 мМ DTT) тричі. Активність АМРК імунокомплексів визначали фосфорилюванням пептиду САМС в реакційному буфері, що містить 0,25 мМ САМС, 5 мМ MgCl2 та 10 мкКі [r- 32 P] АТФ протягом 10 хв при 30 ° C із стимуляцією AMP 200 мкМ або без неї. Реакцію припиняли плямистими реакційними сумішами на фільтрувальному папері P81 і промиванням в 1% (об./Об.) Фосфорної кислоти при обережному перемішуванні для видалення вільного АТФ. Фосфорильований субстрат вимірювали сцинтиляційним підрахунком.
Вестерн-блот-аналіз.
Клітини H4IIE культивували, як описано вище, і екстракти цілих клітин готували в крижаному буфері для лізису [62,5 мМ Tris · HCl (pH 6,8), 2% мас./Об. SDS, 10% гліцерину, 50 мМ DTT, 0,01% мас./об. бромофенолового синього] і центрифугували при 12000 g протягом 20 хв при 4 ° C. Рівні кількості білка (50 мкг) із супернатантів відокремлювали на 10% поліакриламідних гелях SDS і промокали на нітроцелюлозну мембрану. Вестерн-блот-аналіз проводили з моноклональними антитілами до фосфо-Akt (Ser 473) згідно з інструкціями виробника (Cell Signaling Technology, Danvers, MA). Після промивання помарки інкубували з міченим проти кролика пероксидазним вторинним антитілом та візуалізували за допомогою реагенту ECL Western Blotting Detection Reagent (GE Healthcare, Piscataway, NJ). Після позбавлення плям зондували антитілами Akt2 (5B5) для візуалізації загального вмісту Akt (контроль навантаження).
Експерименти на тваринах.
Усі експерименти на тваринах проводились відповідно до процедур, затверджених Інституційним комітетом з догляду та використання тварин Рутгерса. Шеститижневих самців мишей C57BL/6J отримували з лабораторії Джексона (Бар-Харбор, штат Мексика) і підтримували або дієту з низьким вмістом жиру (LFD; n = 10), що містить 10% калорій, отриманих з жиру (D12450B; Дієти досліджень), Нью-Брансвік, Нью-Джерсі) або HFD (n = 10), що містить 60% жирових калорій (D12492, Research Diets) з 12-годинними світлими та темними циклами.
Далі тварин з HFD рандомізували на дві групи. Контрольній групі (n = 10) проводили щоденну пробірку лише розчином носія (10% DMSO у кукурудзяній олії), а оброблюваній групі (n = 10) давали 10 мг/кг маси тіла 20HE протягом 13 тижнів. Для моніторингу збільшення та втрати маси тіла тварин щотижня зважували протягом експерименту. Внутрішньоректальну температуру мишей вимірювали щотижня за допомогою термометра, що містить зонд (Oakton Instruments, Vernon Hills, IL). Концентрацію глюкози у плазмі крові вимірювали на 4, 9, 10, 11 та 12 тижнях у зразках крові підщелепної вени за допомогою глюкометра (Lifescan, Johnson and Johnson, NJ). Плазмові концентрації інсуліну та адипонектину визначали на 13 тижні за допомогою набору ELISA для інсуліну щурів/мишей (Millipore, Billerica, MA) та набору ELISA для адипонектину (Otsuka Phamaceuticals, Toyko, Японія) відповідно.
Для проведення тесту на толерантність до глюкози на 13 тижні експерименту мишам як LFD, так і HFD голодували протягом ночі (16 год) і вводили внутрішньочеревно 1,5 г/кг розчину глюкози. Рівні глюкози в плазмі крові вимірювали безпосередньо перед і через 30, 60 та 120 хв після глюкози. В кінці дослідження мишей вбивали, а рівну кількість печінки та вісцерального жиру видаляли. Жирову масу і нежирну тканину визначали за допомогою аналізу рентгенівської абсорбціометрії з подвійною енергією (DEXA) на обладнанні PIXImus (Lunar, Madison, WI), як описано в інших роботах (27). Відсоток жирової тканини обчислювали наступним чином:% жиру в організмі = (маса жиру/загальна вага тіла) × 100, де загальна вага тіла була сумою нежирної маси та маси жиру для кожної тварини. Співвідношення між жировою масою та нежирною масою для кожної тварини обчислювали діленням маси жиру на нежирну масу.
РЕЗУЛЬТАТИ
20HE модулює метаболізм глюкози в клітинах гепатоми щурів.
Вироблення глюкози у відповідь на 20HE тестували в клітинах гепатоми щурів H4IIE, інкубованих у середовищі, що містить піруват і лактат як субстрати для глюконеогенезу.
Дані представляють середнє значення 2 різних експериментів ± SE. Концентрація інсуліну виражається як нг/мл, а концентрація адипонектину становить нг · мкл -1 г г жиру в тілі -1 та нг · мкл -1 м г тіла мас -1. LFD, дієта з низьким вмістом жиру; HFD, дієта з високим вмістом жиру; 20HE, 20-гідроксиекдизон.
Препарати бігуанідину рослинного походження, такі як метформін, здійснюють PI3K-незалежну регуляцію експресії базального гена PEPCK в гепатоцитах (39) за допомогою AMPK-залежного механізму. Цей шлях призводить до інсулінонезалежного придушення печінкового глюконеогенезу шляхом фосфорилювання та секвестрації цитоплазми цілі ссавців транскрипційного коактиватора комплексу-2 рапаміцину (17). 20HE був здатний збільшити базальну активність повсюдно експресованої каталітичної субодиниці AMPKα1, але не мав впливу на печінково-специфічну каталітичну субодиницю AMPKα2 (рис. 2). З'єднання C, інгібітор AMPK, конкуруючий з АТФ (26), не зменшило ефекти 20HE на стимульовану Dex-cAMP експресію гена PEPCK у клітинах H4IIE (дані не наведені). У сукупності ці дані свідчать про те, що незалежна від PI3K активація AMPKα1 20HE відіграє незначну роль у регуляції глюконеогенних ферментів та виробленні глюкози в печінці.
На закінчення, наші результати проливають нове світло на гіпоглікемічний ефект 20HE in vitro та in vivo і вказують на те, що цей ефект може бути здійснений завдяки PI3K-залежній регуляції активності глюконеогенних ферментів. Ще важливіше те, що дані свідчать про те, що щоденне введення 20HE може запобігти ожирінню, резистентності до інсуліну та пов'язаній з ними гіперглікемії у тварин, зменшуючи жирові депо, збільшуючи експресію адипонектину в жировій тканині та збільшуючи рівень адипонектину в циркуляції з урахуванням маси тіла або маси жиру.
ГРАНТИ
Дослідження було підтримано Міжнародним центром Фогарті Національного інституту охорони здоров’я (NIH) за грантом U01-TW-006674 для Міжнародних кооперативних груп з питань біорізноманіття; Центр досліджень дієтичних добавок NIH з питань рослинництва та метаболічного синдрому, грант №. 1-P50-AT-002776-01; та фітомедицини (Джеймсбург, Нью-Джерсі).
- Мишача модель ожиріння, спричиненого дієтою, та резистентності до інсуліну - PubMed
- Нокдаун CGI-58 у мишей викликає стеатоз печінки, але запобігає ожирінню, викликаному дієтою, та глюкозі
- AR-сигналізація, необхідна для наукових досліджень про термогенез та стійкість до ожиріння, спричинених дієтою
- Найкращі таблетки Я спробував дієтичні таблетки від ожиріння для схуднення - Глобальне дослідження Великобританії
- Екстракт журавлини, багатий поліфенолами, захищає від ожиріння, спричиненого дієтою, резистентності до інсуліну та