Знижена активність MTHFD1 у самців мишей порушує одновуглецевий метаболізм, залежний від фолатів та холіну, а також транссульфурація 1, 2
Марта С. Польова
3 Відділ харчових наук, Корнельський університет, Ітака, Нью-Йорк; і
Келсі С. Шилдс
3 Відділ харчових наук, Корнельський університет, Ітака, Нью-Йорк; і
Абарінова Олена Василівна
3 Відділ харчових наук, Корнельський університет, Ітака, Нью-Йорк; і
Малишева Ольга Василівна
3 Відділ харчових наук, Корнельський університет, Ітака, Нью-Йорк; і
Роберт Х. Аллен
4 Кафедра медицини та відділення гематології Університету Колорадо, Центр наук про здоров'я, Денвер, Колорадо
Саллі П. Стаблер
4 Кафедра медицини та відділення гематології Університету Колорадо, Центр наук про здоров'я, Денвер, Колорадо
Джессіка А. Еш
3 Відділ харчових наук, Корнельський університет, Ітака, Нью-Йорк; і
Барбара Дж. Штрупп
3 Відділ харчових наук, Корнельський університет, Ітака, Нью-Йорк; і
Патрік Дж. Стовер
3 Відділ харчових наук, Корнельський університет, Ітака, Нью-Йорк; і
Марі А. Коділь
3 Відділ харчових наук, Корнельський університет, Ітака, Нью-Йорк; і
Анотація
Вступ
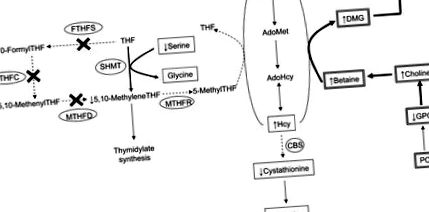
Ген Mthfd1 кодує трифункціональний фермент, що метаболізує фолат, C1-тетрагідрофолат (ТГФ) 5-синтазу, який відіграє важливу роль як у синтезі нуклеотидів, так і в циклі метіоніну. Фермент C1THF-синтази [зазвичай називається метилентетрагідрофолатдегідрогеназа 1 (MTHFD1)] містить синтетазну активність, яка каталізує АТФ-залежне перетворення формату і ТГФ в 10-формилТГФ, циклогідролазну активність, яка каталізує взаємоперетворення 10-формилТГ і 5, 10-метенилТГФ та активність дегідрогенази, яка знижує 5,10-метенилТГФ до 5,10-метиленТФ (1) ( Рис. 1 ).
Робоча модель метаболічних ефектів дефіциту Mthfd1 на холіно- та фолат-опосередкований метаболізм 1-С. Продуктом гена Mthfd1 є синтаза C1THF, яка містить ферментативні дії FTHFS, MTHFC та MTHFD. "X" позначає ферментативні дії, які зменшуються на 50% у моделі миші Mthfd1 gt/+. Метаболіти в коробці - це ті, які були виміряні в цьому дослідженні: подвійна коробка вказує на те, що метаболіт вимірювали в печінці, одинарна коробка вказує, що метаболіт вимірювали в плазмі. Більш товста стрілка, процес посилений зниженою активністю MTHFD1; пунктирна стрілка, процес ослаблений зниженою активністю MTHFD1. AdoHcy, S-аденозилгомоцитеїн; АдоМет, S-аденозилметионін; 1-С, 1-вуглець; CBS, цистатіонін β-синтаза; DMG, диметилгліцин; FTHFS, 10-формилтетрагідрофолатсинтетаза; GPC, гліцерофосфохолін; Hcy, гомоцистеїн; Met, метіонін; MTHFC, метенилтетрагідрофолатциклогідролаза; MTHFD, метилентетрагідрофолатдегідрогеназа; MTHFR, 5,10-метилентетрагідрофолат-редуктаза; ПК, фосфатидилхолін; SHMT, серингідоксиметилтрансфераза; ТГФ, тетрагідрофолат.
Продукт каталізованих C1THF-синтазою реакцій, 5,10-метиленTHF, існує в точці розгалуження на шляху метаболізму фолатів. 5,10-MethyleneTHF є донором 1-вуглецю (1-C) для синтезу тимідилату de novo, або ж може бути безповоротно відновлений до 5-methylTHF за допомогою ферменту 5,10-метилентетрагідрофолат-редуктази (1). 5-MethylTHF є ключовим донором метилу для реметилування гомоцистеїну до метіоніну, реакції, яка функціонально є надлишковою з бетаїном: каталізоване перетворення гомоцистеїну метилтрансферазою гомоцистеїну в метіонін (2–4). Як фолієво-опосередкований метаболізм 1-С, так і деградація холіну можуть незалежно забезпечувати одиниці 1-С для реметилювання гомоцистеїну, і тому ці 2 шляхи дуже взаємопов'язані. Отже, зміни або стану фолатів, або холіну можуть призвести до співмірних змін стану іншого поживного речовини, як показано в декількох моделях гризунів (5–8) та дослідженнях на людях (9–11).
Основною метою цього дослідження було кількісно визначити вплив генотипу Mthfd1 gt/+ на біомаркери метаболізму холіну. Оскільки в нашому попередньому дослідженні використовувалася дієта, дефіцитна як фолієва кислота, так і холін, поточне дослідження намагалося дослідити наслідки порушення Mthdf1 на метаболізм 1-С в умовах лише харчової недостатності фолатів.
Матеріали і методи
Експериментальні миші та дієти.
Усі протоколи досліджень були схвалені Інституційним комітетом з догляду та використання тварин Корнельського університету та відповідають Керівництву NIH з догляду та використання лабораторних тварин. Досліджуваних мишей генерували шляхом схрещування самок мишей C57Bl/6 з мишами-самцями 129P2/OlaHsd Mthfd gt/+. Миші C57Bl/6 Mthfd1 gt/+ були раніше описані (12). Під час відлучення нащадків чоловіків випадковим чином призначали або дієту AIN-93G (22) (контрольна дієта, дієти), що містила 2 мг/кг фолієвої кислоти, або модифіковану дієту AIN-93G без фолієвої кислоти [дефіцит фолієвої кислоти (FD) дієта, дієти]. Всім мишам годували відповідні дієти протягом 5 тижнів після відлучення. Експериментальних мишей генотипували, як описано в інших місцях (12).
Збір тканин.
Мишей вбивали вивихом шийки матки через 12 год позбавлення їжі. Кров збирали через серцеву пункцію в пробірки, покриті гепарином. Плазму відокремлювали центрифугуванням і заморожували в рідкому азоті. Зразки печінки промивали PBS і заморожували в рідкому азоті, потім зберігали при -80 ° C перед холіновим аналізом.
Аналіз метаболітів плазми.
Загальний гомоцистеїн плазми, цистатіонін, загальний цистеїн, метіонін, серин, гліцин, α-аміномасляна кислота, N, N-диметилгліцин та N-метилгліцин аналізували за допомогою стабільної ізотопної розрідженої капілярної газової хроматографії-МС, як описано раніше (23, 24).
Аналіз метаболітів холіну в печінці.
Рідка хроматографія-МС використовувалась для вимірювання вільного холіну, бетаїну та диметилгліцину (25), а також фосфатидилхоліну, лізофосфатидилхоліну, сфінгомієліну, фосфохоліну та гліцерофосфохоліну (26) із модифікаціями, заснованими на наших приладах (11).
Статистичний аналіз.
Статистичний аналіз проводили з використанням двосторонньої ANOVA з інтересними взаємодіями, включеними в початкову модель (JMP, SAS Institute). Ефекти вважалися значущими при P ≤ 0,05.
Результати
Генотип Mthfd1gt/+ асоціюється з вищим холіном печінки, бетаїном та диметилгліцином.
Як показано в Таблиця 1, генотип Mthfd1 gt/+ був пов'язаний з більш високими концентраціями холіну, бетаїну та диметилгліцину в тканині печінки. Печінка мишей Mthfd1 gt/+ мала на 95% вищий рівень холіну (P = 0,005), а також на 50% вищий рівень диметилгліцину (P = 0,004) та бетаїну (P = 0,013) щодо мишей Mthfd1 +/+. Миші Mthfd1 gt/+ також мали на 43% нижчі концентрації гліцерофосфохоліну в печінці (P = 0,002), ніж миші Mthfd1 +/+ (табл. 1). Примітно, що дієта FD не порушувала метаболіти холіну печінки ні у мишей Mthfd1 +/+, ні у Mthfd1 gt/+, а також не виявляла ніяких взаємодій ген-дієта (P> 0,10) (Таблиця 1).
ТАБЛИЦЯ 1
Метаболіти печінкового холіну у мишей +/+ gt/+ після 5 тижнів споживання контрольної або FD дієти 1
| +/+ | gt /+ | P значення ефекту | ||||||
| Метаболіт | Контроль | FD | Всі | Контроль | FD | Всі | Дієта | Генотип |
| n | 10 | 10 | 20 | 10 | 10 | 20 | ||
| Холін, нмоль/р | 346 ± 273 | 248 ± 189 | 299 ± 236 | 621 ± 195 | 552 ± 289 | 585 ± 245 | росіяни | 0,005 |
| Бетаїн, нмоль/г | 418 ± 202 | 331 ± 180 | 376 ± 192 | 618 ± 138 | 563 ± 262 | 589 ± 209 | росіяни | 0,013 |
| Диметилгліцин, нмоль/г | 38 ± 13 | 38 ± 12 | 38 ± 13 | 54 ± 14 | 54 ± 15 | 54 ± 12 | росіяни | 0,004 |
| Гліцерофосфохолін, нмоль/г | 173 ± 77 | 225 ± 137 | 198 ± 110 | 99 ± 22 | 125 ± 27 | 113 ± 28 | росіяни | 0,002 |
| Фосфохолін, нмоль/г | 409 ± 215 | 425 ± 287 | 417 ± 245 | 409 ± 176 | 268 ± 87 | 335 ± 151 | росіяни | росіяни |
| Фосфатидилхолін, мкмоль/г | 17,2 ± 2,75 | 17,1 ± 2,22 | 17,1 ± 2,44 | 17,2 ± 1,87 | 17,5 ± 0,97 | 17,4 ± 1,43 | росіяни | росіяни |
| Сфінгомієлін, нмоль/г | 567 ± 178 | 626 ± 151 | 595 ± 164 | 738 ± 125 | 657 ± 175 | 695 ± 155 | росіяни | 0,05 |
| Лізофосфатидилхолін, нмоль/г | 506 ± 152 | 498 ± 142 | 502 ± 144 | 523 ± 118 | 570 ± 112 | 548 ± 114 | росіяни | росіяни |
Біомаркери плазми метаболізму 1-С та транссульфування змінені у мишей Mthfd1gt/+.
ТАБЛИЦЯ 2
Метаболічний профіль плазми від +/+ gt/+ мишей після 5 тижнів споживання контрольної або FD дієти 1
| +/+ | gt /+ | P значення ефекту | ||||||
| Метаболіт | Контроль | FD | Всі | Контроль | FD | Всі | Дієта | Генотип |
| n | 10 | 10 | 20 | 10 | 10 | 20 | ||
| Гомоцистеїн, мкмоль/л | 4,9 ± 0,6 | 8,0 ± 1,3 | 6,5 ± 1,9 | 6,1 ± 1,3 | 11,4 ± 3,6 | 8,8 ± 3,8 | 1 Дані є середніми ± SD. Дані аналізували за допомогою двостороннього ANOVA. ≤ 0,05 вважали значущим; ns, не значуще, P> 0,10. Не було виявлено жодних значущих взаємодій генотип × дієта, P> 0,10, за винятком того, що гомоцистеїн у плазмі, як правило, був вищим у мишей Mthfd1 gt/+, які годувались FD дієтою, порівняно з Mthfd1 +/+, які годувались дієтою, або Mthfd1 gt/+, які отримували контроль дієта. Р-взаємодія = 0,08. FD, дефіцит фолієвої кислоти. | |
Обговорення
Було показано, що миша Mthfd1 gt/+ виявляє функціональні порушення в метаболізмі 1-С, оскільки концентрації S-аденозилметионіну (AdoMet) у печінці знижуються, мабуть, через зменшення синтезу AdoMet через цикл метіоніну (12). Тут ми спостерігали змінений метаболізм метіоніну у миші Mthfd1 gt/+ у вигляді підвищеного циркулюючого гомоцистеїну та зниженого циркулюючого метіоніну щодо миші Mthfd1 +/+. Ці результати в сукупності вказують на те, що порушення активності синтази C1THF зменшують вироблення 5,10-метиленTHF і, зрештою, 5-метилTHF, фолатного коферменту, який бере участь у реметилюванні гомоцистеїну до метіоніну (рис. 1) (2, 19, 27).
Реакція серинової гідроксиметилтрансферази забезпечує альтернативний шлях синтезу 5,10-метиленТГФ за допомогою C1-ТГФ синтази. Серинова гідроксиметилтрансфераза переносить С3 серину в ТГФ, утворюючи 5,10-метиленТГФ і гліцин (28, 29). У цьому дослідженні миші Mthfd1 gt/+ мали менші концентрації циркулюючого серину порівняно з мишами Mthfd1 +/+, що свідчить про збільшення використання серину як джерела 1-С для циклу метіоніну та/або біосинтезу ядерного тимідилату (12) (рис. . 1).
Порушення в циклі метіоніну, обумовлені генотипом Mthfd1 gt/+, мабуть, мають важливе значення для біохімії транссульфурації (рис. 1). Миші Mthfd1 gt/+ мали знижену концентрацію цистатіоніну в плазмі крові, який виробляється з гомоцистеїну за допомогою цистатіонін-β-синтази (ЦБС), регуляторного ферменту в процесі транссульфурації (30, 31). Оскільки AdoMet необхідний для активації CBS (31, 32), зменшений AdoMet, як це спостерігається у печінці мишей Mthfd1 gt/+ (12), може призвести до одночасного зменшення питомої активності CBS, тим самим послаблюючи конверсію гомоцистеїну до цистатіоніну та збереження гомоцистеїну для виробництва AdoMet. Оскільки попередник цистеїну, який є кінцевим продуктом шляху транссульфурації, зменшена доступність цистатіоніну може передбачати зниження рівня цистеїну (33). Тим не менше циркулюючий цистеїн був вищим у мишей Mthfd1 gt/+, ніж у мишей Mthfd1 +/+. Ми припускаємо, що подібно до того, що спостерігається з іншими поживними речовинами (34), позапечінкові органи діють на забезпечення печінки Mthfd1 gt/+ цистеїном, який може в подальшому метаболізуватися до глутатіону, головного відновлюючого агента в організмі, який використовується для боротьба з окислювальним стресом (35, 36).
У цьому дослідженні знижена активність MTHFD1 мала більший вплив на метаболізм 1-C порівняно з дієтою FD, і не було взаємодії між генотипом Mthfd1 та зниженим вмістом фолієвої кислоти. Наші висновки про те, що дієта FD не посилила додатковий негативний вплив генотипу Mthfd1 gt/+ на холінові та 1-С метаболічні маркери, вказують на те, що 3 ферментативні активності, пов’язані з MTHFD1, не сильно залежать від концентрації внутрішньоклітинної фолієвої кислоти, як це спостерігалося для інші фолатно-залежні ферменти (37).
Комплексні зміни метаболізму холіну, фолатів та метіоніну, що спостерігаються у мишей Mthfd1 gt/+, особливо схожі на зміни, пов’язані з поліморфізмом MTHFD1 G1958A, і надають подальшу підтримку використанню мишей Mthfd1 gt/+ як моделі збурених фолатів і холінозалежний метаболізм 1-С та спадкові недоліки людини MTHFD1. Загалом, результати цього дослідження дають важливе уявлення про метаболічні зміни, які, як очікується, можуть виникнути внаслідок недостатності MTHFD1 у людини, такі як у G1958A та інших нещодавно виявлених SNP MTHFD1 (21). Результати дослідження можуть також інформувати про підходи до дієтичного лікування, такі як необхідність більш високого споживання холіну серед осіб із шкідливими SNP MTHFD1.
Подяка
M.S.F., E.V.A., J.A.A., B.J.S., P.J.S. та M.A.C. розробив дослідження; E.V.A. координував дослідження та збирав тканини; O.V.M., R.H.A. та S.P.S. проведений аналітичний аналіз; M.S.F. та J.A.A. аналізували дані та проводили статистичний аналіз; M.S.F., K.S.S., M.A.C. та P.J.S. підготував рукопис; та M.A.C. несе основну відповідальність за остаточний зміст. Усі автори прочитали та схвалили остаточний рукопис.
Виноски
5 Використані скорочення: AdoMet, S-аденозилметионін; 1-С, 1-вуглець; CBS, цистатіонін β-синтаза; FD, дефіцит фолієвої кислоти; MTHFD, метилентетрагідрофолатдегідрогеназа; SNP, однонуклеотидний поліморфізм; ТГФ, тетрагідрофолат.
- Одновуглецевий метаболізм та іонізуюче випромінювання багатогранна взаємодія
- Ресвератрол потенціює рапаміцин для запобігання гіперінсулінемії та ожиріння у мишей-самців із високим вмістом жиру
- Статус селену щодо зниженої активності глутатіонпероксидази при аспіриночутливій астмі
- Ресвератрол потенціює рапаміцин для запобігання гіперінсулінемії та ожиріння у мишей-самців із високим вмістом жиру
- PRIME PubMed Аналіз макрокомпонентів та жирних кислот у ринковому кошику підлітків чоловічої статі