Зміни метилювання ДНК, пов’язані з поживною депривацією: загальногеномний аналіз популяції та дані in vitro
Анотація
Передумови
Нещодавно метилювання ДНК було визначено як посередник між внутрішньоутробним впливом голоду та низкою метаболічних та психічних ознак. Однак загальногеномний аналіз є дефіцитним, а поперечний аналіз ускладнюється багатьма потенційними незрозумілими факторами. Більше того, причинно-наслідкові зв’язки важко визначити через відсутність контрольованих експериментальних конструкцій. Тому в поточному дослідженні ми поєднали всебічну оцінку відмінностей метилювання ДНК у геному у людей, які зазнали внутрішнього внутрішньоутробного голоду в Китаї, з дослідженням in vitro, в якому ми позбавили фібробластів харчування.
Методи
Ми порівняли відмінності метилювання ДНК цільної крові між 25 особинами внутрішньоутробно, які зазнали голоду, та 54 здоровими особами контролю, використовуючи платформу HumanMethylation450. In vitro ми проаналізували зміни метилювання ДНК у 10 культурах фібробластів, які були позбавлені поживних речовин протягом 72 годин шляхом утримання фетальної бичачої сироватки.
Результати
Ми виявили три диференціально метильовані області (DMR) у чотирьох генах (ENO2, ZNF226, CCDC51, і TMA7), які були пов’язані з опроміненням голодом в обох аналізах. Аналіз шляхів з даними як зразків голоду в Китаї, так і фібробластів виділив нервову систему та шляхи нейрогенезу як найбільш постраждалі від поживної депривації.
Висновки
Поєднання поперечних та експериментальних даних свідчить про те, що біологічна адаптація до голоду призводить до змін метилювання ДНК у генах, що беруть участь у центральній нервовій системі.
Передумови
Метилювання ДНК - один із епігенетичних механізмів, який відіграє важливу роль у клітинних реакціях на згубний вплив навколишнього середовища, що бере участь у етіології багатьох захворювань [1]. Дослідження показують, що ранній вплив харчової депривації на ранній термін життя пов'язаний зі стабільними відмінностями метилювання ДНК [2, 3]. Позбавлення харчування, особливо внутрішньоутробно та на ранніх стадіях життя, згубно впливає на розвиток людини та суттєво збільшує ризик множинних хронічних захворювань у подальшому житті [3,4,5,6].
Основним прикладом впливу внутрішньоутробного впливу харчової недостатності є когортне дослідження на потомство від матерів, які були вагітними під час голландської голодної зими під час Другої світової війни, яке було інтенсивним та добре задокументованим, але короткотривалим [7]. У цьому дослідженні було виявлено стійке диференційоване метилювання інсуліноподібного фактора росту II (IGF2) як ключового фактора росту та розвитку людини, який бере участь у відповіді на голод внутрішньоутробно [3]. Подальші дослідження цієї когорти виявили зміни метилювання ДНК як медіаторів зв'язку між голодом матері та метаболічними захворюваннями у зрілому віці [6, 8]. Інші епігенетичні відмінності, пов’язані з опроміненням голодом у внутрішньоутробному періоді, пов’язані з шизофренією [9] та діабетом 2 типу [10].
Хоча голландський голод є найбільш широко вивченим голодом у літературі, великий голод у Китаї (1959–1961) був одним із найбільших голодоморів, зафіксованих у всьому світі, і мав більш серйозні наслідки, в результаті яких загинуло 30 мільйонів людей [11]. Нащадки тих матерів, які страждали від голоду, були меншими за тривалістю [5], гіршим станом здоров’я середнього віку [12] та вищим рівнем хронічних захворювань [13, 14]. Дослідження також показали в два рази підвищений ризик розвитку шизофренії серед нащадків, зачатих у розпал голоду [15, 16]. Однак лише одне дослідження метилювання ДНК у всьому геномі повідомляє серед популяції голоду в Китаї [17]. Для подальшого розуміння впливу материнського голоду на зміни метилювання ДНК у нащадків ми порівняли метилювання ДНК у цілому з генома цільної крові китайських учасників, які зазнали голоду в першому триместрі, з неекспонованими контролями з тих самих груп населення.
Оскільки перехресне популяційне дослідження піддається залишковому збентеженню і не дозволяє дослідити прямий ефект харчової депривації, ми згодом провели дослідження in vitro фібробластів людини до та після впливу харчової депривації. Поєднуючи результати загальногеномного підходу метилювання обох досліджень, ми прагнемо забезпечити неупереджене дослідження змін метилювання ДНК, спричинених харчовою депривацією.
Методи
Зразок китайського голоду
Зразок китайського голоду є частиною нашого попереднього дослідження і був детально описаний в інших місцях [9]. Коротше кажучи, добровольців завербували у північній провінції Цзілінь, Китай. Враховуючи майже повне проникнення голоду протягом січня 1960 р. Та вересня 1961 р., Передбачається, що ті, хто народився в цей період, будуть піддані. Всього було включено 79 здорових учасників, з яких 25 були піддані голоду протягом перших 3 місяців у внутрішньоутробному періоді. Усі учасники надали письмову інформовану згоду. У таблиці 1 подано повну інформацію про учасників.
Дослідження фібробластів in vitro
Експеримент in vitro з фібробластами був більш детально описаний раніше [9]. Коротше кажучи, фібробласти були отримані шляхом біоптатів шкіри від п’яти здорових учасників голландського походження, серед яких один чоловік був чоловіком, а чотири жінки (середній вік = 38,4 року, sd = 7,0) (див. Таблицю 1). Усі учасники надали письмову інформовану згоду. Фібробласти висівали в дві колби Т25 в мінімальне ефірне середовище (MEM) (Gibco®) з 15% плодової бичачої сироватки (FBS) (Gibco®) і 1% пеніцилін-стрептоміцину PenStrep (Gibco®) і в атмосфері 95% атмосферної повітря і 5% СО2 при 37 ° C (нормальні умови). Після досягнення 70–80% злиття супернатант видаляли і клітини тричі промивали сольовим розчином, забуференним фосфатом (PBS) (BioWhittaker® Reagents, Lonza). Далі одну з колб Т25 від кожного донора культивували в умовах неголодомору з використанням мінімального ефірного середовища (MEM) (Gibco®) з підтримкою 15% FBS, тоді як інші колби T25 культивували лише в мінімальному основному середовищі (MEM) як стан голоду. Через 72 год клітини збирали з кожної колби і зберігали у вигляді гранул клітин для виділення ДНК.
Обробка ДНК
ДНК із зразків китайського голоду витягували із цільної крові за допомогою набору Gentra Puregene Kit (Qiagen, Валенсія, Каліфорнія, США). Гранули клітин фібробластів використовували для виділення ДНК згідно з інструкціями виробника (Qiagen, Hilden, Німеччина). Концентрацію та якість ДНК досліджували за допомогою NanoDrop (Thermo Fisher Scientific, штат Массачусетс, США). Біссульфітна конверсія кожного зразка ДНК проводилась відповідно до інструкцій виробника набору Zymo EZ DNA MethylationTM (Zymo, Irvine, CA, USA). Якість та кількість одноланцюжкової ДНК, обробленої бісульфітом, досліджували за допомогою NanoDrop.
Загальногеномний аналіз метилювання ДНК
Контроль якості фібробластів проводився за подібним робочим процесом, як і зразки голодомору в Китаї, але з урахуванням нової метилювальної бічіпчі EPIC. Набір даних був попередньо оброблений у версії R 3.3.1 з пакетом meffil [22] з використанням функціональної нормалізації [23], щоб зменшити небіологічні відмінності між зондами. Щоб врахувати технічні змінні партії, попередню обробку проводили у більшому наборі даних (n = 80), включаючи зразки ДНК інших досліджень, що включали ДНК мозку та крові. Однак нормалізацію проводили лише для зразків фібробластів. Жодної невідповідності між передбачуваним метилюванням статтю та фактичною статтю не було, а також не було зразків із відхиленнями середніх метильованих та неметильованих каналів. Зонди виймали, якщо вони не пройшли контроль якості (виявлення стор значення> 0,01 для> 10% зразків (n = 4610) або кількість бісеру 10% зразків (n = 68)), були неспецифічними [20] або були одним із зондів SNP, включених до масиву для цілей контролю якості. Усі 10 зразків ДНК фібробластів пережили контроль якості, а 862 160 зондів залишили у наборі даних для подальшого аналізу.
Як для зразків Китаю, так і для зразків фібробластів рівень (відсоток) метилювання виражається як a β значення, що коливається від 0 (неметильований цитозин) до 1 (повністю метильований цитозин), але аналізи проводили з використанням М значення (log2 з β значення), для кращої статистичної достовірності [24]. Для вивчення накладання результатів двох наборів даних було проведено аналіз DMR та шляхів для 397 985 CpG, які були присутні на EPIC, а також масивів 450 k.
Аналіз шляху
Ми провели аналіз збагачення наборів генів (GSEA) для номінальних значущих CpG, які накладалися на зразки голоду та фібробластів у Китаї. Інструмент SetRank був обраний у поточному дослідженні для аналізу GSEA, оскільки він міг усунути багато хибнопозитивних влучень [25], особливо тих, що мають тенденцію до нейрональних шляхів, оскільки ці гени набагато більш поширені та мають більші розміри. Онтологія генів (GO), Кіотська енциклопедія генів і геномів (KEGG), WikiPathways та база даних шляху Reactome включені в інструмент SetRank.
Аналіз перестановок
Рівень значущості виявлених DMR був підтверджений шляхом перестановочного аналізу стор значення розраховували з усіх потенційних DMR з однаковою кількістю CpG по всьому геному. З відповідності фактично визначеного DMR у цьому розподілі, емпірично стор було отримано значення. Була встановлена ймовірність знайти кількість дублюючих DMR, які ми представили, з усіх потенційних збігів. Всі ці аналізи базувались на 10000 перестановок.
Статистичний аналіз
Статистичний аналіз проводили з використанням R [26]. Аналіз асоціації метилювання ДНК з голодом у зразках голодомору в Китаї проводили з використанням лінійної регресії з метилюванням ДНК як залежною та оцінками голоду, віку, статі та типу клітин на основі алгоритму Хаусмана [21], а також першого два основні компоненти, що базуються на метилюванні ДНК, як основні компоненти [19]. Крім того, як і раніше, ми скоригували вплив куріння, вивівши проксі для куріння на основі рівня метилювання CpG, які раніше були пов’язані з курінням [27]. Для експерименту з фібробластами зміни метилювання в умовах голоду оцінювали за допомогою парного рангового тесту Уілкоксона. Ділянки QQ були перевірені для оцінки накачування помилок типу I та потужності (додатковий файл 1). DMRcate (версія 1.4.2) був використаний для ідентифікації диференційовано метильованих областей (DMR). Номінальне значення для аналізу DMR було встановлено 0,01 [28]. Тільки DMR з однаковим напрямком впливу (гіпер- або гіпометилювання) в обох зразках вважалися збігом.
Результати
Ідентифікація диференціально метильованих областей
Аналіз одиночного метилювання CpG не виявив суттєвих відмінностей після коригування для багаторазового тестування через недостатню потужність. Графік QQ вказував, що аналіз був недостатньо потужним для виявлення диференціально метильованих зондів по всьому геному (додатковий файл 1 показує графіки QQ). Додатковий файл 2 містить інформацію та статистичні дані тестів номінально пов'язаних локусів (18 871 для китайського голоду та 56 375 для експерименту з фібробластами). Дві тисячі сімсот шість CpG накладалися між номінально пов'язаними локусами обох експериментів. Ймовірність виявитись значною в обох аналізах була вищою для CpG з дослідження голодомору (хі-квадрат = 843,97, df = 1, стор значення Таблиця 2 Три DMR, послідовно пов'язані з голодом в обох експериментах (зразки голоду в Китаї та зразки фібробластів)
Аналіз шляху виявлених локусів CpG
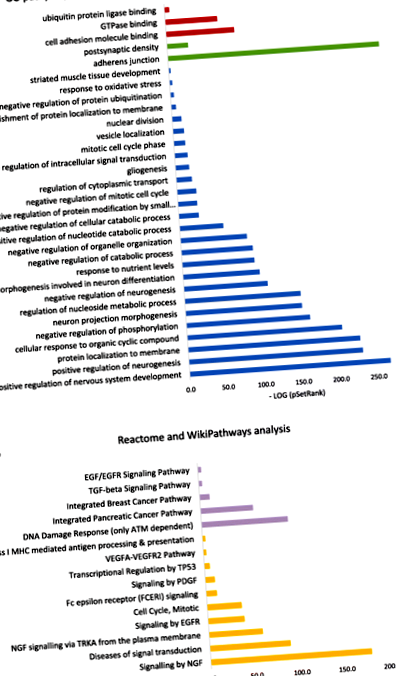
На рисунку 1 показані значущі шляхи, пов’язані з усіма 2706 перекриваються CpG з китайських зразків голоду та експериментів з фібробластами. Аналіз шляхів базується на базах даних GO, KEGG, WikiPathways та Reactome. Аналіз шляхів GO виділив три значущі шляхи молекулярної функції, серед яких здебільшого переважає зв'язування молекул клітинної адгезії. Адреназинг є найбільш актуальним щодо клітинних компонентів. Крім того, ми виявили, що стан голоду впливав на широкий спектр біологічних процесів, серед яких нейронні системи мають найбільший вплив. Наприклад, шляхи у розвитку нервової системи, як позитивний, так і негативний нейрогенез, та морфогенез проекції нейронів мають велику участь. Аналіз шляхів значного аналізу Reactome та WikiPathways показав, що реакція на пошкодження ДНК та сигналізація за допомогою фактора росту нервів (NGF) в основному задіяні внаслідок депривації харчування.
Аналіз значущих шляхів на основі CpG (2706), пов'язаних з голодом, як у китайському голодуванні, так і в дослідженні фібробластів. a Важливі шляхи аналізу GO. Шляхи червоним кольором - молекулярні функції, зеленим кольорові клітинні компоненти, синім - біологічні процеси. X-вісь відображає журнал мінусів стор значення асоціації зі значенням SetRank набору генів. b Значний аналіз шляхів від Reactome та WikiPathways. Шлях Reactome виглядає фіолетовим, а WikiPathways - помаранчевим. X-вісь відображає журнал мінусів стор значення асоціації зі значенням SetRank набору генів
Обговорення
Це перше дослідження, яке поєднує в собі геномний аналіз метилювання ДНК впливу голодомору та дослідження in vitro дефіциту поживних речовин, щоб дослідити вплив голоду на метилювання ДНК. Результати виділяють кілька генних промоторів, які диференційовано метилюються внаслідок поживної депривації. Подальший аналіз шляхів показав, що розвиток нервової системи та передача сигналів за допомогою фактора росту нервів (NGF) чутливі до поживної депривації.
У попередньому дослідженні метилювання в цілому за геном голландської зими голоду було виявлено 181 ген за допомогою зниженого представництва бісульфітного секвенування (RRBS), а ще 6 генів було перевірено в аналізі EpiTYPER на основі мас-спектрометрії [8]. Пізніше, в когорті голоду в Бангладеш, було виявлено сім епіаллелей [4]. Хоча DMR з цих попередніх досліджень не збігаються з нашими DMR, DMRs наближаються до генів того самого шляху. Наприклад, ZNF251 і CCDC57 були виявлені в голландській когорті голоду, тоді як у нашому дослідженні, ZNF226 і CCDC51 виявляються диференційовано метильованими. Різне генетичне тло трьох голодних когортних досліджень може бути одним із пояснень цих відмінностей, оскільки вразливість до факторів навколишнього середовища може бути властивою генетично [50]. Іншим поясненням різних результатів може бути те, що, хоча всі три популяції страждали від голоду, схема споживання їжі, що залишилася, імовірно, була різною в різних країнах. Різниця в дієтичному споживанні поживних речовин в кінцевому підсумку може призвести до різних моделей недоїдання та до різних результатів.
Шляхи, які найчастіше пов’язані з порушенням харчування, пов’язані з нервовою системою та нейрогенезом, зокрема, позитивна регуляція розвитку нервової системи при аналізі шляхів GO (синій на рис. 1) та сигналізація фактору росту нервів (NGF) в аналізі WikiPathways (помаранчевий) на рис. 1). Це вказує на високу відповідність епігенетичних адаптацій до голоду для мозку [51] (навіть незважаючи на те, що сучасне дослідження не аналізувало мозок). Вплив голоду на мозок було показано в дослідженнях на гризунах, які показали великі епігенетичні зміни в гіпокампі у потомства щурів, позбавлених харчування.
Виконання аналізу метилювання ДНК на фібробластах на додаток до цільної крові збільшує різноманітність типів тканин і суттєво знижує ризик того, що результати заважають залишкові фактори. Фібробласти забезпечують інший тип тканини, і використання лонгітюдного аналізу у тих самих учасників дає можливість безпосередньо пов’язати зміни метилювання ДНК з голодом. Реплікація DMR з фібробластів і крові, отже, дає вагомі докази того, що це відповідні гени, які беруть участь у відповіді на недоїдання.
Висновки
Використовуючи неупереджений загальногеномний підхід, в поточному дослідженні розглянуто зв'язок між метилюванням ДНК та важкою поживною депривацією у двох унікальних зразках окремо (китайський голод та фібробласти in vitro) та призводить до ідентифікації DMR, які послідовно гіпометилювались в обох зразках. Три DMR у чотирьох промоторах генів ENO2, ZNF226, CCDC51, і TMA7 а участь нервової системи та передача сигналів фактором росту нервів (NGF), запропоновані аналізом шляхів, можуть забезпечити нові підказки для розуміння шляхів від позбавлення харчування до хвороби.
- Порівняльний аналіз харчових балів для серійного моніторингу стану харчування у
- Вплив національної культури на ІМТ багаторівневий аналіз 53 країн BMC Public Health Повний текст
- DL Foods Health; Оздоровчі статті Терапевтичні зміни способу життя (TLC) Дієта Q; A
- Ефективні поживні рекомендації щодо ожиріння за допомогою дієти з низьким вмістом вуглеводів (РК)
- Відділ харчових наук