Закономірності структурних змін головного мозку при ХОЗЛ з різними рівнями порушень легеневої функції та їх зв’язок з когнітивними дефіцитами
Анотація
Передумови
Дослідити закономірності структурних змін головного мозку у хворих на хронічну обструктивну хворобу легень (ХОЗЛ) з різним рівнем порушень функції легенів та асоціації цих закономірностей із когнітивними функціональними дефіцитами за допомогою морфометрії на основі вокселів (VBM) та просторової статистики на основі тракту (TBSS) аналізи на основі структурної МРТ з високою роздільною здатністю та дифузійного тензорного зображення (DTI).
Методи
Загалом 115 праворуких учасників (26 важких, 29 середньотяжких та 29 хворих на ХОЗЛ та група порівняння з 31 особою без ХОЗЛ) пройшли тести на когнітивну (Монреальську когнітивну оцінку [MoCA]) та легеневу функцію (обсяг форсованого видиху в 1 с [ОФВ1]) та пройшов МРТ-сканування. Аналізи VBM та TBSS використовувались для виявлення змін щільності сірої речовини (GMD) та цілісності білої речовини (WM) у пацієнтів із ХОЗЛ. Крім того, проводили кореляційний аналіз між цими змінами параметрів візуалізації та когнітивними та легеневими функціональними порушеннями.
Результати
Не було значної різниці в структурі мозку між групами порівняння та хворими на ХОЗЛ легкого ступеня. У пацієнтів з помірним ХОЗЛ спостерігалася атрофія лівої середньої лобової звивини та правої окулярної частини/трикутної частини нижньої лобової звивини, а зміни ЗМ були присутніми головним чином у верхній та задній променевій короні, мозолистому тілі та цингулумі. У пацієнтів з важкою формою ХОЗЛ спостерігались найширші зміни ГМД та ЗМ. Деякі зміни сірої речовини (ГМ) та ЗМ корелювали з показниками MoCA та ОФВ1.
Висновки
Ці результати дозволяють припустити, що у пацієнтів з ХОЗЛ спостерігаються прогресуючі структурні порушення як у ГМ, так і у ЗМ, а також порушені рівні функції легенів, що підкреслює важливість ранніх клінічних втручань.
Передумови
Хронічна обструктивна хвороба легень (ХОЗЛ) - це хронічний прогресуючий синдром обмеження повітряного потоку, який часто супроводжується різноманітними позалегеневими ускладненнями. Порушення функції центральної нервової системи є одним із таких позалегеневих ускладнень [1]. Даг та ін. [2] та Лопес-Торрес та ін. [3] показали, що когнітивна функція знижується у хворих на ХОЗЛ; Інь та ін. [4] виявив, що когнітивні порушення у хворих на ХОЗЛ суттєво не відрізняються за статтю, регіоном, освітою, станом куріння або вживанням алкоголю. Механізм когнітивних порушень, пов’язаних із ХОЗЛ, може бути пов’язаний з неврологічними пошкодженнями, спричиненими гіпоксією [5], обструкцією дихальних шляхів (вимірюється об’ємом форсованого видиху за 1 с [ОФВ1]) [6] та медіаторами запалення [7, 8]. Однак дослідження на цю тему просто пропонували асоціацію, а не причинний зв’язок [9]; механізми патології мозку та когнітивних порушень, швидше за все, будуть складними та багатофакторними [10] і недостатньо зрозумілі.
На сьогодні дослідження нейровізуалізації виявили зміни у структурі мозку, метаболізмі та функції у пацієнтів із ХОЗЛ. Ортапамук та ін. [11] встановили, що перфузія кровотоку в лобовій та тім’яній частках хворих на ХОЗЛ була значно знижена на SPECT. Попередні дослідження показали, що завдання та стан спокою префронтальних мереж хворих на ХОЗЛ можуть бути визначені за допомогою досліджень функціонального магнітно-резонансного дослідження (fMRI), і виявлено аномальну активацію багатьох областей мозку [12, 13]. Чжан та ін. встановили, що сіра речовина (ГМ) хворих на ХОЗЛ варіюється в багатьох регіонах мозку, таких як лімбічна та паралімбічна системи [14]. Крім того, у пацієнтів зі стабільною ХОЗЛ виявлено дифузне пошкодження білої речовини (ЗМ) [15].
Попередні нейроанатомічні дослідження хворих на ХОЗЛ базувались головним чином на класифікації насичення киснем [16]. Ступінь тяжкості захворювання стратифікували насиченням киснем, розмір вибірки був відносно невеликим, а діапазон пошкоджень у ЗМ відображався лише величиною дробової анізотропії (ФА), яка недостатньо вичерпна [15], вводячи таким чином упередженість у результати. Керівні принципи Глобальної ініціативи з хронічної обструктивної хвороби легенів (GOLD) рекомендують класифікувати ступінь тяжкості ХОЗЛ на основі легеневої функції (вимірюваної за допомогою ОФВ1) [17], а не насичення киснем. У цьому дослідженні ми використовували більший обсяг вибірки, ніж попередні дослідження, і розділили пацієнтів на кілька підгруп на основі функції легенів. Метою цього дослідження було вивчити закономірності структурних змін мозку у хворих на ХОЗЛ з різним рівнем порушень функції легенів та асоціації цих закономірностей з дефіцитом когнітивних функцій. Ми висунули гіпотезу, що пацієнти з ХОЗЛ матимуть різний ступінь структурних порушень як у ГМ, так і у ВМ відповідно до рівня легеневої функції, і що ці структурні порушення будуть корелювати з когнітивними функціональними дефіцитами.
Методи
Предмети
У дослідженні взяли участь 115 праворуких осіб (26 важких, 29 середніх та 29 хворих на ХОЗЛ та група порівняння з 31 особи без ХОЗЛ). Група порівняння складалася повністю з добровольців із громади, а пацієнти з ХОЗЛ були набрані з легеневої клініки та стаціонарного відділення Першої афілійованої лікарні Медичного університету Аньхоя з березня 2013 року по грудень 2016 року. ХОЗЛ діагностували та класифікували відповідно до ЗОЛОТА 2013 року настанови [17]. Критеріями виключення були такі: (1) інші захворювання легенів; (2) супутні захворювання, такі як судинні ускладнення діабету, печінкова недостатність, серцево-судинні захворювання, неврологічні захворювання, злоякісні пухлини, обструктивне апное сну або інші захворювання, які, як відомо, впливають на пізнання; (3) 80 мм рт.ст .; легка гіпоксія визначалася як 60 мм рт. ст
94%; легку гіпоксію визначали як 90% ≤ SaO2 ≤ 94% [19].
Пацієнти проходили стандартизований тест на легеневу функцію із застосуванням сухого спірометра протягом 24 годин до сканування МР (Erich Jaeger GmbH, Hoechberg, Німеччина), через 15 хв після вдихання 400 мкг сальбутамолу (Ventolin; GlaxoSmithKline; Лондон, Великобританія); реєстрували вимушену життєву ємність (FVC), FEV1 та співвідношення FEV1/FVC. Для пацієнтів із співвідношенням FEV1/FVC Таблиця 1 Демографічні та клінічні характеристики учасників
Аналіз VBM
Атрофію ГМ оцінювали за допомогою модульованого VBM за допомогою статистичного параметричного картографування 12 (SPM12, http://www.fil.ion.ucl.ac.uk/spm/software/spm12) [25]. 3D-структурні дані були сегментовані на ГМ, ЗМ та ліквор за допомогою програмного забезпечення VBM12, а ГМ-зображення, вирівняні за Прокрустами, були сформовані за допомогою жорсткого перетворення. Ці компоненти були нормалізовані до стандартного простору Монреальського неврологічного інституту за допомогою афінних та нелінійних реєстрацій та диффеоморфної анатомічної реєстрації з використанням експонентованого алгоритму алгебри Лі. SPM12 використовувався для згладжування зображень за допомогою 8-мм ядра Гауса. F-тест використовувався для спочатку виявлення ділянок ГМ, що відрізняються між чотирма групами, і проводили пост-hoc аналізи для пошуку попарних відмінностей між групами (важкі проти порівняння, помірні проти порівняння, легкі проти порівняння, важкі проти помірних тощо). Рівень значущості був встановлений на рівні P 30 вокселів [26], а для багаторазового порівняння було застосовано корекцію помилок з урахуванням сімейної помилки (FWE). Аналізи були скориговані з урахуванням віку, статі, рівня освіти, індексу маси тіла (ІМТ), статусу куріння, індексу куріння та балів WMH.
Частковий кореляційний аналіз був таким: 8 цікавих областей (ROI) (включаючи двобічну орбітальну частину нижньої лобової звивини; ліву верхню лобову звивину, середню лобову звивину, медіальну орбітальну звивину, парагіпокампальну/веретеноподібну звивину, додаткова рухова кора і правий таламус) були обрані для кластерів, що демонструють відмінності між чотирма групами, а значення щільності ГМ (ГМД) витягували з карт ГМ кожної особини. Часткові кореляційні зв'язки між значеннями GMD та клінічними змінними (бали MoCA, вимірювання FEV1, PaO2 та SaO2) проводились із статтю, віком, освітою, ІМТ, статусом куріння, індексом куріння та показниками WMH як коваріати. Статистичну значимість визначали як P
Результати
Фізіологічні та поведінкові дані
Не було різниці у віці, статі, ІМТ, стані куріння або освіті серед легких, середніх та важких груп ХОЗЛ та групи порівняння (P > 0,05). Однак показники функції легенів (ОФВ1%) та показників газів крові (PaO2 та SaO2) показали суттєві відмінності (P Таблиця 2 Загальний і підрозділи балів MoCA учасників
Зміна GMD
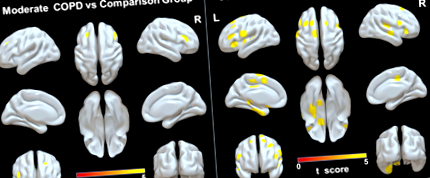
У порівнянні з групою порівняння, у хворих на ХОЗЛ спостерігалася широко поширена атрофія ГМ у двобічній орбітальній частині нижньої лобової звивини; ліва верхня лобова звивина, середня лобова звивина, медіальна очноямкова звивина, парагіпокампальна/веретеноподібна звивина та додаткова рухова кора; і правий таламус (P Рис. 1
Зміна WM
Суттєві відмінності в MD, AD та RD спостерігались серед чотирьох груп, включаючи зміни цілісності WM у мозолистому тілі, цингулумі, форніксі, корона-радіаті, задньому таламічному опроміненні, внутрішній капсулі, зовнішній капсулі (зліва), верхній та нижній поздовжній фасцикулюс (ліворуч) і нижній лобно-потиличний фасцикулус (ліворуч); значення FA не суттєво відрізнялись серед чотирьох груп (P Рис. 2
Порівняно з групою порівняння, тяжкі пацієнти з ХОЗЛ продемонстрували найширші зміни в цілісності ЗМ, включаючи збільшення значень МД, АД та РД у двосторонньому задньому коронарному випромінюванні; ліва передня і верхня корона променева, ліва цингулум (цингулярна звивина); ліве заднє випромінювання таламуса; ліва передня кінцівка внутрішньої капсули; ліва зовнішня капсула; і гену, тіло і селезій мозолистого тіла. Додаткове збільшення МД або РД спостерігалося в області форнікса, двосторонньої цингулуми (цингулярна звивина), правої передньої та верхньої коронарних променевих кісток, лівої задньої кінцівки внутрішньої капсули, лівої верхньої та нижньої поздовжньої фасцикули і лівої нижньої лобно-потиличної фасцикули (рис. . 3).
Кореляційний аналіз
Не було статистично значущої кореляції між змінами GMD або WM та PaO2 або SaO2.
У групі ХОЗЛ GMD у лівій верхній лобовій звивині та правій очноямковій частині нижньої лобової звивини позитивно корелювали з показниками MoCA (r = 0,233, P = 0,048; r = 0,293, P = 0,009 відповідно) та значення FEV1 (r = 0,433, P Таблиця 3 Кореляція параметрів візуалізації з оцінками MoCA та FEV1 при ХОЗЛ
Кореляційний аналіз між показниками MoCA, FEV1 та GMD у хворих на ХОЗЛ. Скорочення: MoCA, Монреальська когнітивна оцінка; ОФВ1, об’єм форсованого видиху за 1 с; ХОЗЛ, хронічна обструктивна хвороба легень; R-OPIFG, права очноямкова частина нижньої лобової звивини; та L-SFG, ліва верхня лобова звивина
Обговорення
У цьому дослідженні ми виявили, що показники MoCA у пацієнтів із ХОЗЛ поступово знижувались від легкої до важкої ХОЗЛ. Більше того, мозкові структури вищезазначених груп хворих на ХОЗЛ продемонстрували тенденцію до прогресивних змін.
Ми виявили, що оцінка хворих на ХОЗЛ за елементами MoCA, що вимірюють аспекти виконавчої функції, уваги та затримки пам'яті, була нижчою, ніж у групі порівняння, подібно до результатів попереднього дослідження, яке показало, що незворотне обмеження потоку повітря у хворих на ХОЗЛ може призвести до зниження постачання кисню, що може спричинити пошкодження нейронів мозку, та безперервна гіпоксія може завдати шкоди затримці відкликання та уваги людей [27]. Інкальці та ін. [28] також виявив, що у хворих на ХОЗЛ з гіпоксією та високим рівнем вуглекислого газу характерна картина когнітивного зниження, що характеризується порушеннями виконавчої функції та уваги. Література продемонструвала наявність легких когнітивних порушень (ІМС) у пацієнтів із синдромом обструктивного апное сну та гіпопное (OSAHS); оцінка предметів MoCA надалі виявила вибіркове зниження візуально-просторових навичок, виконавчої функції, уваги та затримки пам’яті, а показники MoCA суттєво корелювали з рівнями TNF-α у сироватці [29]. Крісан та ін. [30] виявив, що низький рівень ОФВ1 був пов'язаний зі зниженням показників MoCA. Ці результати підтверджують наші висновки і припускають, що когнітивні порушення, що супроводжують ХОЗЛ, можуть бути викликані гіпоксією, затримкою вуглекислого газу, запальними факторами або легеневою дисфункцією.
ФА чутливий до мікроструктурних змін; МД - міра загальної дифузії у вокселі [41]; AD збільшується в трактах ШМ із дозріванням мозку і чутливий до травм аксонів; а РД чутливий до діаметрів аксонів та демієлінізації [42]. Таким чином, значне зниження ФА та збільшення АД та РД вказують на можливість пошкодження аксонів та/або мієліну [41, 43]. Однак ми не виявили суттєвої різниці у значеннях FA серед чотирьох груп. На ФА впливають MD, AD та RD [44]. Однак, коли значення MD, AD і RD збільшуються одночасно, значення FA може не змінюватися, що спостерігалося в наших дослідженнях.
Тому в цьому дослідженні ми поєднали ці три значення, щоб спостерігати зміни в мікроструктурі ЗМ у пацієнтів з ХОЗЛ. Ми виявили, що зміни ВМ у хворих на ХОЗЛ локалізовані головним чином у коронарних променевих кільцях, звивистій мозолі, мозолистому тілі та верхньому та нижньому поздовжньому фасцикулюсі, а зміни у важкій групі були більш масштабними, ніж у групі середньої тяжкості. ЗМ змінився ширше, ніж ГМ. Хоча WM, який займає 50% від загального обсягу мозку у людини, має швидкість метаболізму, подібну до ГМ [45, 46], WM отримує непропорційно невелике кровопостачання та незначний побічний кровообіг, що робить його особливо сприйнятливим до ішемічних образів [ 46, 47], в яких хронічне системне запалення, тканинна гіпоксія та окислювальний стрес відіграють вирішальну роль [48]. Аксональні зміни заважають спілкуванню між структурами мозку і, таким чином, змінюють функції цих структур [49].
Ми виявили, що GMD лівої верхньої лобової звивини та правої очноямкової частини нижньої лобової звивини, MD та RD тіла мозолистого тіла та AD двобічних верхніх коронарних променевих зв’язані з показниками FEV1 та MoCA. Попередні дослідження показали, що ліва сторона верхньої лобової кори виявляла сильніше стоншення [50] і що порушена функціональна зв'язок з двобічною нижньою лобовою звивиною при обструктивному апное сну [51]. Вища корона променева, пов'язаний з цим клітковинний тракт в префронтальній корі, з'єднаний з внутрішньою капсулою. Тіло мозолистого тіла містить комісуральні волокна, які з'єднують двобічні півкулі головного мозку. Всі три згадані тракти клітковини беруть участь у когнітивній функції у хворих на ХОЗЛ. Ми припускаємо, що стійке зниження функції легенів може призвести до атрофії лівої верхньої лобової звивини та правої очноямкової частини нижньої лобової звивини, а також змін WM в тілі мозолистого тіла та двобічного верхнього корона променевого, що в кінцевому підсумку призведе до когнітивних порушень.
Однак ми не знайшли чіткої кореляції між PaO2 або SaO2 та структурними змінами головного мозку у хворих на ХОЗЛ, припускаючи, що гіпоксія може не бути основним механізмом структурних змін мозку та когнітивних порушень при цій хворобі. Мозковий патологічний механізм когнітивних порушень у хворих на ХОЗЛ може бути дуже складним. Савченко та ін. та Сакураї та ін. встановлено, що ОФВ1 негативно корелював із системним запальним фактором IL-26 [52], біомаркером запалення. Співвідношення нейтрофілів до лімфоцитів (НЛР) пов'язане з тяжкістю ХОЗЛ [53]. Запальний фактор «переливання» [54] може спричинити когнітивні порушення у хворих на ХОЗЛ. Ван та співавт. [55] вивчав мозкову активність у стабільних хворих на ХОЗЛ і виявив, що середні значення сигналу в кластері зі зниженою амплітудою низькочастотних коливань (ALFF) суттєво негативно корелювали з PaCO2. Фактори запалення або затримка вуглекислого газу можуть бути потенційними механізмами, які заслуговують на подальшу увагу в майбутніх дослідженнях.
Обмеження
Висновки
Ці висновки дозволяють припустити, що у пацієнтів з ХОЗЛ спостерігаються прогресуючі структурні порушення як ГМ, так і ЗМ, а також порушені рівні функції легенів, що підкреслює важливість ранніх клінічних втручань.
- Переїдання може зменшити роботу мозку - Гарвардське здоров’я
- Харчування та ХОЗЛ 5 видів їжі, яких слід уникати легеневої освітньої та дослідницької фундації
- Нова ін’єкція допомагає зменшити масу тіла, рівень глюкози у пацієнтів із ожирінням; Новини-Медичні
- Структури нервової активації у відповідь на ознаки, пов’язані з їжею
- NewYork-Presbyterian Ask A Nutritionist Foods for Health Brain