Вплив взаємодії між поліморфізмом рецепторів меланокортину-4 та дієтичними факторами на ризик метаболічного синдрому
Анотація
Передумови
Існують суперечливі дані щодо впливу зміни гена рецептора меланокортину-4 (MC4R) на метаболічний синдром (MetS) та неефективності дієти при управлінні MetS. В цьому дослідженні досліджували ефекти взаємодії між поліморфізмом MC4R та дієтичними факторами на MetS.
Методи
Суб'єкти цього вкладеного дослідження випадків контролю були обрані серед учасників Тегеранського дослідження ліпідів та глюкози. У кожному випадку (n = 815) було випадково зіставлено пару з контролем за віком (± 5 років) та статтю серед тих, хто не розвинув ≥1 компонента MetS на той час, коли відповідний випадок розвинув MetS. Дієтичні схеми визначали, використовуючи факторний аналіз для 25 груп продуктів, використовуючи дійсний та надійний напівкількісний опитувальник частоти їжі (168 пунктів) (FFQ). MC4R rs12970134 генотипували за допомогою аналізу ланцюгової реакції полімеразної реакції Tetra-Primer ARMS. Скоригована умовна логістична регресія була використана для оцінки взаємодії SNP з квартилями харчових факторів щодо MetS. MetS був визначений модифікованою Національною освітньою програмою з холестерину/панель лікування дорослих III.
Результати
Було вилучено два режими харчування. Здорова дієта була сильно навантажена на овочі, бобові, молочні продукти з низьким вмістом жиру, цільні зерна, рідкі олії та фрукти; західний режим харчування складався з великого споживання безалкогольних напоїв, фаст-фудів, солодощів, твердих олій, червоного м’яса, солоних закусок, рафінованих зерен, молочних продуктів з високим вмістом жиру, чаю та кави, яєць та птиці. Серед носіїв аллелю А, перебуваючи в найвищих квартилях західного показника дієтичного споживання та споживання насичених жирних кислот, підвищений ризик виникнення MetS, порівняно з тими, що мають найнижчий квартиль (P-тенденція = 0,007). Вживання насичених жирних кислот може модулювати асоціацію носіїв алелю A MC4R з MetS (взаємодія P = 0,03). Значна взаємодія спостерігалась між rs12970134 із загальним споживанням жиру та заліза на ризик абдомінального ожиріння (Р взаємодія
Передумови
Методи
Навчання населення
Суб'єкти цього вкладеного дослідження випадків контролю були обрані серед учасників Тегеранського дослідження ліпідів і глюкози (TLGS), широкомасштабного перспективного дослідження на базі громади, проведеного на вибірці жителів району 13 Тегерану, столиці Ірану . Перший етап TLGS проводився з 1999 по 2001 рік у 15 005 суб'єктах віком ≥3 років, а подальші обстеження проводились кожні 3 роки (2002–2005; 2006–2008; 2008–2011 та 2011–2014) до виявити нещодавно розвинуті захворювання. Деталі цього поточного когортного дослідження були опубліковані в інших місцях [11, 12].
З 11 001 та 9807 осіб віком ≥18 років, які брали участь у базовому та другому подальших обстеженнях відповідно, 5280, були виключені через наявність MetS як на базовому рівні, так і під час другого подальшого обстеження. У поточному дослідженні серед учасників, які розробили MetS у третьому (n = 918), четвертий (n = 827) або п’ятий (n = 1050) фаз, випадковим чином було обрано 1198 випадків. Після виключення осіб з історією серцево-судинних подій, втрати ваги або збільшення> 5 кг за останні 6 місяців, вагітності та годування груддю, або тих, хто приймав будь-які серцево-судинні/антикоагулянтні/стероїдні або гормональні препарати, у дослідження було включено 1158 випадків. Кожен випадок індивідуально відповідав парам випадковим чином з контролем за віком (± 5 років) та статтю серед тих, хто не розвивав ≥1 компонента MetS на той час, коли відповідний випадок розвивав MetS. Після виключення випадків/контролів, що не мають очищення ДНК в діапазоні 1,7 1), діаграма осію, інтерпретація фактора та пояснення дисперсії (> 5%).
Умовна логістична регресія була використана для оцінки взаємодії SNP з квартилями дієтичних факторів щодо MetS після корекції базового ІМТ. Дві оцінки ймовірності були отримані під час цього статистичного аналізу, з умовами взаємодії та без них; P Значення взаємодії визначали, проводячи тест на коефіцієнт вірогідності.
Умовна логістична регресія була використана для формування коефіцієнтів шансів (OR) для MetS для осіб, які переносять або не є носієм алеля ризику (GG/AG + AA) для квартилів балів за дієтами, груп продуктів харчування та споживання поживних речовин (Q1-Q4). Найменший квартиль дієтичних факторів та група гомозигот з основним алелем були досліджені як референтна група. Була проведена безумовна логістична регресія для оцінки взаємодії MC4R SNP з квартилями показників харчування, групами продуктів харчування та споживанням поживних речовин щодо компонентів MetS. Всі ОР були скориговані на змінні, які, як було доведено, пов’язані з компонентами MetS, включаючи вік, стать, рівень освіти, статус куріння, фізичну активність та споживання енергії. Для визначення P значення для тенденції по квартилях дієтичних факторів, використовували логістичну регресію, використовуючи медіану кожного квартиля оцінок дієтичного режиму як безперервну змінну. Дані аналізували за допомогою статистичного пакета STATA v.12.0 або SPSS версії 16.0 (версія 16.0; SPSS, Чикаго, Іллінойс).
Результати
Навчання населення
Загальні характеристики учасників за випадками та контролем наведені в таблиці 1. Не було суттєвої різниці між двома групами у фізичному навантаженні, роках навчання, курінні або щоденному споживанні енергії. Однак на початку дослідження значення компонентів MetS суттєво відрізнялись серед випадків захворювання та контролю. Частота генотипів була в рівновазі Харді Вайнберга (P = 0,92). Істотних відмінностей у частоті генотипів або алелів між цими двома групами не спостерігалось.
Визначено дві основні схеми харчування; здоровий режим харчування був сильно навантажений на овочі, бобові, молочні продукти з низьким вмістом жиру, цільні зерна, фруктові соки, рідкі олії та фрукти, тоді як західний режим харчування складався з великого споживання безалкогольних напоїв, фаст-фудів, солодощів та цукру, твердих олій, червоне м'ясо, солоні закуски, рафінована крупа, молочні продукти з високим вмістом жиру, чай та кава, яйця та птиця (таблиця 2).
Взаємодія SNP та режими харчування щодо MetS або його компонентів
Після корекції базового ІМТ спостерігалась значна взаємодія між MC4R SNP та західним режимом харчування щодо MetS (P взаємодія = 0,04). Ризик MetS не був однорідним у двох групах генотипу rs12970134 MC4R, серед квартилів західних балів. Серед носіїв аллелю A (AG + AA), перебуваючи в найвищих квартилях західного раціону харчування, підвищений ризик виникнення MetS, в порівнянні з тими, що мають найнижчі квартилі (P-тенденція = 0,007); однак у носіїв генотипу GG rs12970134 не було виявлено значущої зв'язку між оцінкою західної дієтичної картини та ризиком MetS (P-тенденція = 0,32) (Таблиця 3). Не було значної взаємодії між MC4R SNP та здоровим режимом харчування щодо MetS. Крім того, не спостерігалося взаємодії між геном MC4R та режимами харчування щодо компонентів MetS.
Взаємодія SNP з поживними речовинами та споживанням групової їжі щодо MetS або його компонента
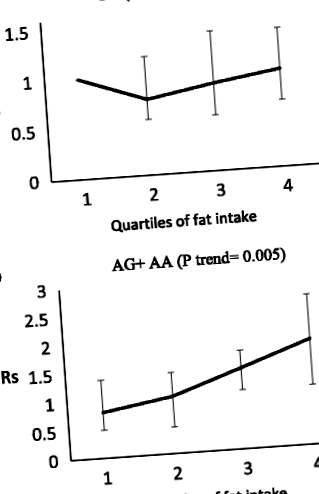
Серед макроелементів, досліджених у цьому дослідженні [вуглеводи, білки, загальний жир, насичені жирні кислоти (SFA), Поліненасичені жирні кислоти та мононенасичені жирні кислоти], лише споживання SFA може модулювати асоціацію носіїв генотипу ризику MC4R з MetS (взаємодія P = 0,03 ). На підставі наших спостережень, носії алелів A (AG + AA) більш чутливі до SFA, ніж носії генотипів GG, і носії алелів A, які споживали більше SFA, мали вищий ризик розвитку MetS, ніж носії генотипів GG, з яких такі стосунки спостерігались. Крім того, спостерігалася значна взаємодія між загальним споживанням жиру та SNP MC4R щодо абдомінального ожиріння (P взаємодія = 0,01), тобто у носіїв алелів A ризик абдомінального ожиріння збільшувався по квартилях загального споживання жиру (P trend = 0,005), однак асоціація не була значущою у носіїв гомозигот GG (P-тенденція = 0,41) (рис. 1). Значної взаємодії між іншими макроелементами та SN4 MC4R щодо інших компонентів MetS не спостерігалося.
Коригується АБО для абдомінального ожиріння до квартилей споживання жиру за генотипами MC4R (p взаємодія = 0,01). Q1 35,83% енергії. Крім того, спостерігалася значна взаємодія між загальним споживанням жиру та SNP MC4R щодо абдомінального ожиріння (P взаємодія = 0,005), така що у носіїв алелів A ризик абдомінального ожиріння збільшувався по квартилях загального споживання жиру (P trend = 0,005), асоціація, однак незначна у носіїв гомозигот GG (P-тенденція = 0,41)
Серед поживних речовин (залізо, цинк та магній) залізо мало взаємодію з MC4R SNP у розвитку абдомінального ожиріння (Р взаємодія = 0,006); у носіїв алелей A ризик абдомінального ожиріння істотно не змінився із збільшенням споживання заліза (P-тенденція = 0,50), тоді як для носіїв генотипу GG, більш високе споживання заліза призвело до збільшення ризику абдомінального ожиріння (P-тенденція = 0,002) (Рис. 2). Не спостерігали значної взаємодії для SN4 MC4R із споживанням магнію та цинку щодо MetS або його компонентів.
Коригується АБО для абдомінального ожиріння до квартилі споживання заліза за генотипами MC4R (p взаємодія = 0,002). Q1 40,36 мг. Серед інших поживних речовин (заліза, цинку та магнію) залізо має взаємодію з цим ОНП у розвитку абдомінального ожиріння (Р взаємодія = 0,006); у носіїв алелей A ризик абдомінального ожиріння істотно не змінився із збільшенням споживання заліза (P-тенденція = 0,50), але для носіїв генотипу GG збільшення споживання заліза призвело до збільшення ризику абдомінального ожиріння (P-тенденція = 0,002)
Значну взаємодію спостерігали між rs12970134 та зеленими овочами, безалкогольними напоями та групами червоного м’яса щодо ризику низького рівня ЛПВЩ (Р взаємодія = 0,04), високого FPG (P взаємодія = 0,02) та високий TG (P взаємодія = 0,05) відповідно. Співвідношення шансів на низький рівень ЛПВЩ значно зменшилось із збільшенням споживання зелених овочів носіями генотипу ризику (P-тенденція = 0,009), тоді як ця група продуктів харчування не мала значного впливу на коефіцієнт шансів на низький рівень ЛПВЩ у носіїв генотипу GG ( P тенденція = 0,32) (рис. 3). У носіїв алелів A збільшення споживання червоного м’яса призвело до більш високого ризику високого рівня TG (P-тенденція = 0,005), ефект не спостерігався для носіїв генотипу GG (P-тенденція = 0,33) (рис. 4); у носіїв генотипу GG коефіцієнт шансів на високу FPG значно збільшився по квартилі споживання безалкогольних напоїв (P-тенденція = 0,006), хоча ця асоціація була незначною у носіїв генотипу ризику AG + AA (P-тенденція = 0,48) (рис. 5).
Коригується АБО для холестерину ліпопротеїдів низької щільності до квартилів зелених спожитих овочів за генотипами MC4R, (р взаємодія = 0,04). Q1 74,08 гр. Співвідношення шансів на низький рівень ЛПВЩ значно зменшилось із збільшенням споживання зелених овочів носіями генотипу ризику (p тенденція = 0,009), але споживання цієї групи продуктів харчування не мало значного впливу на співвідношення шансів на низький рівень HDL у носіїв генотипу GG (p тенденція = 0,32)
Коригується АБО для високих тригліцеридів до квартилів споживання червоного м’яса за генотипами MC4R (взаємодія P = 0,05); Q1 27,81 гр. У носіїв алелів A більша кількість споживання червоного м’яса призводила до більш високого ризику високого рівня TG (p тенденція = 0,005), але цей ефект не спостерігався для носіїв генотипу GG (p тенденція = 0,33)
Коригується АБО для високого вмісту глюкози в крові натще до квартилів безалкогольних напоїв за генотипами MC4R (Р взаємодія = 0,02); Q1 28,57 гр. У носіїв генотипу GG коефіцієнт шансів на високу FPG суттєво збільшився по квартилях споживання безалкогольних напоїв (p тенденція = 0,006), але ця асоціація не була значущою у носіїв генотипу ризику (AG + AA) (p тенденція = 0,48)
Обговорення та висновки
Отримані нами дані вказують на те, що особи зі сприйнятливими генотипами були більш чутливими до загального споживання жиру, ніж особи з генотипами GG, а збільшене споживання жиру або продуктів з високим вмістом жиру (наприклад, червоне м’ясо) у цій групі генотипів ще більше збільшило ризик компонентів MetS.
Кілька механізмів можуть виправдати роль споживання жиру у посиленні ефекту генотипів високого ризику на компоненти MetS. Оскільки MC4R функціонує під впливом анорексигенних гормонів (інсулін та лептин), вплив дієти з високим вмістом жиру з посиленням запалення в гіпоталамусі і згодом підвищує стійкість до лептину та інсуліну, що призводить до зниження функції MC4R [27, 28]. Дослідження на тваринах також припускають, що дієта з високим вмістом жиру може впливати на епігенетичні явища, змінюючи статус метилювання ДНК гена MC4R, і таким чином вона може змінити рівень експресії гена MC4R [29]; останнє, але не менш важливе: у ряді досліджень на експресію та функцію гена MC4R впливало споживання жиру з їжею, показавши, що вплив дієти з високим вмістом жиру у щурів призводить до зниження мРНК MC4R [30, 31].
Попередні дані повідомляють про пряму залежність між споживанням напоїв, підсолоджених цукром, споживанням заліза та ризиком компонентів MetS [32, 33]. Однак у нашому дослідженні цей взаємозв'язок спостерігався у суб'єктів з генотипом GG, але не у носіїв алелю A. Оскільки дефіцит заліза є частим виявленням ожиріння [34], виникає гіпотеза, чи може метаболізм заліза змінюватися у носіїв алелю А. Для підтвердження цієї гіпотези та з’ясування того, як відбувається ця зміна метаболізму, безумовно необхідні подальші дослідження.
У поточному дослідженні споживання зелених овочів модифікувало ефект генетичних змін на рівні ЛПВЩ. Зміна генетичної експресії або статусу метилювання ДНК при вживанні фолатів або фітохімікатів може бути виправданням цього ефекту, оскільки в нашому дослідженні не спостерігалося значної взаємодії між споживанням магнію та MC4R rs12970134 щодо MetS та його компонентів.
Сильні сторони нашого дослідження включають використання проспективних досліджень з довгостроковим спостереженням, велику кількість випадків, що відповідають індивідуально за віком та статтю, значне коригування для потенційних незрозумілих, використання аналізу дієтичного харчування для кращого виявлення асоціації загальний склад дієти і, нарешті, вибір нових випадків MetS, що зменшило можливість будь-яких змін дієтичної поведінки через усвідомлення хвороби.
Однак слід усунути кілька обмежень; Наше досліджуване населення було дуже однорідним, оскільки дослідження проводилось лише на жителях району 13 Тегерану. Статистичні методи, що використовуються для визначення дієтичних схем, тобто факторний аналіз, є дещо суб'єктивними, і дієтичні схеми можуть відрізнятися залежно від соціально-економічного статусу, етнічних груп та культур. Однак попередні дослідження продемонстрували розумну відтворюваність, обгрунтованість та стабільність західного режиму харчування в підпробі населення Тегерану [35]. Вимірювання адипонектину та генотипування поліморфізмів FTO у цьому дослідженні не проводились, хоча адипоцитокіни, такі як адипонектин та ген FTO, ефективні у Mets. Чутливість до інсуліну, як чутливого маркера, не вимірювали, саме тому ми не змогли виявити взаємодію харчових факторів та MC4R SNP щодо нього.
Це дослідження продемонструвало значну взаємодію між західним режимом харчування та дієтою SFA з варіантом MC4R щодо MetS; високе споживання SFA (близько 14% енергії) носіями алелів A збільшувало ризик MetS, однак споживання тієї ж кількості SFA носіями генотипу GG не впливало на ризик Mets. Також спостерігалась значна взаємодія між SNP MC4R та зеленими овочами, безалкогольними напоями, споживанням червоного м'яса та заліза відповідно до ризику низького рівня ЛПВЩ, високого FPG та високого TG та ожиріння живота, тому раннє виявлення людей із високим ризик MC4R rs12970134 алеля та обмеження західного режиму харчування та споживання жиру та вживання більше овочів було б підходящою стратегією зменшення захворюваності на MetS або його компоненти в цій генетичній групі.
Схвалення етики та згода на участь
Протокол дослідження був схвалений двома етичними комісіями, етичним комітетом Науково-дослідного інституту ендокринних наук, Університетом медичних наук Шахіда Бехешті, Тегеран та Комітетом з питань медичних досліджень Університету медичних наук Джунді Шапур, Ахваз, Іран.
- Вплив короткочасної гіпокалорійної дієти на експресію генів печінки та метаболічні фактори ризику в
- Вплив добавки екстракту журавлини на фактори серцево-судинного ризику при ожирінні, інсуліні
- Вплив вегетаріанських та різних всеїдних дієт на фактори ризику сечової кислоти в сечі
- Потенціал перехідного рецептора епітеліального каналу Mg2 Меластатин 6 регулюється дієтичним Mg2
- Вплив заміни рідкої їжі на фактори кардіометаболічного ризику при надмірній вазі