Вплив впливу 2-G на регулювання температури, циркадні ритми та ожиріння у трансгенних мишей UCP2/3
Секція нейробіології, фізіології та поведінки, Відділ біологічних наук,
Секція нейробіології, фізіології та поведінки, Відділ біологічних наук,
Кафедра педіатрії, і
Програма Роу з генетики, Медичний факультет, Каліфорнійський університет, Девіс, Каліфорнія 95616-8519
Програма Роу з генетики, Медичний факультет, Каліфорнійський університет, Девіс, Каліфорнія 95616-8519
Секція нейробіології, фізіології та поведінки, Відділ біологічних наук,
Анотація
Швидкість метаболізму, виміряна споживанням кисню, зростає при хронічній гіпергравітації (22). У 2 Г малі ссавці лінійно збільшують споживання кисню із загальною масою тіла (24, 25). Більше того, у деяких видів виявлено, що потреби у підтримці харчових речовин безпосередньо пов'язані з рівнем прискорення в межах хронічної толерантності до G (30, 31). Відповідне зменшення витрат метаболічної енергії було зафіксовано у резус-мавп, що зазнали впливу мікрогравітаційного космічного середовища (Космос 2044 та 2229) (11, 32). У цих мавп загальний обмін метаболічної енергії, виміряний обертом подвійно міченої води, зменшився на ~ 40% (11, 32). Ці висновки представляють найбільш пряму демонстрацію метаболічних витрат сили тяжіння. На жаль, постійність гравітаційного поля Землі маскує цей важливий взаємозв’язок між метаболічною вартістю життя та гравітаційним середовищем.
Пропорційний розподіл маси тіла між жиром та знежиреними компонентами також вивчався в гіпердинамічних середовищах. Перші кілька днів хронічного центрифугування супроводжуються зменшенням маси тіла (3) та зміною обміну глюкози та жирів (6, 7). Під час впливу гіпердинамічного середовища спостерігалася втрата жиру в організмі мишей (23), щурів (34), кроликів (19) та курей (3). Це зменшення жирової складової маси тіла може бути досить великим; наприклад, кури зменшуються з 30% жиру в організмі при 1 G до 3% при 3 G (3). Зменшення жиру в організмі свідчить про фундаментальний зрушення у використанні субстрату під час впливу гіпердинамічного середовища. Крім того, такий метаболічний зсув може означати змінену функціональну роль адипоцитів і міоцитів у регулюванні посередницького метаболізму та енергетичного гомеостазу протягом 2 G.
Білки, що роз’єднують мітохондрії (UCP), були залучені як потенційні підсилювачі витрат енергії. Фізіологічна роль in vivo UCPs невідома; однак, UCP, імовірно, функціонують як для підвищення термогенезу тканин, так і для регулювання використання ліпідів як паливного субстрату (29). Першим описаним UCP був UCP1, розташований у жировій тканині коричневого кольору. Зовсім недавно UCP2 та UCP3, гомологи коричневого жирового UCP1, були описані в центральних та периферійних тканинах, включаючи гомеостатичні мозкові центри (16, 28), а також скелетних м'язах, білій жировій тканині, печінці, селезінці та серці (2, 8). Як UCP2, так і UCP3 мають властивості відключення in vitro, подібні до UCP1 (2, 8). Створення трансгенної лінії мишей UCP2/3 дає можливість перевірити можливі ролі UCP2 та UCP3 in vivo. Миші в цьому дослідженні були отримані з трансгенної лінії, яка надмірно експресувала UCP2 в селезінці, гіпоталамусі, шлунково-кишковому та білій жировій тканинах та UCP3 в шлунково-м’язовому м’язі. Вважається, що конструкція містить усі промоторні елементи для експресії в нормальних природних тканинах. Крім того, Northern blots підтвердили, що UCP2 та UCP3 утворюються у всіх нормальних тканинах, а не в інших.
Експериментальна парадигма 2-G забезпечує унікальний інструмент для дослідження in vivo фізіологічної ролі UCP2 та UCP3 у терморегуляції та ожирінні. Через потенційну роль UCP2 та UCP3 в опосередкуванні терморегуляційного термогенезу через посилений базальний (метаболізм) або факультативний (підвищене теплоутворення) термогенез тканин, вплив 2 G може викликати диференційну реакцію Tb у трансгенних мишей та мишей дикого типу. Більше того, оскільки UCP2 та UCP3 були залучені до регуляторів ліпідів як паливного субстрату, трансгенна популяція може продемонструвати диференційний жировий метаболізм щодо нетрансгенних речовин під час дії 2 G. У цьому контексті UCP2/3 може виконувати метаболічну адаптивну роль для певних тканини в періоди підвищеної мобілізації жирних кислот. Така передбачувана роль раніше була запропонована для UCP2/3 (4).
Таким чином, це дослідження перевіряє гіпотези про те, що надмірне вираження UCP2/3 буде1) змінити профіль регуляції Tb при 2 G і2) збільшують споживання жиру, як оцінюють за змінами у складі тіла та маси жирової прокладки.
Трансгеніка.
Трансгенних мишей виготовляли з використанням клону бактеріальної штучної хромосоми людини (80 кб). Клон BAC був виділений Genome Systems шляхом гібридизації з людським зондом кДНК UCP2. Цей клон містить усі UCP2 та UCP3. Вони організовані UCP3, а потім UCP2 в орієнтації 5 'до 3'. Крім того, існує 8 кб 3 ′ UCP2 і ∼40 кб 5 ′ UCP3. Це було визначено прямим секвенуванням UCP2, що містить субклони, демонстрацією того, що UCP3 становить 8 кб 5 'UCP2, та опублікованою інформацією про структуру генів та розміри інтронів UCP2 та UCP3 людини. Трансгенних мишей перевіряли методом ПЛР та з тканинною експресією, використовуючи аналіз Нозерн-блот. Догляд за мишами в експерименті відповідав стандартам, встановленим Національним інститутом охорони здоров’я (NIH) у своїх дослідженнях Посібник з догляду та використання лабораторних тварин та був затверджений Інституційним комітетом з догляду та використання тварин у Каліфорнійському університеті.
Тварини та біотелеметрія.
Вісім трансгенних мишей для дорослих чоловіків (28–33 г) UCP2/3 і дев’ять дорослих чоловіків (29–32 г) нетрансгенних однолітніх (дикого типу) (Mus musculus) були імплантовані внутрішньочеревно з передавачами біотелеметрії (диск VM-FH; Minimitter, Sunriver, OR) для запису Tb та активності. Розпочато та підтримують хірургічну площину анестезії із застосуванням 3% ізофлурану в чистому медичному кисні, що вводиться регульованим випарником ізофлурану (Viking Medical Products, Medford Lakes, NJ). За допомогою асептичних методів була виконана целіотомія середньої лінії і стерилізований передавач був введений в порожнину очеревини. Всі розрізи зашивали і обробляли лідокаїном та місцевим антибіотиком. Миші відновлювались на грільній панелі, причому Tb постійно контролювали через зонд товстої кишки.
Корпус та центрифуга.
Через 10 днів відновлення мишей поміщали на центрифугу діаметром 4,6 м. Тварин індивідуально поселяли у стандартних пластикових клітинах для мишей з їжею (лабораторна дієта) та водою ad libitum. Кожна клітка розміщувалася поверх телеметричного приймача, з'єднаного з мікрокомп'ютерною системою збору даних (Data Sciences). Значення Tb реєстрували з інтервалом у 5 хвилин, а дані про активність збирали у бункери за 5 хвилин. Клітки розміщувались у модулях центрифуг, які забезпечували вентиляцію, 12: 12-годинний цикл світло-темрява, температуру навколишнього середовища 25 ± 1 ° C та візуальну ізоляцію. Модулі, що містять клітки, були встановлені з одним ступенем свободи, забезпечуючи тим самим, що сітчасте поле G завжди було перпендикулярним до підлоги клітини. Для встановлення базових рівнів використовували 2-тижневий період 1 G, після чого мишей піддавали дії 2 G центрифугуванням протягом 8 тижнів. Центрифугування переривали двічі на тиждень на період від 15 до 20 хвилин, необхідних для тваринництва.
Жировий склад і склад тіла.
Після закінчення дії 2-G мишей виймали з центрифуги і негайно вбивали. Жирові прокладки (брижові, заочеревинні, стегнові та епідидимальні) видаляли та зважували. Склад тіла визначали методом Белла і Стерна (1). Коротко кажучи, туші готували шляхом евісцерації та сушили ліофілізацією протягом 7 днів (або до тих пір, поки 2 послідовних зважування на день не відрізнялися не більше ніж на 2%), а потім зважували з отриманням сухої маси та відсотків води в організмі. Потім ліпіди екстрагували ефіром протягом 7 днів і ацетоном екстрагували протягом 5 днів. Потім тушку повторно заморожували протягом 24 годин і зважували, щоб визначити відсоток жиру в організмі.
Статистика.
Фазу, середнє значення та активність Tb та ритмів активності визначали за допомогою програми фазового підбору (аналіз гармонічної регресії найменших квадратів), яка використовувала алгоритм Фур'є. Повторні заходи ANOVA використовували для порівняння гравітаційних умов [1 G (контроль), ранні 2 G (адаптація) та пізні 2 G (відновлення)]. Конкретні середні порівняння були проведені за допомогою спеціального тесту Тукі (SPSS). Щодо жирової маси, порівняння між експериментальною та контрольною групами аналізували неспареними т-тест. Рівень значущості P 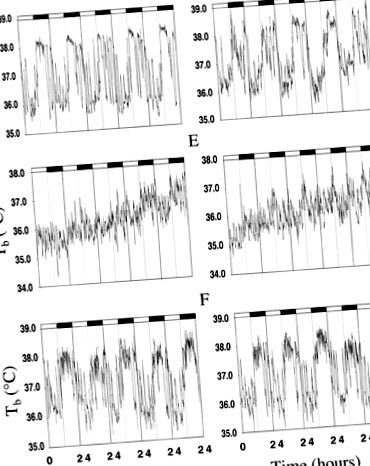
Рис. 1.Ділянки репрезентативної температури тіла (Tb) дані з дикого типу (зліва) і трансгенні (правильно) миші. A і D: Tb при 1 G.B і Е: Tb на початку 2 G.C. і F: Tb протягом кінця 2 р.
Таблиця 1. Температура та активність тіла в середовищах 1-Г, 2-Г та пізніх 2-Г
- Знайти найкраще) Таблиця цілей для схуднення Вулкан Gnc Добавка Побічні ефекти - Табір Комо
- Поширені астматичні стероїди, пов’язані з побічними ефектами в надниркових залозах Стаття AMP Reuters
- Порівняльне дослідження між ефектами стрічки Kinesio та одягом під тиском на вторинну верхню частину
- Побічні ефекти глюкофажа загальні, важкі, довгострокові
- Огляд крему Capsicum для використання болю; Побічні ефекти