Вплив ожиріння, спричиненого дієтою, на рівень плазми нейромедіаторів моноамінів у
Ключові слова: Серотонін, дофамін, норадреналін, ожиріння, депресія, дієта з високим вмістом жиру
Тісний зв’язок між ожирінням та розладами настрою був добре встановлений (Needham et al., 2010), і численні епідеміологічні дослідження підтверджують це (Ma and Xiao, 2010). Дійсно, багато досліджень продемонстрували, що зміни настрою можуть бути пов'язані із станами із зайвою вагою (McElroy et al., 2004), але дебати проти нього не перестають тривати через однаково багато рядків суперечливих доказів (Friedman and Brownell, 1995; Atlantis and Бейкер, 2008; Пікерінг та ін., 2011). Більше того, механістичні дослідження, що пояснюють взаємозв'язок ожиріння та розладів настрою, вкрай обмежені через технічні труднощі кількісної оцінки психічного здоров'я або настрою на моделях тварин.
Ролі нейромедіаторів моноамінів, таких як серотонін, норадреналін та дофамін в модуляції настрою, були добре встановлені (Lanni et al., 2009). Були зроблені спроби виміряти рівень нейромедіаторів у тканинах мозку, щоб побачити зміни настрою, пов'язані з ожирінням (Kimbrough and Weekley, 1984). Однак тканини мозку нелегко зібрати і, що ще гірше, навряд чи доступні в клінічних дослідженнях людини. Замість тканин головного мозку при різноманітних розладах настрою кілька досліджень досліджували рівні нейромедіаторів у крові, екстраполювали їх до рівнів мозку та досліджували зв'язок з особливостями поведінки (Madsen and McGuire, 1984; Moffitt et al., 1998). Однак досі не було звітів щодо рівня нейромедіаторів крові в моделях ожиріння на тваринах, наскільки нам відомо.
Тут ми розробили чутливий, одночасний і швидкий метод кількісного визначення для визначення серотоніну, дофаміну та норадреналіну в плазмі за допомогою UPLC/MSMS (ультрапродуктивна тандемна мас-спектрометрія) та вивчив вплив ожиріння, спричиненого дієтою з високим вмістом жиру (HFD), на рівні нейромедіаторів моноамінів у самців мишей C57BL/6 для вивчення зв'язку між змінами настрою та ожирінням.
Самці мишей C57BL/6J, віком 5-6 тижнів, вагою 20 ± 2 г (Орієнтбіо, Сеул, Корея), розміщувались окремо в поліетиленових клітках в середовищі з контрольованою температурою 24 ± 2 ℃, постійною вологістю 50 ± 10 %, і 12-годинний цикл світлої темряви. Мишей акліматизували протягом останнього 1 тижня до експерименту і розподіляли випадковим чином у різні групи. Тварини мали вільний доступ до стандартної дієти з Кореї Пуріни або до 60% Ккал дієти з високим вмістом жиру (D12492, Research Diets, Нью-Брансвік, Нью-Джерсі, США) та водопровідної води за бажанням .
Фізичну активність мишей вимірювали на 4 тижні HFD, підраховуючи кількість переміщень від кінця клітки до протилежної сторони. Через 8 тижнів кров збирали з ретроорбітального венозного сплетення за допомогою капілярної трубки гепарину натрію для клінічних хімічних змін за допомогою автоматизованого аналізатора Selectra E ® та вимірювання нейромедіаторів. Усі миші були задоволені, а печінку та епідидимальну жирову тканину видалили та зважили.
Біоаналіз підготовки зразків нейромедіаторів
Одночасний біоаналіз моноамінів у плазмі крові проводили за допомогою UPLC/MSMS згідно з раніше описаним методом (Hammad et al., 2009) з незначними модифікаціями. До 50 мкл аліквот плазми додавали 10 мкл 100 нг/мл дофаміну-d4 (як внутрішній стандарт). Після осадження білка вихровим змішуванням з 200 мкл ацетонітрилу: метанолу (75:25, 2% мурашиної кислоти) протягом 5 хв зразки центрифугували при 14000 об/хв, 4 ℃ протягом 10 хв. Верхній органічний шар переносили і випаровували насухо, використовуючи Speedvac (EZ-2 Plus, Genevac, Swiss) при 40 ℃. Залишки відновлювали у 100 мкл ацетонітрилу: метанол (75:25, 0,1% мурашиної кислоти) та 5 мкл розчинів зразків вводили в систему UPLC/MS.
Значення виражали як середнє значення ± стандартне відхилення (SD). Статистичне порівняння проводили за допомогою t-критерію студента для порівняння двох груп та тесту ANOVA для порівняння кількох груп з Minitab ® (State College, PA, USA). Кореляційний аналіз Пірсона був використаний для перевірки кореляції між змінними. Для відповідних рівнів трьох нейромедіаторів ожиріння та не ожиріння тварин було проведено аналіз основних компонентів (PCA), багатофакторний аналіз, який може неконтрольовано вивчити взаємозв'язок багатьох факторів.
Щоб дослідити зв’язок між ожирінням та розладами настрою, ожиріння індукували у самців мишей C57BL/6J дієтою з високим вмістом жиру (HFD, 60% від загальної кількості калорій протягом 8 тижнів). HFD індукував значно більший приріст ваги в організмі (+ 37,8%) та жировій тканині (епідидимус, + 306%) (рис. 1 А та В), і послідовно рівень ЛПНЩ, ЛПВЩ та холестерину значно збільшувався (рис. 1 С), що вказує стійкий розвиток ожиріння. Однак фізична активність мишей з ожирінням не відрізнялася від активності худорлявих тварин (ожиріння проти худих, 9,9 ± 2,5 проти 11,9 ± 3,9 як середнє значення ± SD, p = 0,297, рис. 1 D), що відображає, що фізичні навантаження можуть бути недостатніми або достатньо чутливий для діагностики змін настрою, пов’язаних із ожирінням.
Примітно, було виявлено значну кореляцію між окремими рівнями серотоніну та збільшенням маси тіла (рис. 3 А), як визначено кореляційним аналізом Пірсона (Коефф = - 0,512, пп = 0,070, рис. 3 Б), та між серотоніном та норадреналін (Коефф. = 0,489, р = 0,054, рис. 3 С).
Рис. 3. Зв'язок між нейромедіаторами плазми та ожирінням. (A) Корреляційна крива збільшення маси тіла (BWG) проти серотоніну (SER), (B) дофаміну (DOP) проти норадреналіну (NEP). (C) SER проти NEP. Аналіз основних компонентів проводили з нормалізованими рівнями нейромедіаторів. (D) 3D-бальна діаграма для PC1, PC2 та PC3. Заповнені кола представляють мишей, що харчуються HFD, і порожнисті кола, нормальних мишей, що харчуються дієтою (E) Графік завантаження для PC2. 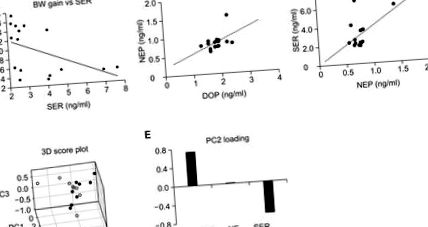
Для подальшого вирішення взаємозв'язку відповідних нейромедіаторів із ожирінням, спричиненим HFD, було проведено багатоваріантний аналіз, аналіз основних компонентів (PCA), який може досліджувати взаємозв'язок множинних метаболітів або мРНК без нагляду (Xia та Wishart, 2011). з рівнями нейромедіаторів. PCA з рівнем нейромедіаторів у плазмі виявив, що ожирілих мишей (миші, що харчуються HFD, заповнені кола) можна відрізнити від худих (нормальних мишей, що харчуються дієтою, порожнисті кола) вздовж осі головного компонента 2 (PC2) (рис. 3 Г). Як показано на завантаженнях PC2 (рис. 3 E), рівні дофаміну та серотоніну сприяють відділенню ожирених мишей від худих протилежними способами. Позитивне навантаження дофаміну та негативне серотоніну свідчать про те, що дофамін може позитивно пов’язаний із ожирінням, тоді як серотонін негативно корелює.
У цьому дослідженні ми продемонстрували, що рівень серотоніну в крові був значно нижчим у людей, що страждають ожирінням, спричиненим HFD, ніж у худих. Загальновідомо, що дефіцит серотоніну пов'язаний з початком та розвитком депресії (Jans et al., 2007), що вказує на те, що дефіцит серотоніну у мишей із ожирінням може пояснити депресивні настрої, пов'язані з ожирінням. Дійсно, Kimbrough and Weekley (1984) вже продемонстрували, що HFD знижує рівень серотоніну в стовбурі мозку у щурів SD. Ми нещодавно виявили, що рівень циркулюючого серотоніну також може бути знижений через ожиріння. Однак рівні серотоніну в плазмі можуть бути кращим сурогатним біомаркером для зміни настрою при ожирінні, ніж рівні серотоніну в мозку з точки зору доступності тканин.
Ми також можемо виявити, що можуть існувати кореляційні зв’язки між рівнем нейромедіаторів моноаміну в крові окремих тварин. Аналіз основних компонентів показав, що рівень дофаміну в крові, а також серотоніну суттєво корелювали із ступенем ожиріння. На відміну від взаємозв'язку між серотоніном та ожирінням, взаємозв'язок між дофаміном та ожирінням було важко інтерпретувати. У пацієнтів з депресією дофамін, як правило, регулюється зниженням (Klimek et al., 2002), що припускає, що вищий рівень дофаміну у депресивних мишей із ожирінням не можна пояснити тенденцією до депресії. Дофамін бере участь у системі винагороди мозку, викликаючи почуття насолоди та підкріплення, щоб спонукати людину виконувати чи повторювати певні дії (Wang et al., 2002). Отже, порушення регуляції дофамінергічного шляху зазвичай бере участь у поведінці, що викликає звикання, такі як запої, їжа, зловживання наркотиками. Нещодавно було продемонстровано, що щури, що страждають ожирінням, мають нерегульовані рецептори дофаміну D2, що викликає неконтрольоване та компульсивне поведінку годування до смачних, багатих жирами дієт (Johnson and Kenny, 2010). У зв’язку з цим збільшення дофаміну у мишей із ожирінням може бути пов’язане з порушенням регульованої дофамінергічної передачі сигналів та тягою до HFD (Corwin et al., 2011), хоча для його підтвердження необхідні подальші дослідження.
На закінчення ми нещодавно виявили, що рівні серотоніну в плазмі крові знижувались через ожиріння, спричинене HFD, і рівень дофаміну також може бути пов’язаний. Ці результати підтверджують, що ожиріння може глибоко вплинути на настрій через зміни рівня нейромедіаторів. Крім того, нейромедіатори плазми можуть бути використані для оцінки пов'язаних із ожирінням змін настрою.
- Періодична гіпоксія та дієта, спричинені ожирінням, впливають на окисний статус, симпатичний тонус, плазму
- Високий рівень тригліцеридів після їжі - це ожиріння - хороший провісник
- Модель ожиріння з високим вмістом жиру, обумовлена дієтою Меліор Діскавері
- Зв’язок між ожирінням та захворюваннями ясен Лікування одного може вплинути на інше - ScienceDaily
- Мельдоній знижує підвищений у раціоні рівень триметиламіну N-оксиду, метаболіту