Вплив однотижневої збалансованої дієти на експресію генів, пов’язаних із метаболізмом та запаленням цинку, у хворих на цукровий діабет 2 типу
Люсія Лейте Лайс
1 кафедра харчування, Федеральний університет Ріо-Гранді-ду-Норте, Натал 59084-100, Бразилія.
Санча Хелена де Ліма Вале
1 кафедра харчування, Федеральний університет Ріо-Гранді-ду-Норте, Натал 59084-100, Бразилія.
Каміла Алвес Ксав'єр
2 Кафедра харчування, Університет Потігуар, Натал 59056-000, Бразилія.
Альфредо де Араухо Сільва
3 Університетська лікарня Лауро Вандерлі, Федеральний університет Парайби, Жоао Пессоа 58051-900, Бразилія.
Толунай Бекер Айдемір
4 Відділ харчових наук та харчування людини, Університет Флориди, Гейнсвілль 32611, США.
Роберт Дж. Казінс
4 Відділ харчових наук та харчування людини, Університет Флориди, Гейнсвілль 32611, США.
Анотація
Вступ
Запалення, окислювальний стрес та порушення гомеостазу цинку можуть відігравати ключову роль у патогенезі та прогресуванні цукрового діабету 2 типу (T2DM) [1,2]. Низький статус цинку пов’язаний із зниженням чутливості до інсуліну, порушенням утилізації глюкози, запаленням та окислювальними пошкодженнями [3]. Незважаючи на добре встановлену взаємозв'язок між транспортером цинку 8 (ZnT8) та діабетом, надійного діагностичного інструменту для доступу до статусу цинку все ще бракує [4]. Недавно були вивчені металотіоїн (МТ) і транспортери цинку (ZnT) як можливі біомаркери, що стосуються стану цинку в організмі [5]. Тим не менше, розуміння взаємозв'язку між ZnT і T2DM обмежене, і вплив дієти на гени, пов'язані із запаленням та окислювальним стресом у T2DM, все ще недостатньо вивчений. Більше того, харчування є, мабуть, найважливішим фактором навколишнього середовища, який здатний модулювати експресію генів, що беруть участь у метаболічних шляхах, пов’язаних з T2DM [6], і це підкреслює важливість правильного харчування як дієтотерапії. Таким чином, це дослідження було спрямоване на оцінку впливу однотижневої збалансованої дієти на метаболічний контроль та експресію ZnT у мононуклеарних клітинах периферичної крові від пацієнтів з T2DM.
Матеріали і методи
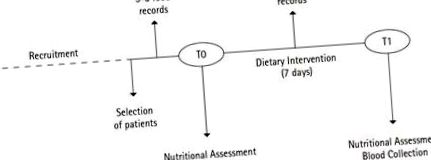
Учасники та дизайн дослідження
Прийом їжі
Інформація про споживання їжі була отримана за допомогою записів про їжу за 3 послідовні дні (2 будні та 1 день вихідних). Пацієнти отримали три цілодобові бланки записів про їжу, щоб якомога точніше записати всі спожиті продукти та напої. За рекомендацією Томпсона та Байєрса [7], навчені дієтологи проінструктували пацієнтів, як правильно фіксувати споживання їжі, включаючи інформацію про час, опис їжі та кількість з'їденого. Побутові міри харчових продуктів перед аналізом перетворювались у грами або масштаби. Споживання енергії, білків, жирів, вуглеводів, загальної кількості клітковини, кальцію, заліза та цинку розраховували за допомогою програмного забезпечення AVANUTRI Revolution® (Avanutri, Ріо-де-Жанейро, Бразилія). Харчові продукти, не включені до програмного забезпечення, були включені для аналізу на основі таблиці бразильського складу продуктів харчування [8] або на основі поживної інформації, що міститься на етикетках продуктів харчування.
Оцінка поживності
Оцінка стану харчування базувалася на індексі маси тіла (ІМТ) та відсотку жирової маси (% FM), розрахованому за допомогою біоімпедансу (RJL Systems, Клінтон, штат Мічиган, США), відповідно до рекомендацій літератури [9,10].
Дієтичне втручання
Індивідуальний план харчування базувався на рекомендаціях Американської діабетичної асоціації [11] та Бразильського діабетичного товариства [12]. Нормокалорійна дієта (25-30 ккал/кг/день) для підтримання ваги, що містить 20% енергії як білка, 20% як жиру, з низьким рівнем насичених жирних кислот (SFA) і 60% як вуглеводів з високим вмістом клітковини. передбачено для Т1. Дієта включала вуглеводи з фруктів, овочів, цільного зерна, бобових, клітковинні продукти та молоко з низьким вмістом жиру. Трансжир був зведений до мінімуму. Цукор замінили неживним підсолоджувачем. Червоне м’ясо пропонувалося лише два рази на тиждень, а також три порції риби на тиждень. Оливкова олія екстра-віджиму включалася щодня в якості заправки для салатів. Ми запропонували схему дієти, яка є повністю доступною та реалістичною. Дієта була передбачена, а не тільки призначена, з усуненням можливих упереджень. Їжа та їжа доставлялися до будинків пацієнтів через день.
Збір та обробка зразків
Статистичний аналіз
Результати відображаються як середнє значення ± SD. Для аналізу нормальності даних використовували тест Шапіро-Вілка. Для порівняння середніх значень між T0 і T1 (спарені дані) (таблиця 1 та рисунок 2) ми використовували тест t Стьюдента або тест Wilcoxon відповідно до розподілу даних. Тест кореляції Пірсона або Спірмена був використаний для аналізу зв'язку між кожною парою досліджуваної експресії генів (табл. 2), залежно від того, розподілялись дані нормально чи ні. Крім того, для порівняння відмінностей між двома незалежними групами (наприклад, здорові суб'єкти проти Т0) (рис. 2), які зазвичай не розподіляються, ми використовували тест Мана-Уітні. Статистичний аналіз проводили із використанням Graph Pad-Prism v.6.0a, і зміни вважалися суттєвими, якщо p ≤ 0,05.
ZnT: транспортери цинку (ZnT1-10 та ZIP1-14), NS: незначущі, TNFα: фактор некрозу пухлини α, IL6: інтерлейкін 6, MT1: металотіонін 1.
* p ≤ 0,05; † p Таблиця 1). Ожиріння та прозапальні цитокіни, включаючи TNFα та IL6, можуть посилити резистентність до інсуліну та погіршити гомеостаз глюкози [13]. Вищі рівні TNFα та IL6 у плазмі крові, виявлені у хворих на цукровий діабет, виявляють типовий запальний профіль цих пацієнтів. Відповідно до наших результатів, більш високий рівень TNFα був виявлений у жінок у постменопаузі [14], а також у пацієнтів з діабетом чоловічої та жіночої статі [15].
Після збалансованої дієти для хворих на цукровий діабет (Т1) рівні TNFα та IL6 у плазмі мали тенденцію до зниження, але різниця не була значною (табл. 1). Однотижневе втручання могло бути занадто коротким, щоб виявити суттєві зміни цих параметрів. Навпаки, FPG у хворих на цукровий діабет значно зменшився при Т1. Однак у наших хворих на цукровий діабет змін ваги не спостерігалося (табл. 1), що наголошувало на важливості складу дієти, а не лише на обмеженні калорійності глікемічного контролю хворих на цукровий діабет [16].
У учасників усіх груп концентрація SZn перевищувала рекомендовану нижчу граничну величину для низького статусу цинку (Таблиця 1). Дослідження показали як зниження [1,17], так і підвищення [18,19] рівня SZn у хворих на цукровий діабет. Загалом зниження SZn є загальним явищем у T2DM через гіперцинкурію, тоді як збільшення SZn частіше спостерігається при цукровому діабеті 1 типу через руйнування β-клітин підшлункової залози з виділенням цинку [20]. Крім того, концентрації SZn можуть залежати від віку діабету [2] та тривалості діабету: рівень SZn знижується із збільшенням тривалості діабету [20]. SZn не є надійним біомаркером для оцінки стану цинку в організмі [21]. Оскільки в цьому дослідженні пацієнти з діабетом мають нормальний вміст SZn, підвищені медіатори запалення, можливо, не були на рівні, необхідному для індукування гіпоцінкемії [22,23]. Порівнюючи збалансовану дієту (Т1) із звичайною дієтою (Т0) у хворих на цукровий діабет, були значні відмінності в загальному вмісті жиру та СФА, а також значне збільшення споживання вуглеводів, клітковини, кальцію та заліза (табл. 1).
Експресія транспортерів цинку в PBMC
Пацієнти з T2DM демонстрували нижчу експресію мРНК ZnT4 та вищу мРНК IL6 у порівнянні зі здоровими суб'єктами (рис.2). Порівнюючи T0 і T1, ми спостерігали знижену регуляцію мРНК TNFα, IL6 та MT1 у відповідь на збалансоване втручання у дієту (рис.2). Тим не менше, мРНК ZnT4 в цьому дослідженні не відрізнялася між Т0 і Т1. Варто зазначити, Noh et al. [24] виявив знижену регуляцію експресії мРНК ZnT4 у жінок із ожирінням з високим рівнем TNFα у плазмі крові. Як білок-експортер цинку, зменшення експресії мРНК ZnT4 у діабетиків порівняно зі здоровими людьми може вплинути на запалення, збільшуючи утримання внутрішньоклітинного цинку.
Дослідження виснаження та переповнення цинку продемонструвало модульовану експресію ZnT та генів запалення у клітинах крові у дев'яти здорових чоловіків [5]. І навпаки, 12-тижневе дослідження не показало жодної суттєвої різниці у експресії ZnT і МТ після прийому цинку та/або α-ліноленової кислоти [14]. У нашому дослідженні експресія ZnTs не змінилася у відповідь на втручання однотижневої збалансованої дієти (рис. 2). Однак зниження регуляції TNFα, IL6 та MT1 спостерігали при Т1 у відповідь на дієту без зміни медичної терапії або рівня фізичної активності. Наші висновки узгоджуються з дослідженнями, які повідомляють, що вибір здорової їжі покращує метаболізм глюкози та зменшує запалення, тим самим пригнічуючи експресію прозапальних генів [25,26]. Крім того, враховуючи, що МТ є окисно-відновним білком і індукується під час запалення, знижена регуляція мРНК МТ1, виявлена при Т1, вказує на зменшення окисного стресу [27].
У таблиці 2 було виявлено діапазон двовимірних кореляційних зв'язків у стенограмах з PBMC. Попередні дослідження виявили позитивні асоціації між мРНК ZnTs у здорових молодих людей (ZnT1 проти ZnT5 та ZnT1 проти Zip3) [26], а також у жінок з діабетом із T2DM після (Zip3 проти Zip5) або без добавок цинку (ZnT6 проти Zip7 ) [14]. За погодженням з Фостером та ін. [28], ми спостерігали найбільшу асоціацію серед мРНК ZnT1, Zip3 та ZnT5. Експресія цього кластеру ZnTs поводилася подібним чином у пацієнтів з T2DM. Крім того, мРНК TNFα була високо асоційована із транскриптами ZnT1 та MT1, тоді як мРНК IL6 мала сильну кореляцію із Zip8 та Zip14. Цей висновок узгоджується із задокументованою регуляцією цих генів транспондерів прозапальними цитокінами [21]. Примітно, що всі позитивні асоціації, що включають мРНК МТ1, були виявлені лише при Т1, що означає, що експресія МТ1 чутлива до рівня глікемії (рис.2).
Висновки
Збалансована дієта, передбачена протягом одного тижня, змогла покращити метаболічний контроль у пацієнтів із СД2 за рахунок зниження ФПГ. Цей метаболічний контроль може бути пов'язаний зі зниженою регуляцією транскриптів, пов'язаних з цинком, з PBMC, як зміни мРНК TNFα, IL6 та MT1. Дієтичне втручання не змогло забезпечити значних змін у мРНК ZnTs від PBMC у цьому дослідженні.
Обмеження цього дослідження включають невеликий обсяг вибірки та короткий період дослідження. Потрібні додаткові дослідження, щоб краще зрозуміти вплив дієти на ZnT та її вплив на метаболічні та запальні шляхи у дорослих з Т2ДМ.
Подяки
Ця робота була частково підтримана Національною радою з наукового та технологічного розвитку (CNPq), грантом № 472832/2011-5 (для LLL) та грантом NIH R01 94244 від Національного інституту діабету та хвороб органів травлення та нирок (до RJC).
Виноски
Конфлікт інтересів: Автори заявляють, що у них немає конкуруючих інтересів.
Внески авторів: Внесок кожного автора: LLL, SHLV, CAX та AAS брали участь у розробці даних дослідження та збору даних. LLL, TBA та RJC брали участь в аналізі та інтерпретації даних; LLL та RJC написали рукопис. Усі автори прочитали та затвердили остаточний рукопис.
- Підрахунок калорій та збалансоване харчування - манекени
- Годуйте коня збалансованим харчуванням - практичні рекомендації для англійських вершників
- Чи їдять гуппі водорості Посібник із збалансованої дієти гуппі; Танк Mate
- Корм для собак - збалансована дієта для собак VetBabble
- Харчування збалансованої дієти Матсун Харчування Рідкі добавки Контрактне виробництво