Вплив лимонної кислоти на окислювальний стрес на мозок та печінку у мишей, оброблених ліпополісахаридами
Омар М. Е. Абдель-Салам
1 Відділ токсикології та наркотиків, Національний дослідницький центр, Каїр, Єгипет
Еман Р. Юнесс
2 Кафедра медичної біохімії, Національний дослідницький центр, Каїр, Єгипет
Надія А. Мухаммед
2 Кафедра медичної біохімії, Національний дослідницький центр, Каїр, Єгипет
Сафаа М. Юсеф Морсі
2 Кафедра медичної біохімії, Національний дослідницький центр, Каїр, Єгипет
Енайат А. Омара
3 Кафедра патології, Національний дослідницький центр, Каїр, Єгипет
Амані А. Слім
4 Кафедра фармакології, Національний дослідницький центр, Каїр, Єгипет
Анотація
Вступ
Лимонна кислота (2-гідрокси-1,2,3-пропан-трикарбонова кислота) - це слабка органічна кислота, що міститься у найбільшій кількості в цитрусових, таких як лимон, грейпфрут, мандарин та апельсин. Лимонний і лаймовий соки - багаті джерела. 9 Він використовується як природний консервант, а також для додавання кислого (кислого) смаку їжі та безалкогольних напоїв. 10 Будучи компонентом трикарбонової кислоти або циклу Кребса, лимонна кислота міститься у всіх тканинах тварин як проміжна речовина в окисному метаболізмі. Дослідження показали, що цитрат зменшує перекисне окислення ліпідів і знижує регуляцію запалення за рахунок зменшення дегрануляції поліморфно-ядерних клітин і послаблення вивільнення мієлопероксидази, еластази, інтерлейкіну (IL) -1β і тромбоцитарного фактора 4. 11-13 In vitro цитрат покращує функцію ендотелію за рахунок зменшення запалення маркери та зменшення діапедезу нейтрофілів при гіперглікемії. 14 Більше того, було показано, що лимонна кислота зменшує гепатоцелюлярні ушкодження, викликані у щурів тетрахлоридом вуглецю. 15 Лимонна кислота може таким чином довести свою цінність у зменшенні окисного стресу.
Таким чином, з огляду на антиоксидантну та протизапальну дію цитрату, про яку повідомляється зараз, і оскільки цитратна антикоагуляція застосовується у важких хворих, доцільним було вивчити вплив введення лимонної кислоти на окислювальний стрес та пошкодження тканин на моделі системних запальних захворювань, спричинених внутрішньоочеревинним (ip) ліпополісахаридом (LPS) введенням мишам. LPS є складовою клітинних стінок грамнегативних бактерій. При системному введенні LPS сильно стимулює імунні клітини на периферії (через білки плазматичної мембрани, наприклад, так званий рецептор 4 [TLR4] і CD14), щоб виділити прозапальні цитокіни, такі як фактор некрозу-альфа (TNF-α), IL -1β, а IL-6 на периферії та мозку. Це призводить до розвитку системного та нейрозапалення. Індукована LPS 16–19 ендотоксемія є добре встановленою моделлю зараження грамнегативними бактеріями і широко використовується для вивчення впливу ендотоксинів на периферичну тканину/органи та впливу системного запалення на мозок.
Матеріали і методи
Тварини
Використовували швейцарських мишей-самців-альбіносів вагою 22–25 г (віком 5–6 тижнів). Мишей отримували з колонії домашніх тварин Національного дослідницького центру. Стандартні лабораторні продукти харчування та вода надавались за бажанням. Процедури на тваринах проводили відповідно до Комітету з етики Національного дослідницького центру та дотримувались рекомендацій Національного керівництва інститутів охорони здоров’я щодо догляду та використання лабораторних тварин (Публікація № 85-23, переглянута 1985 р.).
Наркотики та хімікати
Використовували очищений, ліофілізований ендотоксин кишкової палички (серотип 055: В5; Sigma); його розчиняли у стерильному фізіологічному розчині, розподіляли аликвотами та заморожували при -20 ° C. Для всіх експериментів використовували одні й ті ж розчини запасів. Лимонна кислота та всі інші хімічні речовини були аналітичного класу і отримувались від Sigma. Доза LPS (200 мкг/кг) та час відбору проб тканини базувалися на попередніх дослідженнях. 20
Вивчати дизайн
Мишей випадковим чином розділили на п'ять рівних груп (по шість мишей у кожній). Мишей обробляли або 0,2 мл: стерильного фізіологічного розчину (група 1), або лимонної кислоти в дозах 1, 2 та 4 г/кг, перорально (групи 2–4). Лікування проводили безпосередньо перед введенням ендотоксину (LPS: 200 lg/kg, вводили внутрішньочеревно, 0,1 мл). П’ята група отримала лише транспортний засіб, без LPS (негативний контроль). Мишей евтаназували через 4 год LPS або ін’єкції носія шляхом декапітації під ефірною анестезією, де мозок і печінку кожної миші видаляли, промивали крижаним сольовим розчином, забуференним фосфатом (PBS; pH 7,4), зважували і зберігали при -80 ° C до біохімічного аналізу. Тканини гомогенізували 0,1 М PBS при рН 7,4, отримуючи кінцеву концентрацію 0,1 г/мл для біохімічних аналізів. У тканинах мозку та печінки визначали знижену активність GSH, малонового діальдегіду (MDA), оксиду азоту (нітрити), GPx та параоксонази 1 (PON1). ФНО-α вимірювали в тканині мозку. У тканині печінки вимірювали аланінамінотрансферазу (АЛТ), аспартатамінотрансферазу (АСТ) та фрагментацію ДНК.
Визначення перекисного окислення ліпідів, зниженого рівня GSH та рівня нітритів
Перекисне окислення ліпідів аналізували шляхом вимірювання рівня MDA в тканині мозку за допомогою методу Ruiz-Larrea та співавт. 21 Знижений GSH визначали в тканині методом Еллмана. 22 Оксид азоту, виміряний як нітрит, визначали за допомогою реагенту Гріса за методом Мошаге та співавт. 23
Визначення активності GPx
Активність GPx у супернатантах визначали спектрофотометрично при 340 нм аналізом окиснення NADPH за допомогою набору глутатіонпероксидази (Biodiagnostics). 24 Одна одиниця активності GPx визначається як кількість білка, який окислюється 1 мМ NADPH за хвилину. Активність GPx виражається як мО/мл.
Визначення активності параоксонази
Активність арилестерази параоксонази вимірювали спектрофотометрично у супернатантах, використовуючи в якості субстрату фенілацетат. 25,26 У цьому аналізі арилестераза/параоксоназа каталізує розщеплення фенілацетату, що призводить до утворення фенолу. Швидкість утворення фенолу вимірюється шляхом відстеження збільшення поглинання при 270 нм при 25 ° С. Робочий реагент складався з 20 мМ трис/HCl буфера (рН 8,0), що містив 1 мМ хлориду кальцію та 4 мМ фенілацетату в якості субстрату. Додають зразки, розведені в буфері 1: 3, і реєструють зміну поглинання через 20 секунд затримки. Поглинання при 270 нм приймали кожні 15 с протягом 120 с, використовуючи спектрофотометр, що реєструє УФ-Vis (Корпорація Shimadzu). Одна одиниця активності арилестерази дорівнює 1 мкМ фенолу, що утворюється за хвилину. Активність виражається в кО/л, виходячи з коефіцієнта екстинкції фенолу 1310 М/см при 270 нм, рН 8,0 та 25 ° С. Пусті зразки, що містять воду, використовуються для корекції спонтанного гідролізу фенілацетату.
Визначення TNF-α, фрагментація ДНК та ферменти печінки
TNF-α тканини визначали в тканині мозку згідно з Chen et al. 27 за допомогою імуноферментного аналізу з використанням наборів TNF-α (Biosource International) та зчитувача мікропланшетів (Fisher Biotech). Кількісне визначення фрагментації ДНК в тканині печінки проводили за методикою, описаною Герсел-Тейлором. 28 Активність ALT та AST у печінці вимірювали за допомогою комерційно доступних наборів (BioMérieux). 29,30
Гістологічна оцінка ураження печінки
Печінку у кожної миші швидко видаляли і фіксували у свіжоприготовленому 10% нейтральному буферизованому формаліні, регулярно обробляли і вкладали у парафін. Зрізи товщиною 5 мкм вирізали та фарбували гематоксиліном та еозином (H&E) для гістопатологічного дослідження. Всі зрізи досліджували за допомогою світлового мікроскопа.
Імуногістохімія для каспази-3 та індуцибельної синтази оксиду азоту
Зрізи печінки, вкладені в парафін, депарафінізували та гідратували. Імуногістохімію проводили за допомогою моноклональної каспази-3 миші та індуцибельної синтази оксиду азоту (iNOS) для виявлення розщеплення каспази та активності iNOS. Парафінові зрізи нагрівали в мікрохвильовій печі (25 хв при 720 Вт) для отримання антигену та інкубували з антикаспазою або антитілами iNOS (розведення 1:50) протягом ночі при 4 ° С. Після промивання PBS з подальшою інкубацією з вторинними антитілами біотинільованих козла проти кролика-імуноглобуліну G (розведення 1: 200; Dako Corp.) та комплексом стрептавідин/лужна фосфатаза (розведення 1: 200; Dako) протягом 30 хв при кімнатній температурі, сайти зв'язування антитіл візуалізували за допомогою DAB (Sigma). Після промивання PBS зразки фарбували H&E протягом 2–3 хв і зневоднювали, переносячи їх через збільшені розчини етанолу (30%, 50%, 70%, 80%, 95% та 100% етанолу). Після зневоднення зрізи двічі замочували в ксилоні при кімнатній температурі протягом 5 хв, монтували, досліджували та оцінювали за допомогою потужного світлового мікроскопа. 31
Статистичний аналіз
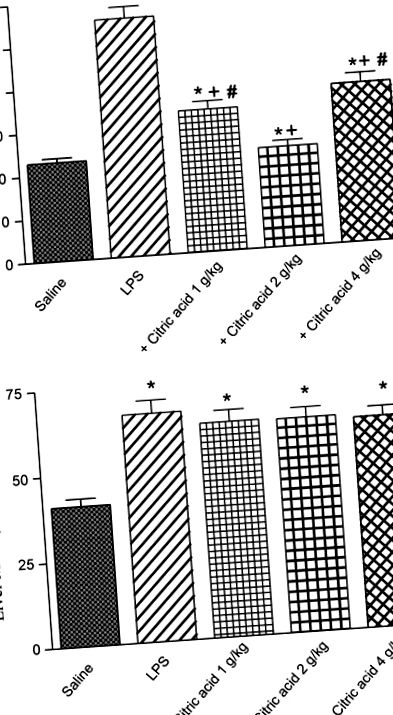
Навпаки, ніякого значного впливу на MDA печінки не спостерігалося після обробки лимонною кислотою (1–4 г/кг; рис. 1В).
Знижений GSH
Після виклику ЛПС рівень GSH знизився в тканинах головного мозку та печінки на 72,1% (1,21 ± 0,07 проти 4,1 ± 0,28 мкмоль/г тканини) та 46,9% (4,16 ± 0,29 проти 7,83 ± 0,36 мкмоль/г тканини) відповідно. . Лікування лимонною кислотою (1–4 г/кг) не мало суттєвого впливу на ГСГ головного мозку або печінки (рис. 2А, В).
У печінці нітрит суттєво зменшився на 17% за допомогою лимонної кислоти, даної при 1 г/кг, порівняно з контрольною групою LPS. Однак вищі дози лимонної кислоти не змогли суттєво змінити нітрит у тканині печінки (рис. 3Б).
Активність GPx
Активність глутатіонпероксидази (GPx) у (A) мозок і (B) печінка мишей після LPS або LPS + лимонна кислота (1–4 г/кг, р.о.). * P + P # P Рис. 5A, B). Активність PON1 мозку зросла на 44,9% після обробки лимонною кислотою при дозі 1 г/кг. Однак більш високі дози не змогли суттєво змінити активність PON1 (рис. 5А). З іншого боку, активність PON1 печінки значно знизилась на 19,7% та 36,6% після обробки лимонною кислотою відповідно 2 та 4 г/кг, порівняно з контрольною групою LPS (рис. 5B).
Зрізи печінки мишей, оброблених гематоксиліном та еозином (H&E) (A) сольовий розчин (контроль). (B) LPS: запальна лейкоцитарна інфільтрація навколо порталу (довга стрілка), некроз (головка стрілки), розширені та перевантажені синусоїди крові та маринований ядерний хроматин (зірка). (C) LPS: фокальна некротична область (головка стрілки), активовані клітини Купфера, розширені та перевантажені синусоїди крові та пікнотичні ядра (зірка). (D) LPS + лимонна кислота 1 г/кг: застій центральної вени (довга стрілка), розширені синусоїди крові та незначна кількість некротичних клітин (стрілка). (E) LPS + лимонна кислота 2 г/кг: нормальна центральна вена (довга стрілка), мінімально розширені синусоїди крові та мало клітин Купфера. (F) LPS + 4 г/кг лимонної кислоти: застій центральної вени (довга стрілка), ознаки дегенерації гепатоцитів, розширені перевантажені синусоїди крові та небагато клітин Купфера (H & E × 400). Кольорові зображення доступні в Інтернеті за адресою www.liebertpub.com/jmf
Гістологічне дослідження печінки у мишей, які отримували ЛПС, виявило інфільтрацію мононуклеарних клітин, проліферацію жовчних проток у перипортальних ділянках та мінімальне збільшення в перипортальних ділянках. У групі LPS ми також спостерігали розширення та застій центральної вени та синусоїдів крові, що показало численні клітини Купфера. Гепатоцити виявляли некротичні зміни у вигляді невеликих пікнотичних ядер із конденсованим або маргінованим хроматином, відсутністю ядерців та сильно ацидофільною цитоплазмою (рис. 9Б, С).
З іншого боку, гістологічне дослідження зрізів печінки у мишей, які отримували ЛПС + лимонна кислота в дозі 1 г/кг, показало майже нормальну печінкову архітектуру. Печінкові часточки з’явилися з видною центральною веною з меншою синусоїдальною дилатацією та зменшенням кількості клітин Купфера в порівнянні з групою, яка отримувала лише ЛПС (рис. 9D).
Поліпшення гістологічного вигляду було більш вираженим після обробки лимонною кислотою при 2 г/кг, що свідчить про нормальний вигляд часточок печінки штамами гепатоцитів порівняно з перерізом груп ЛПС (рис. 9Е).
На відміну від цього, зрізи мишей, оброблених ЛПС та 4 г/кг лимонної кислоти, продемонстрували незначне поліпшення при розширенні портальних ділянок. Гепатоцити демонстрували певний ступінь гістологічної регенерації з меншою синусоїдальною дилатацією та зі зменшенням кількості клітин Купфера та менше некротичних клітин (рис. 9F).
Імунореактивність каспази-3 та iNOS
Позначення активованої каспази-3 було специфічним для виділення морфологічно апоптотичних клітин. Експресія каспази-3 та iNOS була локалізована в цитоплазмі гепатоцитів. У печінці мишей, оброблених носієм, спостерігалася незначна імунопозитивність до каспази-3 (рис. 10А-і) та iNOS (рис. 10А-іі). Після обробки LPS спостерігалася сильна експресія каспази-3 (рис. 10B-i) та iNOS (рис. 10B-ii) порівняно з контрольною групою носія. У цих ділянках імунореактивність каспази-3 та iNOS спостерігалась головним чином навколо центральної вени.
Вплив лікування ЛПС та лимонною кислотою на печінкову каспазу-3 (i) та індуцибельна синтаза оксиду азоту (iNOS) (ii) імунозабарвлення: (A) контроль печінки; (B) LPS; (C) LPS + лимонна кислота 1 г/кг; (D) LPS + лимонна кислота 2 г/кг; (E) лимонна кислота 4 г/кг (каспаза-3 та iNOS імуногістохімія, гематоксиліновий забруднення × 400). Кольорові зображення доступні в Інтернеті за адресою www.liebertpub.com/jmf
Імунопозитивність до каспази-3 та iNOS зменшилась у печінці мишей, інтоксикованих LPS, які отримували 1 г/кг лимонної кислоти (рис. 10С) та 2 г/кг лимонної кислоти (рис. 10D), відповідно. На відміну від цього, лимонна кислота у високій дозі 4 г/кг не була ефективною для зменшення експресії каспази-3 (рис. 10E-i) та експресії iNOS (рис. 10E-ii).
Обговорення
Зі збільшенням кількості вільних радикалів та активних форм кисню клітини оснащені низкою антиоксидантних механізмів, таких як каталази, GPx, глутатіонтрансфераза, супероксиддисмутаза та GSH. 3 Введення ЛПС було пов’язане із збільшенням перекисного окислення ліпідів та падінням рівня GSH та активності GPx у тканинах мозку та печінки, що свідчить про збільшення вироблення вільних радикалів. У мишей, які лікувались LPS, GSH головного мозку та печінки не змінювався лимонною кислотою. Тим часом лікування лимонною кислотою в дозі 1 г/кг асоціювалось із збільшенням активності GPx у тканинах мозку та печінки, можливо, через антиоксидантну дію лимонної кислоти. У поточному дослідженні зниження активності PON1 мозку та печінки спостерігалося після введення LPS. Фермент PON1, який відіграє важливу роль у метаболізмі багатьох сполук ксенобіотиків, нещодавно звернув увагу на можливу роль у захисті клітинних мембран від перекисного окислення ліпідів. 25,26 У тканинах головного мозку активність PON1 покращувалась за допомогою лимонної кислоти, що вводилася в дозі 1 г/кг. Однак активність PON1 у тканині печінки знижується після вищих доз лимонної кислоти, що, можливо, відображає споживання або інактивацію ферменту підвищеними вільними радикалами з високою концентрацією лимонної кислоти.
Одним з потужних прозапальних цитокінів є TNF-α, який виробляється в мозку клітинами глії у відповідь на різні подразники і спонукає астроцити та мікрогліальні клітини виділяти кілька медіаторів запалення, таких як хемокіни, ліпідні медіатори, оксид азоту та інші вільні радикали. Доведено, що TNF-α відіграє важливу роль у опосередкованій нейрозапаленням центральній нервовій системі загибелі клітин у різних нейродегенеративних станах. 37,38 У цьому дослідженні цитокін помітно підвищувався в тканині мозку після введення ЛПС. Тут ми демонструємо, що лікування лимонною кислотою асоціювалось із помітним інгібуючим впливом на вироблення TNF-α у тканині мозку після зараження ЛПС. Ця здатність лимонної кислоти зменшувати патологічну продукцію TNF-α у мозку може мати важливе значення для нейродегенеративних захворювань. Експресія TNF-α, як видається, підвищена в ряді нейродегенеративних розладів, таких як хвороба Альцгеймера, хвороба Паркінсона та аміотрофічний бічний склероз, і фармакологічна маніпуляція TNF-α у мозку пропонується як одна з потенційних цілей при лікуванні цих станів і може представляти цінну мішень для втручання. 39–41
Наведені дані вказують на те, що лимонна кислота може впливати безпосередньо на клітини мозку, інгібуючи їх вироблення TNF-α та нітриту. LPS діє на рецептори TLR4 на макрофагах, дендритних клітинах та інших імунних клітинах для вивільнення прозапальних цитокінів, таких як TNF-α та IL-1β, які можуть отримати прямий доступ до мозку через гематоенцефалічний бар'єр або сигнал до мозку через блукаючий нерв, так звана імунна комунікація кишечник-мозок. 42,43 Таким чином, також можливо, що вплив лимонної кислоти на мозок пояснюється модулюванням вивільнення медіаторів запалення з лейкоцитів на периферії.
Однак слід зазначити, що деякі сприятливі ефекти, що спостерігаються для лимонної кислоти в тканинах мозку та печінки, були лише в діапазоні доз 1–2 г/кг. Цей захисний ефект втрачається при збільшенні дози до 4 г/кг; наприклад, активність GPX та PON1 була збільшена лише з 1 г/кг, а TNF зменшено лише на 1-2 г/кг лимонної кислоти; дози, які були найбільш ефективними в інгібуванні нітриту мозку. Захисні ефекти на печінку також були втрачені з вищою дозою 4 г/кг, що також збільшило фрагментацію ДНК печінки. Оскільки лимонна кислота міститься у всіх тканинах тварин як проміжний продукт у циклі Кребса, не встановлено обмежень щодо прийнятного добового споживання людиною ні кислоти, ні солі. 46 Однак можливо, що при більш високих концентраціях лимонна кислота діє як прооксидант. Деякі антиоксиданти виявляють прооксидантну дію при більших дозах/концентраціях, наприклад, каротиноїди, 47 вітамін Е та вітамін С. 48,49 Природні сполуки також виявляють подвійний ефект на запальні реакції, залежно від їх концентрації: фізіологічні дози, що ведуть до сприятливих наслідків, тоді як високі дози можуть призвести до шкідливих наслідків. 50
Заява про розкриття інформації про автора
Автори заявляють, що не існує конфлікту інтересів.
- Лимонна кислота
- ДЕТОКС І ОКСИДАТИВНИЙ СТРЕС MAAX Життя
- Вплив дієтичних добавок DL-метіоніну на ріст та профіль амінокислот всього тіла
- Вплив канагліфлозину на втрату ваги у мишей, що страждають ожирінням з високим вмістом жиру
- Застосування гамма-аміномасляної кислоти та побічні ефекти добавки ГАМК