Вплив глікозидів вагітних на споживання їжі залежить від стимуляції шляху меланокортину та BDNF на тваринній моделі
Славко Комарницький
† Інститут рослин для здоров'я людини, Науково-дослідний містечко Північної Кароліни, Університет штату Північна Кароліна, 600 Laureate Way, Каннаполіс, Північна Кароліна 28081, США
‡ Департамент харчових продуктів, біообробки та харчових наук, Університет штату Північна Кароліна, 400 Ден Аллен Драйв, Ролі, Північна Кароліна 27695, США
§ Біотехнологічний центр, SEBS, Університет Рутгерса, 59 Dudley Rd, Нью-Брансвік, Нью-Джерсі 08901, США
|| Інститут клітинної біології та генної інженерії, вул. Заболотного, 148, Київ 03680, Україна
Дебора Еспозіто
† Інститут рослин для здоров'я людини, Дослідницький містечко Північної Кароліни, Університет штату Північна Кароліна, 600 Laureate Way, Каннаполіс, Північна Кароліна 28081, США
§ Біотехнологічний центр, SEBS, Університет Рутгерса, 59 Dudley Rd, Нью-Брансвік, Нью-Джерсі 08901, США
Тірумуруганська ратінасабапатія
§ Біотехнологічний центр, SEBS, Університет Рутгерса, 59 Dudley Rd, Нью-Брансвік, Нью-Джерсі 08901, США
Олександр Пулєв
§ Біотехнологічний центр, SEBS, Університет Рутгерса, 59 Dudley Rd, Нью-Брансвік, Нью-Джерсі 08901, США
Ілля Раскін
§ Біотехнологічний центр, SEBS, Університет Рутгерса, 59 Dudley Rd, Нью-Брансвік, Нью-Джерсі 08901, США
Кафедра фармацевтичної хімії, Фармацевтична школа, Міжнародний медичний університет, No 126, Jalan Jalil Perkasa 19, Kukit Jalil, 57000 Куала-Лумпур, Малайзія.
Анотація
Гликозиди вагітних, здається, модулюють споживання їжі, можливо впливаючи на схеми живлення гіпоталамуса; однак механізми регулювання апетиту ефекту глікозидів прегнану залишаються неясними. Тут ми показуємо, що збагачені прегнаном глікозиди екстракти болотних молочаїв Asclepias incarnata при 25–100 мг/кг щоденно послаблюють споживання їжі (до 47,1 ± 8,5% менше, ніж у контрольних груп) і збільшення маси тіла у щурів (10% для самців та 9 % для жінок відповідно) шляхом активації передачі сигналу про меланокортин та гальмування спорожнення шлунка. Основний глікозид прегнанових молочаїв, ікемагенін, здійснював свій регулюючий апетит ефект, знижуючи рівень білка, пов'язаного з готі (в 0,6 рази), але не пептидів ситості NPY. Лікування ікемагеніном також посилювало секрецію нейротропного фактора, отриманого з мозку (BDNF), за рецепторами меланокортину в гіпоталамусі (в 1,4 рази) та в культурі клітин гліоми щурів C6 in vitro (до 6 разів). Ці результати підтверджують мультимодальний вплив глікозидів прегнану на регуляцію харчування, що залежить від активності сигнального шляху меланокортину та BDNF.
ВСТУП
Молочаї - рясне джерело глікозидів прегнану. 8 Повільно зростаючі сукуленти молочаю Hoodia gordonii та Caralluma fimbriata використовуються в традиційній медицині як природні засоби, що пригнічують апетит. 9,10 P57AS3 прегнановий глікозид - це єдина активна складова, повідомляється від Hoodia, яка діє як пригнічувач апетиту11, можливо, збільшуючи вміст АТФ у нейронах гіпоталамусу. 12 В одному подвійному сліпому, плацебо-контрольованому дослідженні, в якому 50 здорових добровольців отримували 1 г екстракту Караллума на день протягом 60 днів, обхват талії та голод продемонстрували значне зниження в експериментальній групі порівняно з плацебо через 2 місяці лікування . 10 Обмежений природний ареал та повільний ріст цих соковитих рослин значно обмежили їх доступність для досліджень та терапевтичного застосування.
Види молочаю Асклепії пристосовані до широкого кола середовищ майже у всіх штатах США і відомі бурхливим зростанням, що дозволяє їх успішно заснувати як альтернативну культуру для виробництва клітковини, латексу, ниткової нитки та олій. 13 Молоді пагони, стебла, квіткові бруньки, недозрілі плоди та коріння болотного молочаю (Asclepias incarnata L.) варили і їли як овоч різні корінні групи східної та середньої Західної Америки. 14 У зв’язку з дослідженням фітохімічних складових болотних молочаїв Варашина виділив природну бібліотеку глікозидів прегнану, аналогічну тим, що містяться у Худії. 15,16 Така різноманітність забезпечує унікальне і рясне джерело глікозидів прегнану для дослідження їх фізіологічних та фармакологічних ефектів.
Щоб розглянути потенціал глікозидів прегнану для зменшення споживання їжі та виявлення їх клітинних та молекулярних цілей, це дослідження оцінило здатність пригнічувати апетит екстракту збагаченого прегнаном глікозиду з болотних коренів молочаю (інкарнатин) та його основного складу прегнанового глікозиду, 12β- циннамоїл-3,8,12,14β-тетрагідроксипрегн-5-ен-20-он глікозид (ікемагенін).
МАТЕРІАЛИ І МЕТОДИ
Хімікати
Розчинники, використані в цьому дослідженні, були високоефективної рідинної хроматографії (ВЕРХ); всі інші хімічні речовини були аналітичного класу та купувались у Sigma-Aldrich (Сент-Луїс, Міссурі), якщо не зазначено інше.
Джерело рослини, вилучення та ідентифікація сполук
Рослини A. incarnata (болотний молочай) вирощували з насіння гідропонічно протягом 4 місяців та збирали. Висушений ліофілізований порошок кореня (100 г) знежирювали гексаном (3 × 100 мл) на шейкері при кімнатній температурі протягом 8 годин. Органічні шари викидали, а гранули звільняли від залишків розчинника у витяжній шафі на ніч. Потім залишковий знежирений матеріал екстрагували метанолом (2 × 150 мл) на шейкері протягом 8 годин при кімнатній температурі. Потім супернатант випаровували при зниженому тиску і ліофілізували, отримуючи сирий екстракт кореня молочаю, позначений як інкарнатин (8 г). Інкарнатин містив 30% (мас.: Мас.) Загальних глікозидів прегнану, як оцінювали за допомогою колориметричного аналізу на основі ксантидролу 17, і відсутність серцевих глікозидів, що підтверджено негативною реакцією Кедде. 18 Хроматографічне розділення інкарнатину на три підфракційні пули високої (A), середньої (B) та низької (C) полярності проводили на підготовчій шкалі ВЕРХ із використанням колони зворотної фази Phenomenex Luna C-8, розмір 150 мм × 2 мм, частинка розміром 3 мкм, оснащений попередньою колонкою Phenomenex SecurityGuard. Рухлива фаза складалася з двох компонентів - розчинника А (0,5% оцтової кислоти в деіонізованій воді, рН 3–3,5) та розчинника В (100% ацетонітрилу) і працювала в градієнтному режимі.
Годування натщесерце
Три групи щурів (n = 6), що голодували протягом 24 годин, отримували одну дозу контрольного розчину per os (10% ДМСО в кукурудзяній олії) або 50 та 100 мг/кг інкарнатину, суспендованого в загальному обсязі 2 мл контрольного розчину при початок циклу годівлі (вимкнене світло, 1400 год), після чого тварини отримували їжу та воду за бажанням. Споживання їжі вимірювали через 3, 6 та 24 год після обробки сонометра та коригували на розсип (день 1). Шлунки та вміст шлунку збирали та реєстрували через 3 години після проведення дачі відповідною дозою екстракту інкарнатину на 2 день експерименту.
Спорожнення шлунка та кишковий транзит
Три групи щурів (n = 6), що голодували протягом 4 год, отримували разову дозу контрольного розчину (10% ДМСО в кукурудзяній олії) або 50 та 100 мг/кг інкарнатину, суспендованого в загальному обсязі 2 мл контрольного розчину при початок циклу годування (світиться, 1400 год). Спорожнення шлунка визначали модифікацією методу фенолового червоного. 19 Після 30-хвилинного впливу інкарнатину внутрішньошлунково вводили розчин 20% пептону, що містив 0,05% фенолового червоного як маркер (1 мл/щур). Шістдесят хвилин пізніше тварин приносили в жертву, черевну порожнину розкривали, шлунково-стравохідний зв’язок і пілор затискали, шлунок виймали, зважували і поміщали в 14 мл 0,1 N NaOH і гомогенізували. Суспензії давали відстоятися протягом 1 години при кімнатній температурі, а потім 5 мл супернатанту додавали до 0,5 мл 20% трихлороцтової кислоти (мас./Об.) І центрифугували при 3000 об/хв протягом 20 хв. Надосадову рідину змішували з 4 мл 0,5 N NaOH, і кількість фенолового червоного у зразку визначали за поглинанням при 560 нм на мікропланшеті Synergy HT (Biotek, Winooski, VT). Одночасно тонкий кишечник був затиснутий на обох кінцях і повністю витягнутий, і зафіксовано відстань від пілоруса до геометричного центру мігруючого барвника.
Довгострокове дослідження годівлі
Інкарнатин давали щодня протягом 90 днів здоровим щурам з 28-денним одужанням та парною оцінкою годування лабораторіями Covance (Відень, штат Вірджинія) (дослідження № 6731-133). Самці та самки щурів Спрег-Доулі були розподілені до п'яти досліджуваних груп (15/стать/група у групах 1, 4 та 5; 10/стать/група у групах 2 та 3). Групи 1 (контроль) і 5 (контроль з парною подачею) отримали транспортний засіб, кукурудзяна олія. Групи 2, 3 та 4 отримували інкарнатин у дозах 20, 40 та 50 мг/кг/добу відповідно. Дозові препарати вводили в обсязі дози 5 мл/кг перорально через один раз на день щурам протягом принаймні 90 днів. Під час фази дозування групи 4 та 5 годувались у парі (середнє споживання їжі групи 4 використовувалось для визначення кількості їжі, наданої групі 5). Додаткові тварини, призначені для фази відновлення (5/стать/група в групах 1, 4 та 5), пройшли принаймні 28 днів відновлення після введення дози. Оцінювали смертність, клінічні спостереження, масу тіла та споживання їжі та води.
Дослідження годування ікемагеніном
Коли тварин обробляли ікемагеніном, дві групи щурів (n = 3), які голодували протягом 24 годин, отримували одну разову дозу контрольного розчину (10% ДМСО в кукурудзяній олії) або 10 мг/кг ікемагеніну, суспендованого в загальному обсязі 2 мл контрольного розчину на початку циклу годування (світиться, 1400 год). Споживання їжі вимірювали через 3 год після обробки сонометра, після чого тварин забивали, а гіпоталамус розтинали та обробляли для вилучення РНК та білка.
Культура клітин
Клітинна лінія гліоми C6 щурів, яка експресує BDNF, була отримана від ATCC (Manassas, VA). Клітини регулярно пасували кожні 3–4 дні і підтримували в модифікованому Дульбекко середовищі Ігл (DMEM), що містив 10% плодової бичачої сироватки (FBS) та 0,1% пеніцилін-стрептоміцину при 37 ° C і 5% CO2. Клітини пересівали в 24-лункові посудини і після їх зниження піддавали впливу середовища DMEM, що містить носій (0,1% етанолу), або різних концентрацій ікемагеніну (0,1–10 мкМ), доданих до набору з трьох лунок на дозу. Цей діапазон доз був обраний на основі фармакологічної активності ікемагеніну в клітинах H295R. 20 Вальпроєву кислоту (2 мМ) використовували як позитивний контроль. Життєздатність клітин оцінювали, використовуючи аналіз МТТ 21, поглинання, зчитане при 550 нм на мікропланшетному спектрофотометрі (Molecular Devices, Саннівейл, Каліфорнія).
Аналіз експресії генів
Вестерн-блот-аналіз
Екстракти цілих клітин або тканин готували в крижаному буфері для лізису (62,5 мМ Трис · HCl рН 6,8, 2% мас./Об. SDS, 10% гліцерину, 50 мМ DTT і 0,01% мас./Об. Бромфенолового синього) і центрифугували при 12000 г протягом 20 хв при 4 ° C. Рівні кількості білка (50 мкг) із супернатантів відокремлювали на 10% поліакриламідних гелях SDS і промокали на нітроцелюлозну мембрану. Вестерн-блот-аналіз проводили за допомогою моноклональних антитіл до BDNF (Abcam, Cambridge, MA) та AGRP (Santa Cruz Biotechnology, Santa Cruz, CA) відповідно до інструкцій виробника. Після промивання помарки інкубували з міченим антирабітом пероксидазою вторинним антитілом і візуалізували за допомогою реагенту ECL Western Blotting Detection Reagent (GE Healthcare, Piscataway, NJ). Після позбавлення плям зондували β-актиновими антитілами (Санта-Крус), щоб служити контролем завантаження.
Статистика
Дані представлені як середнє значення ± стандартні помилки середнього значення (SEM). Статистичний аналіз проводили за допомогою GraphPad Prism 4.0 (Сан-Дієго, Каліфорнія) за допомогою t-критерію Стьюдента або одностороннього дисперсійного аналізу (ANOVA) (відповідно). Вагу тіла аналізували за допомогою одноразового повторного вимірювання ANOVA із проведенням постхок-тестування, щоб локалізувати значущі відмінності в кожну точку часу. Значення Р менше 0,05 вважали значущими.
РЕЗУЛЬТАТИ
Глікозиди вагітних з коренів болотних молочаїв зменшують споживання їжі
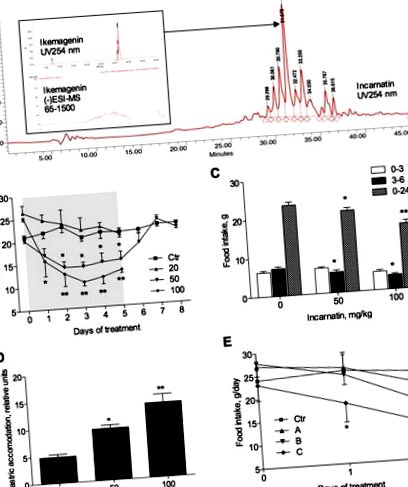
Вплив субфракцій інкарнатину на споживання їжі
Потім три фракції різної полярності, отримані з інкарнатину методом ВЕРХ із зворотною фазою, тестували на пригнічення апетиту при дозі 100 мг/кг. Споживання їжі було зменшено через 1 день прийому як середньої (В), так і низької (С) полярності; однак зменшення досягло значущості лише у тварин, які отримували фракцію С (рис. 1Е). Через 2 дні лікування тварини, які отримували фракцію B, зменшили щоденне споживання їжі на 30,1 ± 4,8% (p Рисунок 2A). Інгібування було більшим при дозі 100 мг/кг. У той же час значення середнього геометричного центру, опосередкованого показника кишкового транзиту, було значно вищим у щурів, які отримували 50 або 100 мг/кг інкарнатину (рис. 2В). Рухова функція товстої кишки, виміряна кількістю фекальних гранул, вигнаних кожною твариною за 1 год після введення інкарнатину щурам, зростала в залежності від дози (Малюнок 2С).
Вплив ікемагеніну на рівні BDNF у культурі клітин
BDNF - центральний аноректичний пептид, який функціонує нижче за рецепторами меланокортину. 5 Щоб підтвердити прямий вплив ікемагеніну на експресію BDNF, ми протестували BDNF-стимулюючу активність ікемагеніну в клітинах гліоми щурів С6 (Малюнок 4А). Доза ікемагеніну залежно підвищувала рівень мРНК BDNF до 6 разів порівняно з клітинами, обробленими носієм. Вальпорова кислота служила позитивним контролем у цьому аналізі (2 мМ) і підвищувала рівень мРНК BDNF у 2,1 рази за однакових умов. Збільшення білка BDNF in vitro після лікування ікемагеніном було підтверджено аналізом Вестерн-блот (рис. 4В).
Прямий вплив ікемагеніну на рівень BDNF у клітинах гліоми С6. (А) Залежне від дози підвищення рівня мРНК BDNF у відповідь на 8 год лікування 0–10 мкМ ікемагеніном. (B) Вестерн-блот-аналіз рівнів BDNF після 24 годин лікування 0–10 мкМ ікемагеніном після денситометричного кількісного визначення з використанням GAPDH як контролю навантаження. Зірочки вказують на значну різницю (* p Таблиця 1). Залишкове незначне зниження споживання їжі на 2% також спостерігалося на фазі відновлення у самців, тоді як самки щурів надмірно компенсували споживання їжі. Маса тіла та збільшення маси тіла зменшувались при застосуванні інкарнатину на 6 та 10% відповідно у чоловіків та на 3 та 9% у жінок, але не досягли значущості ні за один день лікування (рис. 5). Ці значення також узгоджувались із тими, що належали до групи, яка отримувала пару, що свідчить про те, що лише зміна споживання їжі є достатнім для пояснення спостережуваного зниження маси тіла та збільшення маси тіла, пов’язаного із введенням інкарнатину. Середнє споживання води було збільшено у обох статей під час фази дозування експерименту, але мало великого значення і не спостерігалося на фазі відновлення.
Зниження споживання їжі, пов’язане з пероральним введенням інкарнатину, спостерігалося разом із значним збільшенням акомодації шлунка та затримкою спорожнення шлунка (рис. 2). Проксимальний відділ шлунка виробляє низькочастотні стійкі скорочення, які генерують градієнт тиску від шлунка до тонкої кишки і, таким чином, відповідають за спорожнення шлунка. Така закономірність моторики шлунка виникає внаслідок клітин гладких м’язів, які інтегрують велику кількість хімічних, гормональних та нервових сигналів, причому останні походять переважно з кишкової нервової системи. 25 Подібний набір симптомів, що складається із затримки рідкого спорожнення шлунка, розслаблення проксимального відділу шлунка та прискореного транзиту тонкої кишки, був описаний раніше у людей для агоністів рецепторів серотоніну MKC-733 26 та метформіну. 27 Швидкість спорожнення шлунка є важливою для регулювання споживання їжі та гомеостазу глюкози, особливо у осіб із ожирінням. 28 Отже, уповільнення спорожнення шлунка зменшує споживання їжі за рахунок подовження рефлексу насичення, спричиненого блукаючим нервом. 29 Точний механізм впливу глікозидів прегнану на спорожнення шлунку ще слід дослідити.
У сукупності результати, представлені тут, демонструють, що лікування прегнановим глікозидом має кілька наслідків для прийому їжі, які, можливо, опосередковуються нейропептидами гіпоталамусу. Хоча точний механізм невідомий, як геномний аналіз, так і функціональні аналізи вказують на те, що клітинні механізми, що діють in vivo в гіпоталамусі для посилення ситості, можуть або безпосередньо впливати глікозидами прегнану (як у випадку з BDNF), або можуть бути вторинними щодо модуляції шлунково-кишкового транзиту через стимуляцію блукаючих аферентних терміналів. Розуміння ефекту прегнанових глікозидів може призвести до кращого розуміння механізмів, що лежать в основі поведінки годування, і потенційно може призвести до нових терапевтичних цілей для схуднення.
Подяка
Фінансування
Аналізи були частково підтримані Центром ботанічних досліджень NIH Грант 2P50AT002776-06 від Національного центру додаткової та нетрадиційної медицини (NCCAM).
Цей рукопис подано в пам’яті Дмитра Говорка та Джозефа М. О’Ніла, які сприяли цій роботі. Ми вдячні Івану Дженкінсу за допомогу в тепличних господарствах та Рені Пулєвій за технічну допомогу в культурі клітин.
- Вибір їжі європейською козулею (Capreolus capreolus) вплив рослинної хімії та
- Пристрої для контролю фізичної активності та споживання їжі - The New York Times
- Кордони Тепла температура навколишнього середовища зменшує споживання їжі в імітованому офісі, де встановлюють пілота
- Калорії, краса та овуляція Вплив менструального циклу на їжу та зовнішній вигляд
- Годування наших котів Посібник з правильного вживання калорій Оздоровчий корм для домашніх тварин