Вплив до- та перинатального харчування на придбання та підтримку скелета
М. Дж. Девлін
1 Центр удосконалених ортопедичних досліджень, Медичний центр Бет-Ізраїль з питань дияконіси та Гарвардська медична школа, Бостон, Массачусетс 02215
М. Л. Буксен
1 Центр удосконалених ортопедичних досліджень, Медичний центр Бет-Ізраїль з питань дияконіси та Гарвардська медична школа, Бостон, Массачусетс 02215
Анотація
ВСТУП
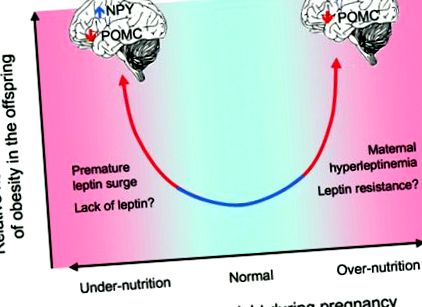
Починаючи з спостереження, що особи, народжені з низькою вагою при народженні, мають підвищений ризик серцево-судинних захворювань [1], є все більше доказів того, що харчування на ранніх термінах впливає на здоров'я після пологів. Як низька вага при народженні [2–10], так і висока вага при народженні [11–14] пов’язані зі зниженням репродуктивної та імунної функцій, а також значно більшою ймовірністю ожиріння, атеросклерозу, діабету II типу та метаболічного синдрому у зрілому віці [15], що свідчить про те, що погане внутрішньоматкове харчування може бути фактором ризику метаболічних захворювань дорослих [16–17] (рис. 1). Наприклад, у дітей жінок, які були вагітними під час Голландської голодної зими 1944–1945 рр., Зростала частота ожиріння, гіперліпідемії та атеросклерозу, якщо голод протягом першого триместру постраждав від їхніх матерів; більш високі показники легеневих та ниркових захворювань, якщо протягом другого триместру; та порушення толерантності до глюкози, якщо протягом третього триместру вагітності [18–20]. Для порівняння, діти з ожирінням матерів або ті, хто народився великим для гестаційного віку, також мають підвищений ризик розвитку метаболічного синдрому порівняно з дітьми, які народилися з нормальною вагою від матерів із нормальною вагою, особливо якщо їх матері також мали гестаційний цукровий діабет [13].
Взаємозв'язок між перинатальним харчуванням та постнатальним метаболічним захворюванням може бути U-подібною, з вищим ризиком порушення метаболізму як при перинатальному недоїданні, так і при недостатньому харчуванні (адаптоване з малюнка 1 у Grattan, D. R. Endocrinology 2008; 149: 5345–5347).
Хоча існує певна підтримка кожної з цих гіпотез, ідея про те, що метаболічні зміни, викликані перинатальним програмуванням розвитку, є адаптивними, сама по собі є гіпотезою. Як зазначають Еллісон та Ясієнська [31], такі реакції розвитку можуть бути адаптацією, але також можуть бути результатом обмежень або патологічних змін нормальної фізіології. Таким чином, уявлення про те, що дана риса є адаптацією, є гіпотезою, яку необхідно перевірити на противагу альтернативним гіпотезам, що ознака виникла через патологію чи обмеження. Найбільш суворий підхід для розрізнення цих альтернатив полягає у розробці підроблених прогнозів для кожної гіпотези - адаптації, патології чи обмеження -, які можна оцінити на основі даних [31]. Як приклад, ми можемо очікувати різних моделей змін розміру тіла потомства, маси кісткової тканини та складу тіла у відповідь на обмеження калорій у матері залежно від того, чи є ця реакція пристосуванням до очікуваного постнатального обмеження енергії, результатом обмеження внутрішньоутробної енергії що виділяється після народження або продукт постійного патологічного порушення процесів росту (табл. 1).
Обмеження калорій у матері та дієта з високим вмістом жиру у матері можуть спричинити подібні зміни в кістковій масі нащадків через змінене програмування вентромедіальних ланцюгів живлення гіпоталамуса, постнатальне ожиріння та потенційно підвищену активність симпатичної нервової системи, що спричиняє втрату кісткової маси. Зміни периферичного лептину можуть також відвернути ендостальні мезенхімальні стовбурові клітини від остеобласта до лінії адипоцитів, збільшуючи жир кісткового мозку та зменшуючи кісткову масу.
СКЛАД МАТЕРІАЛЬНОГО ТІЛА, ДІЄТА ТА МАСА КІСТКІВ, ЩО НАВОДИТЬ
Недоїдання
Недоїдання плода, спричинене обмеженням калорій у матері або порушеннями плаценти, що обмежують кровопостачання плода, пов’язане зі зменшенням кісткової маси. Низькі запаси жиру у матері та енергійні фізичні вправи у матері також пов’язані з нижчою масою кісткової тканини новонароджених у людей [5], а немовлята, народжені малими для гестаційного віку (СГА), мають нижчі показники мінливості кісткової тканини порівняно з великими немовлятами [55]. Ці відмінності зберігаються і в зрілому віці, оскільки особи, які народилися з дуже низькою вагою при народженні, мають нижчу МЩКТ у передпліччі [56] та в поперековому відділі хребта та шиї стегна [57] порівняно з дорослими, народженими з більшою вагою при народженні. Однак, як і загальна зв'язок між масою тіла при народженні та кістковою масою дорослого, описана вище, вплив низької ваги при народженні на кісткову масу може відображати постнатальні умови та/або зменшену масу тіла дорослого. Наприклад, дорослі, народжені раніше терміну, мають менший показник МЩКТ порівняно з дорослими, народженими у доношені терміни, але їх МЩКТ відповідає їх нижчому зросту [58]. Подібним чином низька вага при народженні асоціюється з раннім статевим дозріванням у людей [59], що може зменшити розмір дорослої людини та кісткову масу, передчасно закінчуючи ріст скелета.
Надмірне харчування
На моделях на тваринах діабет матері у щурів асоціюється із зниженим вмістом кальцію та затримкою мінералізації скелета порівняно з контролем [77]. Дієта з високим вмістом жиру у матері часто використовується для індукування метаболічного синдрому у нащадків гризунів [78–79], хоча існують суперечливі дані про те, чи має ожиріння матері бути присутнім до вагітності, щоб викликати метаболічний фенотип [80], чи його наслідки подібні незалежно від того, чи дієта є довгостроковою, чи обмежується вагітністю та лактацією [47]. У мишей потомство дам, що піддаються дієті з високим вмістом жиру, коротше, із меншою загальною кістковою масою тіла на 19 день плоду [81]. Нащадки матерів, котрі харчуються дієтою з високим вмістом жиру і відлучені від тієї ж дієти з високим вмістом жиру, мають більш високе ожиріння кісткового мозку, більшу масу тіла та коротші стегна з більшими розмірами поперечного перерізу у віці 30 тижнів [82]. Однак незрозуміло, чи залишаться ці відмінності після корекції їхньої більшої маси тіла. В цілому, хоча дослідження на тваринах постійно показують, що дієта з високим вмістом жиру у матері призводить до підвищеного ризику метаболічних порушень у потомства, вплив на здоров’я скелета менш чіткий.
Вживання мікроелементів
Вживання мікроелементів матері також може вплинути на здоров’я кісток нащадків, хоча дані важко інтерпретувати з кількох причин. По-перше, визначення «достатнього» рівня вітаміну D у матері під час вагітності залишається спірним [83]. По-друге, хоча деякі дослідження повідомляють про асоціацію рівня немовляти вітаміну D та ВМС [84–85], інші - ні, навіть при крайньому дефіциті вітаміну D. Наприклад, за відсутності добавок вітаміну D загальний BMC в організмі вищий у літніх людей, ніж у корейських новонароджених [86]; в США, де добавки вітаміну D є більш поширеними, BMC насправді вищий у немовлят, народжених взимку, та влітку [87–89]. З іншого боку, немовлята з дефіцитом 1-альфа-гідроксилази або мутацією рецепторів вітаміну D, які не можуть синтезувати або зв’язати вітамін D, мають нормальні скелетні фенотипи при народженні і можуть лікуватися кальцієм, повністю обходячи вітамін D і вважаючи, що це не є важливим для нормальної мінералізації кісток [90]. Таким чином, хоча повідомляється, що потомство матерів з рівнем 25-гідроксивітаміну D 50 нМ/л під час вагітності [91], не ясно, що ця асоціація включає програмування розвитку.
Пов’язки між здоров’ям кісток після пологів та внутрішньоутробним впливом інших мікроелементів такі ж скромні. Щодо кальцію, дослідження в Гамбії не повідомило про різницю в BMC у всьому тілі протягом першого року життя у немовлят із добавками та жінок, які не отримували добавки [92]. Однак у індійських жінок споживання кальцію у матері під час вагітності пов'язане з вищою МЩКТ у потомства у віці 6 років [93]. Нарешті, у Довгому дослідженні Avon для батьків та дітей (ALSPAC) когорта, споживання магнію, калію та фолієвої кислоти під час вагітності у матері позитивно пов’язані з властивостями кісток у віці 9 років, хоча лише останнє залишається значним після корекції розміру тіла [94 ].
Підводячи підсумок, ці дослідження демонструють, що порушення споживання калорій матір'ю та/або дієтичного складу макроелементів у період гестації та лактації мають тривалий вплив на придбання та підтримку скелета нащадків, особливо на моделях тварин. Однак, наскільки ці зміни відбуваються через перинатальне програмування розвитку або через суперечливий перинатальний та постнатальний соматичний ріст, ще потрібно визначити, особливо у людей. Проте, коли дані про людей та тварин беруться разом, вражає те, що дисбаланс у харчуванні матері - занадто мало калорій, занадто багато жиру, занадто мало білка - здається, змінює постнатальну кісткову масу та мікроархітектуру. Перинатальне вплив обмеження калорійності або дієти з низьким вмістом білка шкідливі як для кіркової, так і для трабекулярної кісток, тоді як вплив дієти з високим вмістом жирів, як видається, має складні позитивні та негативні наслідки для різних аспектів трабекулярної та кортикальної мікроархітектури, хоча потрібно більше даних.
МЕХАНІЗМИ, ЩО МОЖУТЬ ПІДКЛЮЧИТИ СКЕЛЕТНУ ВІДПОВІДЬ НА ЗМІНЕНЕ ПЕРИНАТАЛЬНЕ ХАРЧУВАННЯ
Програмування перинатального розвитку рівня гормонів
У разі переїдання матері механізми, що беруть участь у програмуванні розвитку, менш чіткі. На моделях гризунів припускають, що гіперлептинемія новонароджених змінює експресію рецепторів лептину та сприяє селективній стійкості до лептину в дугоподібному ядрі гіпоталамуса, як це спостерігається при постнатальній гіперлептинемії [15]. Також було показано, що дієта з високим вмістом жиру сприяє росту нейронів, що експресують орексигенні пептиди у щурів [123], що може збільшити жирову масу і, отже, рівень лептину. Збільшення споживання жиру дамами щурів на пізніх термінах вагітності та лактації пов’язане з вищою масою жиру у потомства та рівнем лептину при відлученні, але меншим рівнем лептину, ніж контроль після цього [124].
На жаль, існування та терміни перинатального стрибка лептину у людей залишаються незрозумілими, хоча, схоже, рівень лептину у плода високий безпосередньо перед народженням і падає на першому тижні життя. Очевидно, що перинатальне недоїдання або переїдання змінюють рівень постнатального лептину. У немовлят, які народилися великими для гестаційного віку (LGA), рівень лептину вищий за нормальний [125–126], який зберігається до дитинства [127]. І навпаки, діти, народжені малими для гестаційного віку (СГА), мають аномально низький рівень лептину при народженні [128–129] та в дитинстві [130]. Крім того, рівень лептину в грудному молоці різниться залежно від дієти матері, і навіть припускають, що ця варіація - і відсутність лептину у дитячих сумішах - може сприяти захисному ефекту грудного вигодовування на постнатальне ожиріння [131–132]. Однак можливі наслідки рівня лептину при придбанні скелета незрозумілі. Хоча деякі дослідження повідомляють про позитивний зв’язок між розмірами скелета новонароджених, мінеральною щільністю кісток та рівнем лептину в пуповинній крові [133], інші не виявляють такої асоціації [69].
Хоча концепція перинатального програмування розвитку кісток є інтригуючою, потрібні додаткові дані, щоб встановити, чи включають зміни скелета, викликані материнською дієтою, програмування лептину чи інших гормонів, а також зрозуміти, як взаємодія рівнів лептину в перинатальному, лактаційному, а часові рамки після відлучення впливають на постнатальне придбання та підтримку скелета.
Епігенетичні зміни
Епігенетичні зміни в експресії генів, такі як змінене метилювання ДНК, спричинені широким спектром захворювань людини, від раку [140] до алергії та астми [141], до функції специфічних генів, включаючи ген глюкокортикоїдних рецепторів [142]. З огляду на величезний потенціал цього механізму пояснити, як перинатальні впливи можуть спричинити довічні зміни у фізіології потомства, інтерес до потенційних епігенетичних ефектів материнської дієти на кісткову масу потомства високий. Незважаючи на те, що це дослідження знаходиться на початковій стадії, є кілька неприємних натяків. Наприклад, вплив перинатального голоду, як і в Голландській зимі голоду, було пов’язане зі зміненим метилюванням гена IGF2 у зрілому віці [143], що також могло впливати на кісткову масу.
Серед найбільш інтригуючих спостережень є те, що індуковані дієтою зміни з високим вмістом жиру можуть зберігатися протягом кількох поколінь за допомогою епігенетичних механізмів. Чотири покоління мишей, які постійно вирощуються на дієті з високим вмістом жиру, демонструють поступове збільшення жирової маси, незважаючи на відсутність змін у споживанні їжі, поряд із змінами в експресії генів, включаючи колонієстимулюючий фактор 3 (також відомий як гранулоцитарний колонієстимулюючий фактор) і Ноктурнін [149]. Як самці, так і самки мишей, які зазнали високої жирності та/або перегодовування матері під час лактації, можуть передавати своїм потомкам знижену чутливість до інсуліну та збільшену довжину тіла через епігенетичне успадкування [150–151].
Ці дослідження дають шаблон для розуміння того, як перинатальна дієта може впливати на метаболізм нащадків, і ілюструють важливість епігенетичних механізмів у помірності між людиною та навколишнім середовищем. Найбільшими проблемами в майбутньому буде визначити, чи має епігенетична регуляція прямий вплив на кісткову масу та мікроархітектуру потомства, і чи можуть шкідливі епігенетичні зміни бути модифіковані постнатально для зменшення ризику захворювання.
БЕЗОСВІДЧЕНІ ПИТАННЯ ТА МАЙБУТНІ НАПРЯМКИ
Перинатальна дієта матері може впливати на кісткову масу нащадків через перинатальне програмування розвитку рівня лептину, епігенетичні механізми, такі як метилювання ДНК або інші типи геномного імпринтингу, або інші механізми, такі як прямий вплив на диференціацію кісткових клітин, проліферацію або експресію генів. Більше даних про природу перинатального стрибка лептину у людей, а також краще розуміння того, як перинатальний стрибок лептину впливає на кісткову масу, було б особливо корисним. Ще однією ключовою сферою для майбутніх досліджень є спостереження, що ефекти материнської дієти залежать від гестації та лактації, особливо з точки зору розвитку нейронів та програмування ланцюгів живлення. Наприклад, обмеження калорійності матері у щурів лише під час гестації, з наступним швидким наростаючим зростанням лактації, пов’язане з ожирінням та гіперлептінемією, тоді як у нащадків матерів, обмеження калорій яких тривало через лактацію, цих відхилень не спостерігається [152]. Розуміння відносної важливості дієти під час гестації та лактації у встановленні постнатальної кісткової маси може пролити світло на задіяні механізми.
Нарешті, гіпотезу про те, що перинатальне програмування розвитку скелетних фенотипів є адаптивним, слід оцінювати в рамках суворої системи тестування гіпотез, яка розглядає патологію та обмеження як альтернативи адаптації [31]. Після встановлення механізмів, що лежать в основі цих реакцій розвитку, наступною метою буде розробка стратегій для поліпшення кісткової маси та зменшення ризику остеопорозу у постраждалих людей.
Подяка
Фінансування цього проекту забезпечили NIH F32HD060419, T32DK007028 та RC1AR058389.
Виноски
Заява видавця: Це PDF-файл нередагованого рукопису, який прийнято до друку. Як послуга для наших клієнтів ми надаємо цю ранню версію рукопису. Рукопис пройде копіювання, набір версій та перегляд отриманого доказу, перш ніж він буде опублікований у остаточній формі. Зверніть увагу, що під час виробничого процесу можуть бути виявлені помилки, які можуть вплинути на вміст, і всі юридичні застереження, що стосуються журналу, стосуються.
- Вплив генетичного поліморфізму The Journal of Nutrition Oxford Academic
- Магістр університету харчування Сіммонса
- Магістр наук у галузі харчування в НГУ
- Цілющі дієти Харчування Диплом I Школа природної медицини Int l
- Вилікувати ваші незручні (спричинені SIBO) симптоми кишечника за допомогою персоналізованого харчування; Харчуйте здоров’я;