Внутрішня каталаза захищає вірус простого герпесу від інактивації перекисом водню
Анотація
Було показано, що вірус простого герпесу 1 (ВПГ-1) містить каталазу, фермент, здатний детоксифікувати перекис водню, перетворюючи її у воду та кисень. Дослідження з інгібітором каталази показали, що асоційована з вірусом каталаза може відігравати роль у захисті вірусу від окисної інактивації. Встановлено, що ВПГ-1 є більш чутливим до знищення перекисом водню у присутності інгібітора каталази, ніж за його відсутності. Результати свідчать про захисну роль каталази протягом часу, який HSV-1 проводить в окислювальному середовищі поза клітиною господаря.
Віруси відчувають досить різні середовища, залежно від того, чи вони розмножуються всередині клітини хазяїна або переходять від одного хоста до іншого. У клітині вірус та компоненти вірусу піддаються відновлювальному середовищу, де окислювально-відновний потенціал визначається головним чином глутатіоном (18). На відміну від них, за межами клітини вірус піддається дії кисню та токсичних продуктів, одержуваних з кисню, таких як перекис водню, супероксид та гідроксильний радикал, реактивні види, які мають потенціал для інактивації вірусу. Щоб впоратися з такими високореактивними сполуками, рослини та тварини експресують ферменти, здатні перетворювати їх у нетоксичні продукти. Прикладами таких ферментів є каталаза, пероксидази та супероксиддисмутаза (28). Тут ми описуємо результати досліджень, які демонструють наявність каталази в очищеному віріоні простого герпесу. Потім були проведені випробування, щоб визначити, чи може внутрішня каталаза захистити вірус від інактивації H2O2.
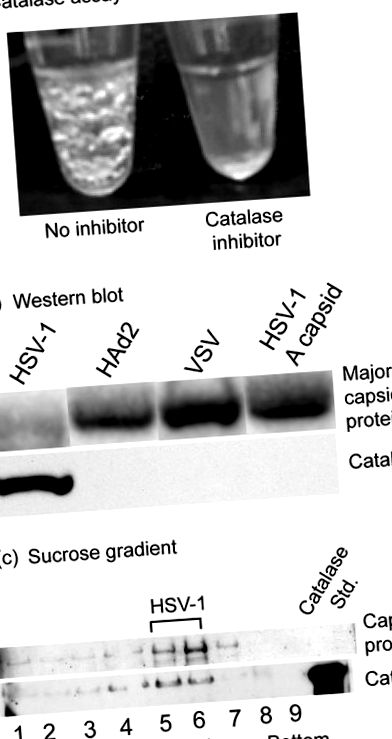
Дослідження каталази проводили з вірусом простого герпесу 1 (HSV-1), який вирощували на клітинах Vero в культурі та очищали центрифугуванням з градієнтом щільності сахарози. Коли суспензії вірусів доводили до 1% H2O2, бульбашки кисню починали швидко утворюватися, вказуючи на наявність каталази (рис. 1а, ліва трубка). Бульбашки стали очевидними візуально через кілька секунд інкубації при кімнатній температурі і продовжували формуватися і збільшуватися щонайменше 20 хв. Однак бульбашки не утворювались, якщо до суспензії вірусу до обробки H2O2 додавали інгібітор каталази азид натрію (рис. 1а, праворуч). Аналізи також були негативними, коли (i) вірус видаляли з розчину центрифугуванням перед додаванням H2O2 або (ii) капсиди HSV-1 (капсиди B) замінювали інтактним вірусом. У подібних аналізах бульбашки, що вказують на наявність каталази, не спостерігались при очищеному вірусі везикулярного стоматиту або аденовірусі людини 2 (дані не наведені). Вестерн-блот-аналіз підтвердив наявність каталази, асоційованої з вірусом HSV-1, але не з аденовірусом, вірусом везикулярного стоматиту (VSV) або капсидами HSV-1 A (рис. 1b).
Були проведені контрольні експерименти, щоб підтвердити, що каталаза була пов'язана з HSV-1, а не з домішками, присутніми у препараті вірусу. Очищений HSV-1 центрифугували в смужку на градієнті щільності сахарози, градієнт фракціонували, а Вестерн-блот-аналіз використовували для тестування окремих градієнтних фракцій на наявність каталази. Результати показали, що каталаза присутня у фракціях, що містять віруси, але не у флангових (рис. 1в). Результати інтерпретуються, щоб вказати, що каталаза асоційована з ВПГ-1, а не із забруднюючими речовинами, такими як бактерії, що містять каталазу, або матеріали клітин-хазяїв у препараті вірусу. Оскільки геном HSV-1 не кодує каталазу (22), асоційований з вірусом фермент повинен бути отриманий з клітини-хазяїна. Ранні дослідження вірусу вакцинії продемонстрували наявність каталази всередині зрілого віріона (8). Окрім цього спостереження, ми не знаємо жодного іншого повідомлення про каталазу як компонент вірусної структури.
Більш точне визначення місця розташування каталази було отримано обробкою очищеного вірусу неіонним миючим засобом Triton X-100 (TX-100). При проведенні свіжого вірусу це лікування спричиняє втрату мембрани вірусу, мембранних глікопротеїнів та майже всіх 20 або більше білків тегументу (всі, крім UL36, UL37 та US3) (13, 21, 27). Однак капсид зберігає свою цілісність, і жоден з основних білків капсиду не втрачається. ДНК вірусу зберігається всередині капсиду. Експерименти включали обробку ВПГ-1 1% ТХ-100 та виділення отриманих капсидів центрифугуванням з градієнтом щільності сахарози. Потім був використаний Вестерн-блот-аналіз для тестування капсидів на наявність каталази. Результати продемонстрували, що глікопротеїни вірусу та білки тегументу були видалені, як очікувалось, і що каталаза також була видалена (див. Рис. 2а, смуги 4 та 5). Цей експеримент інтерпретується, щоб вказати, що каталаза присутня в тегументі HSV-1.
Інформація, така як показана на рис. 2, може бути використана для визначення кількості молекул каталази на віріон HSV-1 (15). Це вимірювання проводили, починаючи з двох однакових аликвот очищеного вірусу. Ці два використовувались для визначення (i) кількості основних молекул капсидного білка (UL19) із забарвленого синім гелем Кумасі та (ii) кількості молекул каталази 60 кДа від каліброваного вестерн-блот. У репрезентативному визначенні цей аналіз дав значення 1: 207,5 для молярного відношення каталази до UL19. Оскільки на одну капсиду HSV-1 припадає 955 молекул UL19, кількість молекул каталази на капсид була визначена 955/207,5 або 4,6. Друге подібне визначення дало значення 7,1 молекули каталази. Оскільки в активній молекулі каталази є чотири субодиниці 60 кДа (11, 20), результати вказують на наявність 1–2 тетрамерів каталази на віріон.
Наявність каталази всередині віріона HSV-1 свідчить про можливість її участі у захисті вірусу від окисного пошкодження H2O2. Альтернативно, каталаза може бути пасивно включена в HSV-1, оскільки тегумент додається в цитоплазму клітини-хазяїна і не має жодної захисної функції. Щоб розрізнити ці дві можливості, ми дослідили чутливість очищеного HSV-1 до інактивації H2O2 in vitro. ВПГ-1 обробляли H2O2 у присутності або відсутності інгібітора каталази азиду натрію (NaN3), а потім визначали титр вірусу (за відсутності інгібітора каталази). Результати показали, що, хоча 50 мМ H2O2 спричиняє помірне зниження титру (від 3 до 4 разів), за наявності NaN3 спостерігався летальний ефект у 10 6 разів або більше (табл. 1). Контрольні експерименти показали незначне знищення ВПГ-1 лише NaN3 (табл. 1). Результати інтерпретуються, щоб вказати, що каталаза забезпечує значний рівень захисту від інактивації HSV-1 H2O2.
Таблиця 1
Титр вірусу після обробки H2O2 з інгібітором каталази або без нього (NaN3) a
| Ні NaN3 | 28 × 10 10 | 60 × 10 10 | 8 × 10 10 | 28 × 10 10 | 10 × 10 10 | 8 × 10 10 |
| 2 мМ NaN3 | 30 × 10 10 | 6 × 10 10 | 4 | 30 × 10 10 | 1 × 10 10 | 4 |
Не очікується, що ВПГ-1 потрібно захищати від окисних пошкоджень H2O2, поки він пов'язаний з клітиною-господарем. Як описано вище, у клітині знаходиться відновлювальне середовище, яке запобігає утворенню H2O2. Однак поза клітиною хазяїна середовище є окислювальним, здатним продукувати H2O2 як всередині вірусу, так і в навколишньому середовищі. ВПГ-1 стикається з цим середовищем, оскільки воно передається від одного господаря до іншого, і каталаза може брати участь у захисті від інфекції ВПГ-1 під час транзиту. Каталаза, асоційована з ВПГ-1, може також забезпечити захист від H2O2, що утворюється коменсальними бактеріями або іншими джерелами. Наприклад, H2O2, вироблений лактобактеріями, захищає статеві шляхи жінки від захворювань, спричинених мікробною інфекцією (4). Через свою високу каталітичну швидкість, асоційована з вірусом каталаза може відігравати роль у захисті ВПГ-1, незважаючи на низьку кількість копій (1 - 2 копії на віріон). Наприклад, печінкова каталаза здатна детоксифікувати десятки мільйонів молекул H2O2 в секунду, серед найвищих каталітичних показників для будь-якого ферменту (2).
Усі віруси сімейства герпесів мають покрив, шар білка, який лежить між капсидом вірусу та мембраною (5, 6, 9, 13). Тегумент HSV-1 має товщину від 40 до 50 нм і складається приблизно з 20 різних видів білків, майже всі з яких кодуються в геномі вірусу. Білки тегументу суттєво відрізняються між собою за вмістом у віріоні 800 або більше копій основних видів, таких як UL47, UL48 та UL49 (див. Рис. 2а, смуга 3) (5, 16). Багато білків тегументу беруть участь у ранніх стадіях реплікації HSV-1, таких як активація ранньої транскрипції генів та ослаблення синтезу білка клітини-господаря (13, 24, 25). Тегумент збирається у зароджується віріон HSV-1 у вигляді ДНК-вмісних капсидних бруньок у міхур транс-мережі Гольджі (10). Вважається, що каталаза включається разом з іншими білками тегументу в процесі бутонізації.
У неінфікованих клітинах більшість каталази виявляється секвестровано в пероксисомах (26). Для того, щоб він міг бути включений у потомство HSV-1 під час тегументації, як описано вище, каталазу потрібно було б звільнити від пероксисом. Ми припускаємо, що це може мати місце як наслідок масштабної перебудови цитоплазматичних мембран, що супроводжує реплікацію HSV-1 (1).
Паламара та ін. (19) продемонстрували, що зниження концентрації цитоплазматичного глутатіону відбувається негайно після зараження клітин Vero ВПГ-1. Очікується, що зниження концентрації глутатіону призведе до зменшення цитозольного потенціалу відновлення, і це зниження, здається, посилює реплікацію HSV-1. Встановлено, що додатковий глутатіон, що міститься в ростовому середовищі, антагонізує ріст HSV-1 (19). Подібно до зовнішнього доданого глутатіону, цитозольна каталаза може збільшити потенціал зменшення цитоплазми шляхом видалення H2O2. Отже, припускають, що одним із наслідків включення каталази у віріони потомства може бути посилення росту вірусу шляхом позбавлення інфікованих клітин каталази.
Невелика кількість молекул каталази на віріон може пояснити, чому його не було виявлено в мас-спектрометричному аналізі цілих віріонів HSV-1 (7). Є кілька білків віріону HSV-1 з великим числом копій, які можуть затуляти сигнал від каталази (наприклад, є тисячі копій молекул глікопротеїну та 955 копій основного капсидного білка [3]). Велика кількість каталази не відповідає неформальному стандарту для детектування за допомогою мас-спектрометрії (видимість на забарвленому Кумасі гелі SDS-PAGE). Пероксиредоксин, пероксисомний білок з антиоксидантною активністю, був виявлений в мас-спектрометричному аналізі ВПГ-1 (7, 26).
У майбутньому може бути можливим використати чутливість HSV-1 до цитотоксичних ефектів H2O2. Очікується, що вірус буде особливо вразливим, коли він перебуває в окислювальному середовищі поза клітиною хазяїна та коли інгібується каталаза.
ПОДЯКИ
Ми дякуємо Тому Кроуеллу, Діну Кедесу, Лізі Джонс та Ніку Шерману за допомогу з інтерпретацією результатів, Джамілі Харуака за подарунок вірусу везикулярного стоматиту та Онеїді Мейсон за допомогу в експериментальному дизайні.
Ця робота була підтримана премією NIH AI041644 .
- Вірус простого герпесу Інформація Гора Синай - Нью-Йорк
- Вірус герпесу вбиває нерви товстої кишки - Cosmos Magazine
- Перекис водню та сила оксигенації
- Інфекція вірусом герпесу - огляд тем ScienceDirect
- Кетогенна дієта захищає від грипу вірусної інфекції