Визначення олова, властивості, використання та факти Британіка
Наші редактори розглянуть подане вами повідомлення та вирішать, чи слід переглянути статтю.
Олово (Sn), хімічний елемент, що належить до сімейства вуглецю, група 14 (IVa) періодичної системи. Це м’який, сріблясто-білий метал із синюватим відтінком, відомий древнім у бронзі, сплаві з міддю. Олово широко використовується для покриття сталевих банок, що використовуються як харчова тара, в металах, що використовуються для підшипників, і в припої.
Витоки олова втрачені в античності. Бронзи, що є сплавами міді та олова, використовувались людьми в передісторії задовго до того, як був виділений чистий метал олова. Бронзи були поширені в ранній Месопотамії, долині Інду, Єгипті, Криті, Ізраїлі та Перу. Велика частина олова, що використовувалося ранніми середземноморськими народами, очевидно, надходила з островів Сіллі та Корнуолл на Британських островах, де видобуток олова припадає щонайменше на 300–200 років до н. Е. До завоювання Іспанії олов'яні шахти діяли як в областях інків, так і в ацтеках Південної та Центральної Америки. Символ Sn для олова - це абревіатура латинського слова олово, stannum.
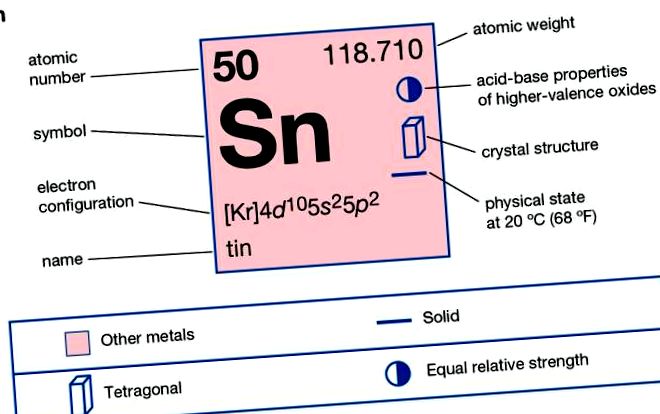
| 50 |
| 118,69 |
| 231,97 ° C (449,54 ° F) |
| 2270 ° C (4100 ° F) |
| 7.28 |
| 5,75 грам/см 3 |
| +2, +4 |
| [Кр] 4d 10 5s 2 5p 2 |
Виникнення та поширення
Цей елемент присутній у магматичних породах земної кори приблизно на 0,001 відсотка, що є дефіцитом, але не рідкістю; його кількість в тому ж порядку величини, що й такі технічно корисні елементи, як кобальт, нікель, мідь, церій та свинець, і по суті дорівнює ряду азоту. У космосі на 1 × 10 6 атомів кремнію припадає 1,33 атома олова, кількість яких приблизно дорівнює кількості ніобію, рутенію, неодиму або платини. Космічно олово є продуктом поглинання нейтронів. Заслуговує на увагу його багатство стабільними ізотопами.
Олово міститься в зернах самородного металу, але головним чином як оксид олова, SnO2, в мінералі каситерит, єдиному мінералі олова комерційного значення. Метал отримують з каситериту шляхом відновлення (видалення кисню) вугіллям або коксом у плавильних печах. Високоякісні депозити не відомі. Основними джерелами є алювіальні родовища, у середньому близько 0,01 відсотка олова. Найдавнішими шахтами для олова були ті, що знаходились у Корнуолі, які працювали принаймні ще за фінікійських часів, але вже не мають великих наслідків, та в Іспанії. Лодові родовища, що містять до 4 відсотків, є в Болівії та Корнуолі. На початку 21 століття Китай лідирував у світі з виробництва олова, що становило майже половину всього виробництва; Індонезія, Перу та Болівія також були провідними виробниками. Було розроблено кілька способів відновлення металу з брухту олова або виробів, покритих оловом. (Повне лікування видобутку, переробки та відновлення олова див. У переробці олова.)
Властивості елемента
Олово є нетоксичним, пластичним, пластичним і пристосованим до всіх видів холодної обробки, таких як прокат, прядіння та екструзія. Колір чистого олова зберігається під час впливу, оскільки тонка, невидима, захисна плівка оксиду олова перетворюється мимовільно в результаті реакції з киснем повітря. Низька температура плавлення олова та його міцна адгезія до чистих поверхонь заліза, сталі, міді та мідних сплавів полегшують його використання як стійкого до окислення матеріалу покриття. Олово існує у двох різних формах, або алотропах: знайома форма, біле (або бета) олово, і сіре (або альфа) олово, яке є порошкоподібним і мало корисним. Сіра форма змінюється на білу вище 13,2 ° C (55,8 ° F), швидко при температурі вище 100 ° C (212 ° F); зворотне перетворення, яке називається шкідником олова, відбувається при низьких температурах і серйозно ускладнює використання металу в дуже холодних регіонах. Ця зміна є швидкою лише нижче -50 ° C (-58 ° F), якщо тільки не каталізується сірим оловом або оловом у стадії окислення +4, але запобігає невелика кількість сурми, вісмуту, міді, свинцю, срібла або золота зазвичай присутній у комерційних сортах олова.
Біле олово має орієнтовану на тіло тетрагональну кристалічну структуру, а сіре олово має кубову структуру, орієнтовану на обличчя. Згинаючись, олово викликає моторошний, тріскучий «крик», коли його кристали давлять один одного. Олово атакують сильні кислоти та луги, але майже нейтральні розчини не впливають на нього помітно. Хлор, бром і йод реагують з оловом, але фтор реагує з ним лише повільно при кімнатній температурі. Взаємозв'язок між алотропними модифікаціями олова можна представити як перетворення від одного типу кристалів до іншого за певних температур:
(Подвійні стрілки означають, що перетворення відбувається в обох напрямках, коли олово нагрівається або охолоджується.)
Олово існує у двох ступенях окиснення, +4 та +2. Елементарний олово легко окислюється до дипозитивного іона в кислому розчині, але цей іон Sn 2+ перетворюється в іон Sn 4+ багатьма м'якими окислювачами, включаючи елементарний кисень. Окислення в лужних умовах зазвичай дає тетрапозитивний (Sn 4+) стан. У лужному середовищі дипозитивне олово (Sn 2+) легко диспропорціонує до тетрапозитивного олова та вільного елемента.
Олово має 10 стабільних ізотопів, що зустрічається в таких відсотках у природному олові: олово-112, 0,97; олово-114, 0,65; олово-115, 0,36; олово-116, 14,53; олово-117, 7,68; олово-118, 24,22; олово-119, 8,58; олово-120, 32,59; олово-122, 4,63; і олово-124, 5,79.
Лудіння заліза захищає останнє від корозії; олов'яні трубопроводи та клапани підтримують чистоту у воді та напоях; розплавлене олово є основою для виробництва (поплавкового) склопластику. Оскільки чистий олово відносно слабкий, його не застосовують для структурних цілей, якщо він не легований з іншими металами в таких матеріалах, як бронзи, олова, несучі метали, метали типу, припої на основі свинцю, колокольний метал, метал бабіту та низькотемпературні ливарні сплави . Оксид олова, в якому олово перебуває у стадії окислення +4, корисний для того, щоб зробити керамічні тіла непрозорими, як м'який абразив і як обважнювач тканин. Фторид олова та пірофосфат олова, у яких олово перебуває у стадії окислення +2, використовуються в засобах для чищення зубів. Органічні сполуки олова діють як стабілізатори певних пластмас та як консерванти деревини. Кристалічний сплав з ніобієм є надпровідником при температурах до 18 К (-427 ° F) і зберігає цю властивість у дуже сильних магнітних полях.
Елементарний олово, мабуть, нетоксичний, і кількість олова до 300 частин на мільйон, розчинене харчовими продуктами, упакованими в покриті олов'яним посудом та посудом, не є шкідливими. Проте органічні сполуки олова, які зазвичай використовуються як біоциди та фунгіциди, токсичні для людини.
Сполуки
Олово утворює два ряди сполук: олов'яний, у якому олово перебуває у +2 ступені окиснення, і олований, у якому він перебуває в +4 стані. Одними з комерційно важливих важких сполук олова є хлорид олова SnCl2, який використовується при цинкуванні олова та як відновник при виробництві полімерів та барвників; оксид олова, SnO, застосовуваний для виготовлення солей олова для хімічних реагентів та для покриття; та фтористий олово, SnF2, активний інгредієнт зубних паст. Значущі сполуки станіну включають хлорид олова, SnCl4, широко застосовуваний як стабілізатор для парфумерії та як вихідний матеріал для інших солей олова; і оксид олова, SnO2, корисний каталізатор у певних промислових процесах і полірувальний порошок для сталі.
Олово може утворювати зв’язок з вуглецем, як у більш ніж 500 відомих органотинових сполуках. Органотинові стабілізатори застосовуються для запобігання змінам полівінілхлориду під впливом світла та тепла. Ряд органотинових сполук є основними інгредієнтами біоцидів та фунгіцидів.
Ця стаття була нещодавно переглянута та оновлена Адамом Августином, керуючим редактором, Довідковий вміст.
- Визначення невагомості, ефекти та факти Британіка
- Переваги та використання The Steel Club Onnit AcademyOnnit Academy
- Дивні факти, через які ваша мова може змусити вас їсти занадто багато солі
- Tribulus Застосування, побічні ефекти, дозування, взаємодія та користь для здоров'я
- Правда про мікрохвильові печі 5 фактів, які можуть вас здивувати