Управління метастатичною тимомою за допомогою метаболічної та медичної терапії: звіт про випадок
Метью К. Л. Філіпс
1 Неврологічне відділення лікарні Вайкато, Гамільтон, Нова Зеландія
Дебора К. Дж. Муртаг
2 Healthy Kitchen Christchurch Ltd., Гамільтон, Нова Зеландія
Санджай К. Сіньха
3 Відділення патології лікарні Вайкато, Гамільтон, Нова Зеландія
Бен Г. Місяць
4 Відділення рентгенології, лікарня Вайкато, Гамільтон, Нова Зеландія
Анотація
Вступ
Тимоми, найпоширеніша пухлина переднього середостіння, складаються з новоутворених клітин тимічного епітелію, змішаних з різною кількістю неопухолевих лімфоцитів (1, 2). Тимоми, як правило, протікають безсимптомно, але можуть проявлятися болем у грудній клітці, задишкою та різноманітними аутоімунними розладами, найчастіше міастенією, яка має слабкість очей, бульбар та кінцівок та втомлюваність (3). Майже 30% тимом непрацездатні (4), що призводить до 5-річного рівня виживання 36–53% (5, 6). Неопераційні метастатичні тимоми, як правило, управляються за допомогою хіміотерапії для контролю симптомів, пов’язаних з пухлиною; не очікується тривалого виживання (4). При метастатичних тимомах необхідні нові терапевтичні стратегії.
Рак, як правило, розглядається як головним чином генетичний розлад, але він також може сприйматись як головним чином метаболічний розлад, причому більшість генетичних відхилень виникають як вторинні явища (7). Ракові клітини демонструють різко збільшене засвоєння глюкози, що є спільною рисою понад 90% злоякісних ракових захворювань (8), а деякі ракові клітини також демонструють посилене засвоєння амінокислоти глутаміну (9, 10). Клітини раку покладаються на ці ферментовані метаболіти, щоб компенсувати дисфункцію мітохондрій та порушення дихання клітин, що характерно для більшості видів раку (7). Ракові клітини також значною мірою покладаються на шляхи передачі сигналів росту, особливо на ті, що включають інсулін, інсуліноподібний фактор росту-1 (IGF-1) та мішень для ссавців рапаміцину (mTOR) (11), щоб підтримати “перепрограмований” метаболізм клітин, перенаправлений нестримний ріст і розповсюдження (12). З огляду на ці факти, ракові клітини можуть бути вразливими до втручань, які вибірково націлюються на їх ненормальний метаболізм.
Звіт про справу
Ми повідомляємо про випадок з 37-річною 37-тижневою вагітною консультантом з маркетингу, у якого через 2 місяці погіршилася слабкість повік за активністю, а також 1 місяць плевритичного болю в грудях та задишки. Їй діагностували міастенію у віці 26 років, протягом цього часу супутню середостінну масу лапароскопічно резекували та діагностували як інвазивну тимому В2 типу ВООЗ. Незважаючи на те, що їй тимчасово вводили піридостигмін, преднізон та внутрішньовенний імуноглобулін (IVIg), єдиним її поточним препаратом був азатіоприн 50 мг перорально щодня. Вона важила 53 кг. Неврологічне обстеження виявило тонкий двосторонній асиметричний птоз та легку стомлюваність повік. Результати обстеження щодо сили верхніх і нижніх кінцівок, рефлексів, підошовної реакції та відчуття були нормальними.
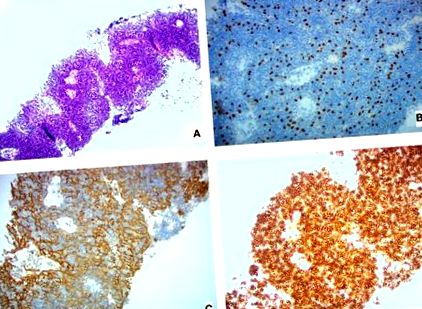
За допомогою комп’ютерної томографії (КТ) шиї та грудної клітки виявлено кілька великих м’яких тканин у лівій легені, найбільша - 10 × 5 × 14 см (загальний об’єм пухлини 549,6 см 3); кілька мас вторглися в ліву плевру, і був невеликий лівий плевральний випіт. Нашого пацієнта лікували IVIg (1 г/кг, вводили протягом 5 днів), щоб забезпечити нескладне виношування здорової дівчинки через 2 тижні. На наступний день після пологів їй зробили біопсію черезшкірної голки лівої плеври та діагностували ВООЗ типу АВ (із зазначенням овальних/веретеноподібних клітин із домішкою рясних дрібних лімфоцитів), стадію Масаока IVA (із вказівкою на розповсюдження плеври або перикарда) тимоми [Рис. 1; (3)]. На багатодисциплінарному засіданні тимому визнали нерезектабельною, і їй запропонували нелікувальну хіміотерапію, від якої вона відмовилася. Після цього було запропоновано комбіноване метаболічне втручання; після пояснення всіх передбачуваних ризиків та переваг, вона обрала цей курс.
Показані гістологічні зображення біопсії плеври (A) Пляма H&E, (B) Пляма 20 × P63 (виділення ядер клітин епітелію), (C) 20 × пляма AE1/AE3 (виділяючи цитоплазму клітин епітелію), та (D) 20 × пляма CD45 (виділення лімфоїдних клітин).
Здоров’я і міастенія нашого пацієнта регулярно контролювався неврологом під час метаболічного втручання, яке складалося з періодичного режиму голодування (починаючи з 12-денного голодування лише з водою, після чого послідовно 7-денних голодування лише з рідиною) 1–2 місяці) у поєднанні із модифікованою кетогенною дієтою (60% жиру, 30% білка, 5% клітковини та 5% ваги вуглеводів, що складається переважно із зелених овочів, м’яса, яєць, горіхів, насіння, кремів та натуральної олії) у дні годування (рис. 2). Вона моніторувала та реєструвала рівень глюкози та бета-гідроксибутирату (BHB) у крові (Freestyle Neo; Abbott Diabetes Care, Уїтні, Великобританія) три рази на тиждень (17). Всі побічні ефекти були задокументовані. Онколог спостерігав за тимомою за допомогою КТ кожні 4–5 місяців, а рентгенолог, засліплений лікуванням, одночасно оцінював всі КТ за допомогою об’ємного аналізу в кінці втручання (рис. 3). Обсяги пухлини обчислювали за пороговою сегментацією одиниці Хаунсфілда з наступною ручною корекцією всіх полів пухлини.
КТ грудної клітки (корональний та осьовий види, основна частина пухлини обведена червоним кольором), що показує загальні обсяги пухлини під час діагностики, 8, 12, 25 та 29 місяців після діагностики.
Перші 3 місяці комбінованого метаболічного втручання проходило без особливих зусиль, але протягом 4–7 місяців у нашого пацієнта спостерігався знижений апетит та пероральне вживання протягом декількох тижнів діареї (до 10 рухів на день), що призводило до ваги 6 кг втрата; діарея була широко досліджена і вважалася асоційованою з тимомою аутоімунною ентеропатією (18). У збігу з діареєю у неї розвинувся рецидив міастенії, що призвів до погіршення двостороннього птозу, дисфагії та слабкості чотирьох кінцівок із втомлюваністю. Наша пацієнтка вирішила не починати приймати преднізон, оскільки вона кілька років тому переживала порушення настрою, безсоння та збільшення ваги під час прийому цього препарату. Тому їй розпочали 4-тижневий IVIg протягом 4 місяців, після чого її 8-місячна КТ виявила часткову регресію пухлини (376,4 см 3, що являє собою зменшення обсягу діагнозу на 32%), помірний двобічний плевральний випіт та невеликий перикардіальний випіт. Враховуючи те, що симптоми міастенії зберігалися в поєднанні з можливістю того, що IVIg, можливо, сприяв частковій регресії, азатіоприн був зупинений, а частота IVIg збільшена до 3-х тижнів.
Протягом 9–12 місяців у нашої пацієнтки діарея припинилася, вона набрала вагу, і симптоми міастенії зникли. Однак 12-місячна КТ продемонструвала, що тимома відросла до початкового діагнозу. Враховуючи постійний контроль міастенії та відсутність інгібуючого впливу IVIg на ріст пухлини, частоту IVIg зменшували до 6 тижнів.
Протягом 13–24 місяців наша пацієнтка в основному залишалася без діареї і підтримувала діагноз, масу тіла, а симптоми міастенії залишалися контрольованими. Частота її введення IVIg була зменшена до 8 тижнів, а потім 12 тижнів. На момент 25-місячної КТ тимома демонструвала мінімальний ріст (632,7 см 3, що становить 13% збільшення обсягу діагностики), і всі випоти зникли.
Через 2 роки на комбінованому втручанні натще і кетогенну дієту наша пацієнтка важила 54 кг, а її середній 2-річний рівень глюкози та BHB (± стандартне відхилення) вимірювали відповідно 4,98 ± 0,55 та 3,50 ± 1,27 ммоль/л. Протягом кожного 7-денного періоду голодування вона втрачала в середньому 2,9 ± 0,72 кг маси тіла із середнім рівнем глюкози та BHB у крові протягом періодів голодування, виміряних відповідно 3,92 ± 0,73 та 6,31 ± 1,55 ммоль/л. Було кілька побічних ефектів, пов’язаних з голодуванням, включаючи непереносимість холоду, втома та генералізовані м’язові болі, які досягли максимуму протягом перших 3 днів кожного періоду голодування і поступово зникали протягом першого року, так що вони більше не виникали на другий рік. Жодних негативних наслідків щодо кетогенної дієти не спостерігалося.
Протягом 25–29 місяців наш пацієнт пережив кілька тижнів різко зменшеного прийому всередину та діареї, що призвело до втрати ваги на 15 кг. Вона також розробила другий, більш важкий рецидив міастенії, що призвів до двостороннього птозу, дизартрії, слабкості чотирьох кінцівок зі стомлюваністю та дихальної недостатності, що вимагала 2 тижнів інтубації та штучної вентиляції легенів у відділенні інтенсивної терапії. Її лікували плазмообміном з подальшим внутрішньовенним внутрішньовенним введенням 3–4 разів на тиждень та 10 днів октреотиду у дозі 1,5 мг підшкірно на день (з подальшим введенням одноразової дози октреотиду тривалої дії 20 мг внутрішньом’язово через 1 місяць). Незважаючи на попередні несприятливі ефекти, які відчував наш пацієнт стосовно преднізолону, ми вирішили розпочати приймати преднізон у дозі 40 мг перорально щодня. Симптоми її міастенії зникли, і 29-місячна КТ виявила майже повну регресію тимоми (21,3 см 3, що становить 96% зменшення обсягу діагностики).
Обговорення
У цьому випадку втручання на основі голодування та кетогенної дієти, а також допоміжні ліки, спрямовані на контроль симптомів міастенії, завершились майже повною регресією метастатичної тимоми. Протягом 2 років наша пацієнтка майже повністю покладалася на метаболічну стратегію управління своїм метастатичним раком, протягом якого вона залишалася активною, підтримувала свою діагнозну масу тіла, а обсяг пухлини збільшився на скромні 13%. Було кілька побічних ефектів, пов’язаних з голодуванням, включаючи непереносимість холоду, втома та генералізовані болі в м’язах, які всі зникли до другого року. Потім вона пережила 4-місячний рецидив міастенії, що супроводжувався серйозною втратою ваги та потребою преднізолону, за цей час тимома зменшилася в об’ємі на 96%. Майже через 3 роки після діагностики метастатичного раку наш пацієнт не виявляє ознак захворювання і веде повноцінне та активне життя. Вона продовжує свою метаболічну терапію, і її єдиною медичною терапією є преднізон 10 мг перорально щодня.
Важливо зазначити, що хоча 2 роки комбінованого втручання натще і кетогенної дієти могли обмежити ріст метастатичної тимоми у нашого пацієнта, пухлина не зменшилась в обсязі до кінця цього підходу; лише на тлі двох рецидивів міастенії відбулося значне зменшення обсягу, із зменшенням обсягу діагнозу пухлини на 32% протягом першого 4-місячного рецидиву та зменшенням обсягу на 96% під час другого 4-місячного рецидиву. Враховуючи, що обидва рецидиви у нашого пацієнта характеризувались аномальною імунною функцією та помітною втратою ваги, можливо, що імунна активація та екстремальне обмеження енергії сприяли регресам, а оскільки обидва рецидиви лікувались медичним шляхом, один або кілька препаратів від міастенії могли мати сприяли регресіям. Ці можливості вимагають обговорення.
По-перше, можливо, що імунна активація сприяла обом регресіям. Так звані "спонтанні" регресії протягом тисячоліть фіксуються при різних видах раку (29). Механізм спонтанної регресії залишається невідомим, але може включати активацію механізмів розпізнавання антигенів таким чином, що імунна система стає здатною розпізнавати ракові клітини, що дозволяє встановити активний імунітет проти пухлин (30). У випадку тимом, які, як правило, протікають безсимптомно, нечисленні задокументовані випадки спонтанного регресу мають лихоманку, біль у грудях та плевральний випіт, які, як вважають, є результатом масивної запальної реакції всередині пухлини (31). З огляду на подібні висновки у цьому випадку, у нашого пацієнта могла статися індукована імунітетом регресія, хоча слід зазначити, що спонтанна регресія метастатичної тимоми за відсутності будь-яких інших лікувальних факторів є надзвичайно рідкою; наскільки нам відомо, зареєстровано лише один випадок тимоми IVA стадії, що зазнала спонтанну (і лише часткову) регресію (31).
По-друге, надзвичайне обмеження енергії могло сприяти обом регресіям. Під час кожного рецидиву наш пацієнт відчував глибоке зниження апетиту, що призвело до мінімального споживання калорій протягом декількох тижнів. Наступна втрата ваги була значною - наприклад, протягом кожного 1-тижневого швидкого прийому рідини наша пацієнтка зазвичай втрачала 2,9 кг (5% маси тіла), тоді як під час першого та другого рецидивів вона втрачала 6 кг (11% маси тіла) та 15 кг (28% маси тіла) відповідно. В обох випадках такий ступінь втрати ваги призвів би до значних змін рівня кетону, глюкози, глютаміну та факторів росту, сприяючи виникненню ворожого фізіологічного середовища для метаболічно негнучких ракових клітин. Таким чином, можливо, що у нашого пацієнта сталася надзвичайна метаболічна регресія.
У сукупності цілком ймовірно, що кілька факторів завершились майже повною регресією метастатичної тимоми нашого пацієнта. Важко ігнорувати 2 роки періодичного голодування в поєднанні з кетогенною дієтою, яка занурювала б пухлину в кетони, позбавляючи її глюкози, глутаміну та факторів, що стимулюють ріст. Не менш важко ігнорувати два рецидиви міастенії, при яких імунна активація та екстремальне обмеження енергії могли сприяти обом регресіям; у разі другого рецидиву можливо, що індукований преднізоном апоптоз лімфоцитарного компонента пухлини сприяв різкій другій регресії. Загалом, ми висуваємо гіпотезу, що 2 роки комбінованого втручання натще і кетогенної дієти метаболічно ослабили неопластичний компонент тимової клітини тимоми, «створивши стадію» для імунної активації та екстремального обмеження енергії для знищення більшості ракових клітин під час рецидивів. індукований преднізолоном апоптоз, що руйнує більшу частину лімфоцитарного компонента тимоми під час другого рецидиву, що завершиться віртуальною ерадикацією пухлини.
Враховуючи, що в цьому дослідженні брав участь один пацієнт, його основне обмеження очевидне, і важко зробити остаточні висновки. Додаткові потенційні обмеження включають занепокоєння тим, що періодичне голодування та кетогенні дієти можуть спричинити небажану втрату ваги та інші несприятливі наслідки у пацієнтів з метастатичним раком. Тому важливо зауважити, що наш пацієнт не відчував втрати ваги після 2-х років, що пройшли обидва метаболічні втручання. Більше того, хоча вона зазнала декількох несприятливих наслідків, пов’язаних з голодуванням, усі вони були тимчасовими та покращувались, оскільки вона адаптувалася до кожного наступного періоду голодування.
На закінчення, цей випадок унікальний тим, що втручання на основі голодування та кетогенної дієти було використано як основну стратегію лікування метастатичного раку за відсутності хірургічного втручання, хіміотерапії чи променевої терапії, що завершилося майже повною регресією непрацездатного метастатична тимома, у нашого пацієнта спостерігаються лише тимчасові побічні ефекти, пов’язані з голодуванням. Майже через 3 роки після діагностики неоперабельного метастатичного раку наш пацієнт не виявляє ознак захворювання і веде повноцінне та активне життя. Хоча ми не можемо бути впевнені в механізмі, що лежить в основі цього чудового результату, найбільш правдоподібним поясненням є те, що 2 роки голодування та кетогенної дієтичної терапії метаболічно ослабили тимому, створивши основу для комбінованого імунітету, метаболізму та індукованого преднізолоном. майже повна регресія. Незважаючи на нашу невизначеність, надзвичайний результат у нашого пацієнта підкреслює важливість вивчення методів метаболічної терапії у запущених випадках раку в надії, що пацієнтам у найближчі роки можна запропонувати більше можливостей.
Заява про етику
У цьому звіті від пацієнта було отримано письмову інформовану згоду на публікацію будь-яких потенційно ідентифікованих зображень або даних, включених до цієї статті.
Внески автора
МП: концепція, дизайн, інтерпретація та написання остаточної статті. DM: впровадження дієти та поради, а також перевірка остаточної статті. СС: гістологічний аналіз та поради, а також перевірка остаточної статті. BM: аналіз зображень та поради, а також перевірка остаточної статті.
Конфлікт інтересів
DM був найнятий компанією Healthy Kitchen Christchurch Ltd. Інші автори заявляють, що дослідження проводилось за відсутності будь-яких комерційних або фінансових відносин, які можна трактувати як потенційний конфлікт інтересів.
- Оздоровчі рішення для медичної нутруційної терапії (МНТ)
- IV дієтотерапія; Slender Me Medical
- Ібупрофен, потенційна причина гострого геморагічного гастриту у дітей - звіт про випадок
- Епізод, що загрожує життю після прийому яєць жаб, повідомлення про випадок з оглядом літератури
- Дитячий амебіаз Звіт про випадок