Тератогенні ефекти одночасного введення флуоксетину та оланзапіну на плоди щурів
1 Факультет фармакології, Медичний факультет, Тегеранський університет медичних наук, вулиця Pour Sina, вулиця Qods, бульвар Кешаварз, Тегеран 1417613151, Іран
2 Кафедра анатомії, Медична школа Тегеранського університету медичних наук, Тегеран 1417613146, Іран
3 Школа медицини, Тегеранський університет медичних наук, Тегеран 1417613110, Іран
4 Кафедра нейрохірургії лікарні Шаріаті Тегеранського університету медичних наук, Тегеран, Іран
5 Департамент ветеринарних наук, Пізанський університет, Сан-П'єро-а-Градо, Піза 56122, Італія
Анотація
Об’єктивна. Депресія під час вагітності є відносно поширеною проблемою. Оскільки про тератогенні ефекти одночасного прийому флуоксетину та оланзапіну протягом періоду органогенезу відомо мало, метою цього дослідження було оцінити тератогенні ефекти одночасного прийому флуоксетину та оланзапіну на плоди щурів. Метод. Сорок дві вагітні щури були випадковим чином розділені на сім груп. Перша група отримувала 0,5 мл фізіологічного розчину в якості контролю. Друга та третя групи отримували флуоксетин у дозах 9 мг/кг та 18 мг/кг відповідно. Оланзапін вводили у дозі 3 мг/кг та 6 мг/кг четвертій та п’ятій групам відповідно. Шоста група отримувала 9 мг/кг флуоксетину та 3 мг/кг оланзапіну. Нарешті, сьомій групі вводили флуоксетин та оланзапін по 18 мг/кг та 6 мг/кг відповідно. Препарати вводили внутрішньочеревно між восьмим днем і 15 днем вагітності. На 17 день вагітності плоди були вилучені та мікро-/макроскопічно вивчені. Результати. Плоди щурів, які отримували високі дози цих препаратів, продемонстрували значну швидкість розвитку щілини піднебіння, передчасне розкриття століття та аномалії кручення порівняно з контрольною групою (
). Зроблено висновок, що ці препарати можуть призвести до тератогенності, тому слід уникати їх одночасного застосування під час вагітності або, якщо необхідно, їх дози слід зменшити.
1. Вступ
Одним з найбільш використовуваних антидепресантів є флуоксетин. Цей активний інгредієнт належить до класу СІЗЗС (селективні інгібітори зворотного захоплення серотоніну). Він підвищує рівень серотоніну в синаптичних щілинах і використовується для лікування депресії [1]. Він також використовується для обсесивно-компульсивного розладу (ОКР), поширеного захворювання посиленої тривожності, яке було діагностовано приблизно у 2% населення світу. Дисбаланс естрогену та прогестерону та його вплив на ліквор частково пояснюють частоту виникнення психологічних проблем, включаючи ОКР під час вагітності [2, 3]. Дослідники показали, що ОКР може бути спровокований під час періодів фертильності, таких як менструація, вагітність або час після пологів. Його швидкість можна зменшити за допомогою ранньої діагностики та відповідного лікування [4]. Мейна та його колеги продемонстрували прискорюючий ефект, який може мати ОКР при вагітності та пологах, що призводить до проблем після пологів як матері, так і дитини [5]. Лекман та його колеги виявили, що секреція окситоцину під час вагітності підвищує внутрішньомозковий тиск (ICP), а також може призвести до OCD [6].
Оланзапін - нетиповий антипсихотичний препарат для лікування шизофренії та інших маніакальних синдромів. У 2013 р. Дубовський повідомив, що одночасне застосування флуоксетину та оланзапіну має потенціюючий вплив на лікування депресії через їх синергічну дію [7]. Пояснення цього явища полягає в тому, що оланзапін стабілізує рівень серотоніну, який вже збільшився при лікуванні флуоксетином. Спільне введення оланзапіну та флуоксетину демонструє синергетичний ефект на внутрішньоклітинні шляхи виживання, що дозволяють зберігати молекули [8]. Слід уникати прийому ліків, що відпускаються за рецептом, під час вагітності, щоб не згубно впливати на розвиток плода; однак іноді це неможливо. Після катастрофи з талідомідом спостерігається значне збільшення уваги до тератогенних властивостей ліків під час вагітності. Хоча рецепт ліків під час вагітності зменшився, деякі ліки все ще можуть застосовуватися у вагітних жінок і можуть призвести до проблем у розвитку плода [9, 10].
У деяких випадках вагітні матері не знають про свою вагітність у перші місяці, якщо їм призначили флуоксетин та оланзапін, вони приймали їх, не пам’ятаючи про можливу небезпеку. Мета цього дослідження - дослідити тератогенні ефекти введення оланзапіну або флуоксетину або їх комбінованого застосування в різних дозах на розвиток плоду у вагітних щурів.
2. Матеріали та методи
2.1. Тварини
Випадковим чином відбирали здорових дорослих щурів NMRI жіночої та чоловічої статі (Морський медичний науково-дослідний інститут) із середнім віком приблизно три місяці та вагою 250–300 грам. Їх витримували при температурі
° С і вологість 70% і піддається дії 12 годин денного світла на добу з ad libitum доступ до їжі та води. Після спаровування та забезпечення успішного зачаття сорок дві вагітні щури були випадковим чином розділені на сім груп (
). Усі експерименти проводились у Тегеранському університеті медичних наук відповідно до рекомендацій Комітету з етики з експериментів на тваринах Медичної школи.
2.2. Наркотики
Наркотики були придбані у компанії Sigma-aldrich, США. Заздалегідь визначені дози препаратів вводили внутрішньочеревно щодня, між восьмим і п’ятнадцятим днем вагітності. Перша група отримувала 0,5 мл фізіологічного розчину в якості контролю. Друга та третя групи отримували флуоксетин у дозах 9 мг/кг та 18 мг/кг відповідно. Оланзапін вводили у дозі 3 мг/кг та 6 мг/кг четвертій та п’ятій групам відповідно. Шоста група отримувала 9 мг/кг флуоксетину та 3 мг/кг оланзапіну. Нарешті, сьомій групі вводили флуоксетин та оланзапін по 18 мг/кг та 6 мг/кг відповідно. На 17 день вагітності тварини були евтаназовані вдиханням СО2, а плоди вилучені за допомогою кесаревого розтину.
2.3. Макроскопічні та мікроскопічні дослідження
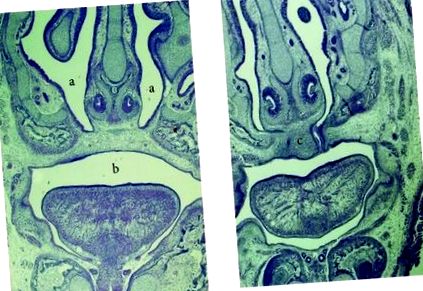
Плоди були обстежені на предмет макроскопічних відхилень. Також були підготовлені гістопатологічні слайди плодів. Після фарбування гематоксиліном та еозином за допомогою оптичного мікроскопа відзначали будь-які мікроскопічні зміни у плодів. Позиційні аномалії (аномальна форма тіла або не у формі С), аномалії кінцівок (зігнуті кінцівки) та структурні дефекти (одностороння або двостороння щілина піднебіння та не зрощені повіки) розглядалися як аномальні плоди [11].
2.4. Статистичний аналіз
Дані аналізували за допомогою статистичного програмного забезпечення GraphPad Prism версії 5. Точний тест Фішера використовували для встановлення значущості варіацій між кількістю аномальних плодів у різних групах. Відмінності вважалися значними на .
3. Результати
). † Значуще при аномальних плодах груп O3 та O6 (
4. Обговорення
Після трагедії талідомідів вчені усвідомили важливість врахування тератогенної дії препаратів, що вводяться під час вагітності [10]. Препарати з низькою тератогенністю не впливають на більшість вагітних жінок, але в деяких випадках можуть бути шкідливими. Частота депресії зростає під час вагітності, і можна розглянути можливість застосування флуоксетину.
У цьому експерименті ми використовували флуоксетин у дозах 9 мг/кг та 18 мг/кг та оланзапін у дозах 3 мг/кг та 6 мг/кг. Поланд та ін. повідомили, що флуоксетин у дозі 12,5 мг/кг може проходити через плаценту та розподілятися у плода в періоди органогенезу у щурів [11]. Vorhees та ін. показали, що введення флуоксетину в дозі 12 мг/кг спричиняло втрату ваги матері під час вагітності, зменшення розміру посліду при народженні та збільшення смертності новонароджених [12]. Кабрера-Віра та ін. показали, що пренатальний вплив флуоксетину (10 мг/кг) може спричинити обмежені зміни в серотонінергічних нейронах мозку у щурів [13]. І навпаки, Берд та Маркхем не виявили тератогенності у плодів щурів, яким вводили флуоксетин у дозах 12,5 мг/кг і нижче [14]. У нашому експерименті ми вибрали дози 9 та 18 мг/кг для флуоксетину, грунтуючись на вищезазначених дослідженнях.
У 2002 році Розенгартен та Квартермейн вводили оланзапін у терапевтичній дозі 2 мг/кг/день вагітним щурам [15]. У 1998 р. Li et al. продемонстрували, що оланзапін у дозах 0,5, 3 та 10 мг/кг, введений підшкірно, надає фармакологічний ефект через підвищення рівня позаклітинного дофаміну та норадреналіну в мозку щурів [16]. Аравагірі та ін. у 1999 р. вивчав фармакокінетику та розподіл тканин оланзапіну у щурів. Вони провели свій експеримент із застосуванням стандартних доз 0,25, 1, 3 та 6 мг/кг/добу внутрішньочеревно [17]. Дози 3 і 6 мг/кг оланзапіну в цьому дослідженні були обрані на основі попередніх експериментів, і ці дози спричинили деякі аномалії у плодів щурів. Терапевтичні дози флуоксетину та оланзапіну для використання людиною становлять 0,25-1 мг/кг/день та 0,1-0,25 мг/кг/день відповідно. Оскільки метаболізм щурів набагато ефективніший, ніж у людей, ми застосовували більші дози, ніж у людей.
Гольдштейн та ін. у 1997 р. та Oberlander et al. у 2004 р. повідомив, що більшість селективних інгібіторів зворотного захоплення серотоніну, особливо медичні дози флуоксетину, не мають тератогенних ефектів [18, 19]. Багато клінічних аналізів показали подібні результати [20, 21]. У цьому дослідженні ми також не виявили специфічного ефекту флуоксетину.
Мойсей-Колко та ін. у 2005 р. опублікував огляд літератури про фетотоксичні ефекти деяких СІЗЗС [22]. Каспер та співавт. у 2003 р. Cissoko та його колеги у 2005 р. та Gentile у 2005 р. також згадали про ці тератогенні ефекти [23–25]. Деякі аналізи повідомляють, що високі дози СІЗЗС, такі як флуоксетин, мають потенційний шкідливий вплив на дозрівання плоду, але вони не надають достатньої інформації про початок та тривалість цих побічних ефектів [26–29]. Дослідження показали, що спільне введення флуоксетину та оланзапіну корисно для лікування стійкої депресії [30]. Тривалий період напіввиведення флуоксетину та його активного метаболіту (диметилфлуоксетин) підвищує ймовірність лікарської взаємодії навіть після припинення лікування [31–33].
5. Обмеження вивчення
Оскільки окремі цуценята не є незалежними, а належать до послідів, проблема залежності всередині послідів може розглядатися як обмеження цього дослідження. Подальші дослідження з більшими розмірами вибірки з використанням ієрархічного аналізу дисперсій між послідами та всередині посліду можуть призвести до більш надійних результатів. Відмінності в обміні речовин між щурами та людьми та різниця в дозах у цих видів також є обмеженням цього експерименту.
6. Висновки
Це дослідження проводили на щурах, тому слід бути обережним при екстраполяції цих даних на людей. З цього застереження можна зробити висновок, що через потенційний тератогенний ефект флуоксетину та оланзапіну, а також інгібуючу дію флуоксетину на метаболізм та елімінацію оланзапіну слід уникати одночасного прийому цих препаратів під час вагітності або, якщо необхідно, їх дози слід зменшився.
Конфлікт інтересів
Жоден з авторів цієї статті не має фінансових або особистих стосунків з іншими людьми чи організаціями, які могли б неналежним чином вплинути на зміст статті або упереджити її.
Подяка
Це дослідження було засноване та підтримане Тегеранським університетом медичних наук (TUMS), грант No. 15614-61-04-90. Дякуємо доктору Х. Оуену (Квінслендський університет) за її неоціненну редакційну допомогу.
Список літератури
- Редуктил - дозування огляду препарату, побічні ефекти, дія, купити Редуктил
- Налтрексон-Бупропіон перорально, побічні ефекти, взаємодії, зображення, попередження; Дозування - WebMD
- Реглалан Застосування, дозування; Побічні ефекти
- Назальний спрей (оксиметазолін) Назальне використання, побічні ефекти, взаємодії, зображення, попередження; Дозування -
- Remedy Phytoplex Moisturizer Тематичне використання, побічні ефекти, взаємодії, картинки, попередження; Дозування