Теплоємність
Теплоємність це здатність матеріалу поглинати тепло, не відображаючи все це безпосередньо як підвищення температури. Вам слід прочитати розділи про тепло і температуру як тло, і розділ про воду теж допоможе.
Оскільки тепло додається рівномірно до подібних кількостей різних речовин, їх температура може зростати з різною швидкістю. Наприклад, метали,
добре провідники тепла, показують швидке підвищення температури при нагріванні. Нагріти метал порівняно легко, поки він не світиться червоним. З іншого боку, вода може поглинати багато тепла при відносно невеликому підвищенні температури. Ізоляційні матеріали (ізолятори) є дуже поганими провідниками тепла і використовуються для ізоляції матеріалів, які потрібно зберігати при різних температурах - наприклад, всередині вашого будинку ззовні.
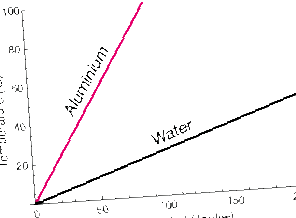
Речовини, що поглинають однакову кількість тепла, можуть мати різне підвищення температури.
Цей графік показує підвищення температури, оскільки тепло додається з однаковою швидкістю до рівних мас алюмінію (Al) та води (H2O). Температура води підвищується набагато повільніше, ніж температура Al.
У металі атоми Al мають лише поступальну кінетичну енергію (хоча цей рух сильно пов'язаний із сусідніми атомами). Вода, навпаки, може також обертатися і вібрувати. Ці ступені свободи рух може поглинати кінетичну енергію, не відображаючи її як підвищення температури речовини.
Розподіл енергії
Більшість речовин підкоряються закону Росії рівноділ енергії в широкому діапазоні температур. Закон говорить, що енергія, як правило, розподіляється рівномірно між усіма ступенями свободи молекули — перенесення, обертання та вібрації. Це має наслідки для речовин з більшою чи меншою кількістю атомів. На діаграмі нижче кожен контейнер відображає ступінь свободи. Ситуації для 3-атомного та 10-атомного
показано молекулу. Якщо до кожної молекули додати однакову загальну кількість теплової енергії, 3-атомна молекула отримує більше енергії в поступальних ступенях свободи. Оскільки 10-атомна молекула має більше коливальних режимів, в яких зберігається кінетична енергія, менше доступно для переходу в поступальні режими, і в основному ми вимірюємо поступальну енергію температури.
Питома теплоємність
Залишилось ще одне вдосконалення теплової потужності. Очевидно, що кількість тепла, необхідне для підвищення температури великої кількості речовини, перевищує кількість, необхідну для невеликої кількості тієї ж речовини.
Для контролю кількості, як правило, ми вимірюємо та повідомляємо теплову потужність як питоме тепло, теплоємність на одиницю маси.
Конкретні нагрівання великої кількості речовин вимірювались у різних умовах. Вони записані в онлайнових книгах.
Зазвичай ми вибираємо одиниці Дж/грам або КДж/кг. Питома теплоємність рідкої води становить 4,184 Дж/г, що також становить 4,184 КДж/кг. Калорія - це одиниця тепла, яка визначається як кількість тепла, необхідна для підвищення температури 1 см 3 води на 1ЛљС.
Питома теплоємність
Питома теплоємність - теплоємність на одиницю маси.
Питома теплоємність води становить 1 кал/гЛљC = 4,184J/гЛљC
Розрахунок змін тепла та температури
Спека, q, необхідний для підвищення температури маси, м, речовини за кількістю ΔT є
$$ q = mC \ Delta T = mC (T_f - T_i) $$
де C. - питома теплоємність і Tf і Ti - це кінцева та початкова температури.
Нахил графіку температури проти тепла, доданого до одиниці маси, становить лише 1/C.
Використовуючи цю формулу, порівняно легко розрахувати додану теплоту, кінцеву або початкову температуру або саме питоме тепло (саме так воно вимірюється), якщо відомі інші змінні.
Тепло додається для досягнення зміни температури
Спека q додають або еволюціонують для зміни температури маси м речовини з питомою теплоємністю C. є
$$ q = mC \ Delta T = mC (T_f - T_i) $$
Одиниці питомої теплоємності зазвичай складають Дж/моль · K (J · · моль -1 K -1) або J/g · K (J · · g -1 · K -1). Пам’ятайте, що можна sC поміняти на K, оскільки розмір градусів Цельсія та Кельвіна однакові.
Приклад 1
Розрахуйте кількість тепла (в джоулях), необхідну для зміни температури 1 літра води (1 л = 1 кг) від 20ЛљС до 37ЛљС.
Питома теплоємність (С) води становить 4,184 Дж/гЛљC (або Дж/г · К - якщо ми працюємо з градусами Цельсія або Кельвінами, ΔT буде однаковим, оскільки розмір двох однаковий. Це Фаренгейт, що є меншим за ступенем). Нам потрібно рівняння:
Підключивши 1000 г до маси 1 л води (грам визначається як маса 1 мл води) і зміни температури (37 ° C - 20 ° C), отримуємо:
$$ = (1000 \, г) \ ліворуч (4.185 \ frac \ right) (37 - 20) ЛљC $$
$$ = 71128 \; J = \ bf 71 \; KJ $$
Коли кількість Джоулів енергії перевищує 1000, ми, як правило, виражаємо кількість в КілоДжоулях (КДж), щоб спростити число.
Попрактикувати проблеми
(Використовуйте таблицю нижче, щоб знайти відсутні специфічні теплоти.)
| 1. | Скільки тепла (в джоулях) потрібно для підвищення температури 100 г H2O з 22ЛљС до 98ЛљС? | Рішення |
| 2. | Якщо для підвищення температури 100 г речовини на 25ЛљС (без зміни фази) потрібно 640 Дж теплової енергії, розрахуйте питому теплоту речовини. | Рішення |
| 3. | Якщо до 100 мл етанолу [щільність (ρ) = 789 кг · м -3] спочатку при 10 ° C додати 80 Дж тепла, розрахуйте кінцеву температуру зразка. | Рішення |
Рішення завдання 1
Розв’язання задачі 2
Переставте рівняння теплоти, щоб розв’язати для C:
$$ q = mC \ Delta T \; \ longrightarrow \; C = \ frac $$
Примітка: під час обчислення ΔT, 'OK' використовувати градуси Цельсія або Кельвіни, оскільки розмір, а отже і будь-яка різниця, будуть однаковими. Однак все це розпадається з Фаренгейтом.
Розв’язання задачі 3
Спочатку переставте рівняння теплоти, щоб визначити остаточну температуру.
$$ \ begin q = mC \ Delta T \; & \ longrightarrow \; T_f - T_i = \ frac \\ & \ longrightarrow T_f = \ frac + T_i \ end $$
Тепер обчисліть кількість грамів етанолу, використовуючи щільність, і обережно стежте за одиницями вимірювання.
Тепло (ентальпія) зміни фази
. або, що, якщо ми нагріваємо або охолоджуємо через температуру зі зміною фази
Фазові зміни є великим джерелом або стоком тепла. Ось, наприклад, крива нагріву води.
Він показує підвищення температури, оскільки тепло додається до води з постійною швидкістю. Ось що відбувається в регіонах A-E:
A. До твердої води (льоду) при температурі нижче 0ЛљС додається тепло, і температура її зростає з постійною швидкістю.
B. Твердий лід розтоплюють до рідкої води. Під час додавання прихованої теплоти плавлення (ΔHf), підвищення температури не спостерігається, але водневі зв’язки, що утримують лід, розриваються.
C. До рідкої води, що перевищує 0ЛљС, додається тепло, і її температура постійно зростає до температури кипіння при 100ЛљС.
D. Вода при температурі 100 ° C поглинає велику кількість теплової енергії при температурі 100 ° C, переживаючи фазовий перехід від рідини до газу. Це прихована теплота випаровування, ΔHv, енергія, необхідна для того, щоб вода не мала більше когезійної сили.
Е. Нарешті, газоподібна вода вище 100 ° C поглинає тепло, збільшуючи свою температуру з постійною швидкістю. Після цього у води більше немає фазових переходів.
Порівняно великі привабливі міжмолекулярні сили між молекулами води дають воді дуже високі теплоти плавлення та випаровування. Порівняно з більшістю інших речовин, для розтоплення водяного льоду та кип’ятіння або випаровування води потрібна велика кількість тепла.
Ентальпії плавлення та випаровування представлені в таблиці і їх можна переглянути. Сторінка сполуки у Вікіпедії, як правило, є гарним місцем для їх пошуку. Нижче ми зробимо приклад розрахунку теплоти, коли температура речовини підвищується через фазову зміну.
Згуртовані сили
Когезійні сили - це сили, що утримують речовину разом. Коли вода потрапляє на воскоподібну або гідрофобну поверхню, вона утворює маленькі сферичні краплі - «намистинки». Ці кульки води мінімізують контакт з поверхнею та повітрям і максимізують контакт води з собою. Рідка вода дуже згуртована. Він утворює переривчасті, але відносно міцні зв’язки з собою.
Інші речовини, такі як CO2, не мають таких сильних міжмолекулярних привабливостей і не утворюють рідин або твердих речовин, якщо вони не дуже холодні або під дуже високим тиском.
Тепло фазового переходу
Тепло, поглинене або виділене при фазовому переході, обчислюється множенням ентальпії випаровування, ΔHv, або ентальпія плавлення, ΔHf за кількістю родимок речовини:
$$ \ begin q & = m \, \ Delta H_f \\ [5pt] q & = m \, \ Delta H_v \ end $$
Ентальпію плавлення часто називають "прихованою теплою плавлення", а ентальпію випаровування - "прихованою теплою випаровування".
Одиниці ΔHf і ΔHv є Джоулі/моль (Дж · моль -1) або Дж/г (Дж · г -1).
Приклад 2
Обчисліть кількість тепла, необхідного для нагрівання 18 г льоду від -20ЛљС до води при 25ЛљС.
Рішення: Є фазовий перехід води в цьому діапазоні температур, тому ця проблема складатиметься з трьох етапів:
- Підніміть температуру льоду з -20ЛљС до температури плавлення, 0ЛљС, використовуючи питому теплоту льоду, С = 2,010 ДжВ · г -1 К -1 .
- Перетворіть лід у воду при 0ЛљС, використовуючи молярну ентальпію плавлення, ΔHf = 333,5 Дж · г -1 .
- Підняти температуру рідкої води з 0ЛљС до 25ЛљС, використовуючи питому теплоємність води, С = 4,184 Дж/г -1 К -1 .
Ось розрахунки для кожного з наших кроків:
Крок 1: Кількість тепла, необхідна для підвищення температури льоду (до його танення) на 20Л byС, становить:
Зверніть увагу, що ми перевели температуру Цельсія в кельвін.
Крок 2: Кількість тепла, необхідного для розплавлення 18 г льоду, становить:
Крок 3: Кількість тепла, необхідна для підвищення температури рідкої води на 25ЛљC, становить:
Складаючи всі ці енергії, ми отримуємо загальну, q = 2642 Дж,
Тепер давайте порівняємо це з подібним розрахунком, але цього разу ми нагріємо рідку воду до температури кипіння до газу.
Приклад 3
Обчисліть тепло, необхідне для підвищення температури 18 г рідкої води при Ti = 80ЛљС до пари при 125ЛљС.
Рішення: Це також триступенева проблема, але цього разу ми випробовуємо воду. Ось кроки:
- Підніміть температуру рідкої води з 80 љC до температури кипіння, 100 љ C, використовуючи питому теплоту води, C = 4,184 Дж/г -1 K -1 .
- Перетворіть воду в пару (газоподібну воду) при 100 ° C, використовуючи молярну ентальпію випаровування, ΔHf = 2258 Дж/г -1 .
- Підніміть температуру пари від 100 љC до 125 љC, використовуючи питому теплоту пари, C = 2,010 Дж/г -1 K -1 .
Ось розрахунки для кожного з наших кроків:
Крок 1: Кількість тепла, необхідна для підвищення температури води (до її випаровування) з 80 ° C до 100 ° C, становить:
Крок 2: Перетворіть рідку воду на пару при 100 ° C. Тут ми використовуємо тепло випаровування води:
Крок 3: Нарешті, ми розрахуємо кількість тепла, необхідну для зміни температури 80 г пари від 100 ° C до 125 ° C:
Майже там. Останній крок - скласти всі ці енергії разом:
Зверніть увагу, що найбільший внесок у цю енергію, безумовно, полягає у випаровуванні води - перетворенні її з рідини на газ. Цей процес вимагає величезної кількості енергії, і на цю енергію припадає велика кількість енергії, яка потрібна для кип’ятіння води для отримання пари в електростанціях усіх видів (включаючи атомну), а також на ефективні засоби, якими людина охолоджує наше тіло: піт.
Попрактикувати проблеми
(Скористайтеся таблицею нижче, щоб знайти відсутні специфічні нагрівання; у задачах наведено теплота плавлення або випаровування).
| 1. | Скільки тепла (у джоулях) потрібно, щоб 120г льоду при -10ЛљС змінити воду на 37ЛљС? (ΔHf = 334 КДж · кг -1)? Зверніть увагу, що це триступенева проблема: спочатку нагрійте лід до 0 ° C, потім перетворіть всі 120 г у рідину, а потім підніміть температуру води до 37 ° C (температуру людського тіла). | Рішення |
| 2. | Скільки теплоти виділяється, коли 1 кг пари при 300 љC охолоджується до рідини при 40 љ C? (ΔHv = 2260 КДж · кг -1) | Рішення |
| 3. | Чи достатньо тепла в 100 мл води при 25 ° C, щоб повністю розплавити 50 г льоду при температурі 0 ° C? (ΔHf = 334 КДж · кг -1) | Рішення |
Рішення завдання 1
Спочатку розрахуйте тепло, необхідне для підвищення температури води з 10ЛљС до 0ЛљС
Тепер перетворіть 120 г льоду при 0ЛљС у рідку воду при 0ЛљС:
Нарешті, підняти температуру води до 37 ° C, і скласти енергії:
$$ q_ = 2352 \, J + 40080 \, J _ 18577 \, J = 61 \; KJ $$
Зверніть увагу, що більша частина енергії йде на руйнування регулярної кристалічної решітчастої структури льоду (його плавлення).
Розв’язання задачі 2
Охолодити пару від 300 љC до 100 љC.
Перетворіть пару в рідину при 100 ° C.
Охолодити рідину від 100 љC до 40 љC.
Нарешті, додайте втрачене тепло.
$$ q_ = 416 + 2260 + 251 = 2927 \; КДж = 2,9 \; MJ $$
Розв’язання задачі 3
По-перше, скільки тепла нам потрібно, щоб розтопити стільки льоду при 0ЛљС?
$$ q = m \ Delta H_f = (50 \, г) (334 \, Дж/г) = 16 700 \; J $$
Тепер розрахуйте кількість тепла, що виділяється 100 мл води, коли вона охолоджується до 0ЛљC:
У цій воді недостатньо тепла, щоб розтопити стільки льоду.
Специфічна теплоємність вибраних сполук
| Водяний лід (H2O) | 2.11 |
| Водна рідина | 4.184 |
| Водяний газ | 2.08 |
| Алюміній (и) (Al) | 0,897 |
| Мідь (і) (Cu) | 0,385 |
| Залізо (и) (Fe) | 0,450 |
| Свинець (и) (Pb) | 0,129 |
| Метанол (л) (CH3OH) | 2.14 |
| Етанол (л) (C2H5OH) | 2.44 |
| Етиленгліколь (л) (C2O2H6) | 2.2 |
| Водень (г) (H2) | 14.267 |
| Бензол (л) (C6H6) | 1.750 |
| дерево (типове) | 1,674 |
| скло (типове) | 0,867 |
Доопрацювання: Cp та Cv
До цього часу, щоб зробити речі простими, я мав на увазі конкретне тепло C.. Але теплоємність (питома теплоємність, якщо вона на моль або на грам) може змінюватися залежно від того, чи підтримуються термодинамічні змінні тиску або температури постійними під час нагрівання чи охолодження.
Як правило, в лабораторії ми працюємо при постійному тиску - атмосферному, отже Cp - це найбільш часто використовувана питома теплоємність.
У системах з постійним об'ємом, наприклад у газовому балоні, де тиск може змінюватися, але об'єм не може, ми використовуємо теплоємність при постійному обсязі, Резюме.
Відносна теплоємність - Cp води висока
Однією з найцікавіших і найважливіших речей у воді є її висока питома теплоємність порівняно з іншими молекулами її розміру. Він аномально високий, і вважається, що ця особливість кількома способами пов’язана із зародженням життя на Землі. Унікальність води в цьому сенсі частково є тим, чому ми шукаємо воду на інших планетах і супутниках, коли шукаємо ознаки позаземного життя.
Приклад збереження енергії
10 г льоду при -10 љC додають до 100 г води при 50 љC. Обчисліть кінцеву температуру цієї суміші, як тільки лід розтане і температура врівноважиться. Не допускати обміну теплом із оточенням (адіабатичні умови).
Ця проблема вирішується за допомогою принципу збереження енергії. Якщо навколишнє тепло не втрачається, і жодному не дозволяється потрапляти в систему, тоді все тепло, що використовується для розтоплення льоду та нагрівання отриманої рідини, має надходити з води 50ЛљС.
Тепло, втрачене водою = тепло, отримане льодом
Однією з поширених проблем з вирішенням подібних проблем є ведення бухгалтерії - відстеження ознак втрат тепла та виграшу тепла. Ви будете мати кращі результати, якщо будете працювати так:
Тепло, втрачене водою, становить
$$ \ begin q & = m C \ Delta T \\ & = (100 \, g) \ зліва (4.184 \ frac \ right) (T_f - 50) ЛљC \\ & = 418.4 \, T_f - 20920 \ end $ $
де Tf - невідома кінцева температура.
Тепло, отримане льодом, включає тепло, щоб довести температуру твердої речовини до 0ЛљC, тепло, необхідне для її плавлення, і тепло, щоб довести її до кінцевої температури, Tf.
Тепер, якщо ми додамо тепло, втрачене водою, до тепла, отриманого льодом, і встановимо суму, рівну нулю, отримаємо:
$ 418,4 T_f - 20920 + 211 + 3340 + 41,84 T_f = 0 $$
Тоді ми збираємо подібні терміни і вирішуємо остаточну температуру:
$$ \ begin 460.24 \, T_f & = 20920 - 211 - 3340 \\ \ bf T_f & = 37.7 ЛљC \ end $$
Ця температура має сенс. Вода охолоджувалась, коли танула лід, але не надто сильно, оскільки води в 10 разів більше за масою.
- Непряме нагрівання - простий спосіб смажити рибу на грилі; Партнерство з харчування морепродуктів
- Тепло - Відновлювані джерела енергії 2019 - Аналіз - МЕА
- Тепло і родючість чоловіків WINРодючість
- Скільки калорій тепла потрібно для підвищення температури води з 10
- Управління діабетом у ЦДЗ "Тепловий діабет"