Src-залежна, опосередкована нейтрофілами судинна гіперпроникність та модифікація β-катеніну
1 Кафедри хірургії та медичної фізіології, Інститут серцево-судинних захворювань, Техаський науковий центр охорони здоров'я університету A&M, Темпл, Техас 76504
1 Кафедри хірургії та медичної фізіології, Інститут серцево-судинних захворювань, Техаський науковий центр охорони здоров'я університету A&M, Темпл, Техас 76504
1 Кафедри хірургії та медичної фізіології, Інститут серцево-судинних захворювань, Техаський науковий центр охорони здоров'я університету A&M, Темпл, Техас 76504
1 Кафедри хірургії та медичної фізіології, Інститут серцево-судинних захворювань, Техаський науковий центр охорони здоров'я університету A&M, Темпл, Техас 76504
Анотація
ендотелій судин служить ефективним бар’єром для контролю трансавалярного проходження розчинених речовин, рідини та клітин крові. Зміни бар’єрної функції пов’язані з тромбогенезом, ангіогенезом, запаленням та ішемічно-реперфузійною травмою. Зв'язування агоністів запалення та клітин з ендотеліальними клітинами викликає безліч внутрішньоклітинних сигналів, що може призвести до збільшення проникності ендотелію (12, 19, 30, 34). Взаємодія актоміозину породжує скорочувальні сили, які розтягують тісно пов’язані між собою ендотеліальні клітини, що призводить до високомолекулярного відтоку. Трансмембранний адгезивний білок, який називається судинним ендотеліальним (VE) -кадгерином, утворює ендотеліальні зчеплені з’єднання (AJ), які інгібують парацелюлярний витік макромолекул. Коли рівновага між цими адгезивними і скорочувальними силами змінюється, виникає дисфункція бар’єру та витік.
Попередні дослідження показали, що група запальних клітин, поліморфно-ядерні лейкоцити (ПМН), приєднуються і мігрують через ендотелій в навколишні тканини в місцях пошкодження або запалення, і що цей процес пов'язаний із збільшенням проникності (1, 2, 35). Ми продемонстрували, що ПМН-індукована гіперпроникність відбувається одночасно зі збільшенням фосфорилювання тирозину VE-кадгерину та β-катеніну, важливого члена сімейства білків, що пов'язує комплекс кадгерину з цитоскелетом актину (14, 16, 27). Нещодавно дослідження показали очевидний зв’язок між β-катеніном та тирозинкіназами сімейства Src (Src) (17). Відомо, що кінази Src відіграють роль у передачі сигналів про трансдукцію дисфункції ендотеліального бар’єру та ангіогенезі (9, 13, 15, 24). Активність Src регулюється фосфорилюванням тирозину при Tyr416, який підвищує регуляцію кінази, та Tyr527, що робить Src менш активним (24).
Хімічні речовини та наркотики.
Використовуваними хімічними речовинами були людський рекомбінантний C5a та оксид феніларсину (PAO; Sigma), SRCi та PP1 (Calbiochem), поліклональний анти-Src та поліклональний анти-β-катенін (Santa Cruz), поліклональний антифосфо-Src (Tyr416) та (Tyr527) (Клітинна сигналізація) та поліклональний антифосфотирозин (Трансдукція). SRCi [Ac-Tyr (PO3H2) -Tyr (PO3H2) -Tyr (PO3H2) -Ile-Glu-OH] конкурує за зв'язування з доменами SH2 (31). Негативним контрольним пептидом був [Ac-Asp-Ser (PO3H2) -Thr (PO3H2) -Val-Ser (PO3H2) -OH].
Виділення та перфузія мікросудин.
Аналізи ендотеліальних клітин.
Виділення нейтрофілів.
Свинячих нейтрофілів (ПМН) виділяли, як описано раніше (27). Для активації PMN піддавали впливу людського рекомбінантного C5a (10−8 M). В ізольованих препаратах венул ПМН додавали у суфузійну ванну, а у випадку досліджень HUVEC - безпосередньо на моношарі, в обох випадках у концентрації 10 6/мл. Попередні дослідження показали, що C5a впливає на функцію ендотелію через нейтрофільно-залежні шляхи, проте сам по собі не впливає на проникність (27).
Трансфекція білка.
Для трансфекції венул SRCi судини перфузували протягом 1 год пептидом при 10 мкг/мл у присутності реагенту для трансфекції поліаміну ТрансIT-LT1 (PanVera) при 10 мкл/мл. Попередні дослідження трансфекції із використанням зеленого флуоресцентного білка та різних інгібуючих пептидів показали, що це є підходящим способом введення білків/пептидів у інтактні мікросудини (28). Крім того, ТрансСам по собі IT-LT1 не має очевидного впливу на проникність мікросудин та вазореактивність (28). Для трансфекції HUVEC, SRCi та ТрансIT-LT1 додавали до клітинного середовища з однаковими концентраціями, і трансфекцію дозволяли продовжувати протягом 1 години. Попередні дослідження показали успішну трансфекцію білка ендотеліальних клітин за допомогою цієї методики (26).
Аналіз даних.
В дослідженнях імуноблот було обрано репрезентативне зображення вестерн-плям для представлення. Для кожного втручання проводили щонайменше три повтори, і оптичну щільність білкових смуг усереднювали. Дисперсійний аналіз використовували для оцінки значущості міжгрупових відмінностей в імуноблот-аналізі та дослідженнях проникності. Значення P 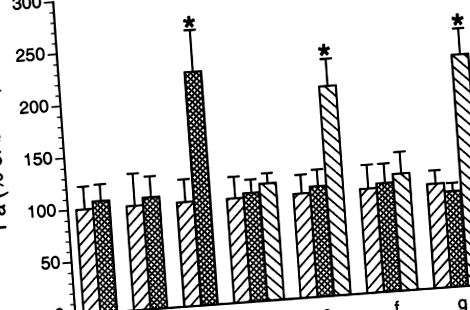
Рис. 1.Поліморфно-ядерні лейкоцити (ПМН), індукована венулярною гіперпроникністю. Венули перфузували альбумін-фізіологічним розчином солі (APSS), і коефіцієнт базальної проникності альбуміну (Па) визначали протягом 1 години (перший бар у кожній групі). Результати виражаються у відсотках від базальних. Лікування було таким: a: неактивований свинячий PMN (10 6/мл),b: C5a (10 -8 М), c: C5a активований PMN, d: SRCi трансфікований протягом 1 год з подальшим активацією C5a PMN, e: пептид негативного контролю, трансфікований протягом 1 год з подальшою активацією C5a ПМН, f: PP1 (10-6 М), після чого активований C5a PMN, та g: DMSO (0,05%) з подальшим активацією C5a PMN. Значення є середніми ± SE. * Значне збільшення базальної проникності,P
Індукована ПМН гіперпроникність у культивованих ендотеліальних клітинах.
Щоб визначити, що реакція проникності моношарів ендотеліальних клітин узгоджується з реакцією інтактних венул, HUVEC піддавались активованим PMN після трансфекції SRCi або пептидом негативного контролю або впливу PP1. Як показано на фіг.2b, активовані ПМН індукували значні реакції гіперпроникності вище рівня контролю. Крім того, супернатант, отриманий після центрифугування активованих ПМН, мав подібний вплив на проникність (рис. 2c). Однак SRCi повністю скасував це збільшення проникності (рис. 2e). Трансфекція пептиду негативного контролю не блокувала ПМН-індуковану гіперпроникність (рис. 2g). За погодженням із ефектом SRCi, PP1 також блокував ПМН-індуковану гіперпроникність (рис. 2i), тоді як транспортний засіб DMSO не мав ефекту (рис. 2k).
Рис.2.Реакція гіперпроникності в ендотеліальних клітинах пупкової вени людини (HUVEC). Лікування було таким: a: контроль, b: С5а активований свинячий ПМН (10 6/мл),c: супернатант від активованого ПМН, d: SRCi,e: SRCi з подальшим активованим PMN, f: пептид негативного контролю, g: пептид негативного контролю з подальшим активованим ПМН, h: PP1 (10-6 М), i: PP1 (10-6 М) з подальшим активованим PMN, j: DMSO (0,05%) та k: DMSO з подальшим активованим PMN. Па вимірювали через 30 хв, і результати виражали як відсоток контролю. Значення є середніми ± SE. * Значне збільшення проникності, P
Фосфорилювання тирозину Src.
Як зазначалося раніше, Src є тирозинкіназою, яка сама регулюється фосфорилюванням тирозину. Використовуючи HUVEC, ми показуємо, що активовані ПМН та ПАО (інгібітор тирозин фосфатази) індукують фосфорилювання Src на Tyr416 (рис. 3A,смуги 4 і 7), умова, як відомо, активує Src. Це фосфорилювання Tyr416 послаблювалось у клітинах, які були трансфіковані SRCi (рис. 3A, смуги 6 і8). Малюнок 3B, смуги 4 і7, показує, що коли Src активується PMN або PAO, фосфорилювання в Tyr527 знижується. Інтенсивність смуги з трьох різних експериментів була отримана за допомогою скануючої денситометрії з подальшим кількісним визначенням за допомогою програмного забезпечення зображень Національного інституту охорони здоров’я. Ці дані показали, що зміни фосфорилювання Src Tyr416 та Tyr527 у відповідь на активовані ПМН та ПАО суттєво відрізняються від змін рівня контролю (рис. 3,D і Е). Кількість Src, присутніх у клітинах, суттєво не змінюється за будь-яких умов тесту (рис. 3C.).
Рис.3.Фосфорилювання Src у HUVEC. Лікування було таким: 1: контроль, 2: C5a (10 -8 М), 3: PMN (10 6/мл), 4: C5a активований PMN (10 6/мл), 5: SRCi трансфікований протягом 1 год,6: SRCi з подальшим активованим PMN (10 6/мл),7: феніларсин оксид (ПАО) (10−8 М), і8: SRCi з наступним PAO (10−8 М). Процедури тривали протягом 10 хв. Після лізису клітин 10 мкг білка від кожної обробки піддавали Вестерн-аналізу на 6% гелі PAGE. Використовувані антитіла були такими: A: антифосфо Src (Tyr416), B: антифосфо Src (Tyr527), та C.: анти-Src. D і Е: смуги від A іB, відповідно, були визначені кількісно за допомогою скануючої денситометрії та Src Tyr416 (D) і Tyr527 (Е) фосфорилювання виражалося як відсоток контролю. Ці експерименти повторювали 3 рази. Значення є середніми ± SE. *P
Активація Src та β-катеніну.
Рис.4.локалізація β-катеніну в HUVEC. A: контрольні клітини;B: клітини, що піддаються дії PM5, що активується C5a; C.: супернатант від активованого C5a ПМН; D: PP1 (10-6 М) з подальшим активованим PMN; Е: SRCi трансфікований протягом 1 год; F: SRCi з подальшим активацією C5a PMN; G: Вплив PM5, що активується C5a, промити PBS, повернути до повного середовища на 1 год; і H: пептид негативного контролю з подальшим активацією C5a ПМН. Після фіксації та проникнення клітини інкубували з анти-β-катеніновим первинним антитілом з подальшим кон'югованим з FITC вторинним антитілом. Зверніть увагу на утворення щілини та втрату β-катеніну в місцях, де клітини втратили контакт B,C., і H.
Рис.5.Індукована PMN асоціація Src/β-катеніну в HUVEC. ДляA і B, лікування було наступним:1: контроль, 2: C5a активований ПМН (10 6/мл) та 3: SRCi трансфікований протягом 1 год з подальшим активацією C5a ПМН (10 6/мл). Після обробки ПМН протягом 10 хв для імунопреципітації Src використовували 100 мкг білка. Імунопреципітати піддавали західному аналізу та досліджували або β-катенін (A) або Src (B). ДляC., D, і Е, лікування було наступним: 1: контроль, 2: C5a активований ПМН (10 6/мл), 3: SRCi трансфікований протягом 1 год з подальшим активацією C5a PMN (10 6/мл) та 4: Трансфекція SRCi. Після обробки ПМН протягом 10 хв 100 мкг білка використовували для імунопреципітації β-катеніну з подальшим імуноблотуванням фосфотирозином (C.) або імунопреципітація фосфотирозином з подальшим імуноблотінгом β-катеніну (D). В Е, 15 мкг загального клітинного білка використовували для імуноблотингу β-катеніну.
Наші попередні дослідження показали остаточний вплив ПМН на ендотелій судин із використанням як інтактних мікросудин, так і культивованих клітин, в яких активовані ПМН викликають фосфорилювання та конформаційні зміни білків AJ у поєднанні з утворенням міжклітинної щілини (27,35). Однак сигнальні події, що відбуваються між адгезією ПМН та зміною AJ, недостатньо зрозумілі. Це дослідження вперше пов'язує відомий шлях передачі сигналів Src з цими процесами. Ми знаємо, що щодо тирозинкіназ Src, які мають шість функціональних доменів, фосфорилювання Tyr527 та взаємодії між доменами SH2 та SH3 стабілізують неактивну форму Src (21). І навпаки, фосфорилювання Tyr416 в активуючій петлі домену кінази активує Src (21). Інші продемонстрували вимогу Src до проникності судин у відповідь на фактор росту судинного ендотелію (9). Наші результати чітко показують, що ПМН-індукована гіперпроникність як у мікросудинах, так і в ендотеліальних клітинах може значно послабитись через інгібування Src. Активовані ПМН збільшували фосфорилювання Src Tyr416 та зменшували фосфорилювання Tyr527, дві події, які, як відомо, підвищують активність Src. Ці результати свідчать про те, що Src є головним компонентом дисфункції ендотеліального бар'єру, опосередкованої ПМН.
Точні молекулярні механізми, що призводять до витоку мікросудин після адгезії ПМН, чітко не зрозумілі. Попередні дослідження з ендотеліальними моношарами показали, що активовані ПМН індукують формування актинового стресового волокна, на відміну від нестимульованих клітин, у яких більша частина ниткоподібного актину знаходиться на периферії клітини (27). Очевидно, ці волокна контактують з протилежними сторонами клітинної мембрани та індукують клітинне скорочення, що порушує контакти між клітинами та призводить до утворення щілини. Наша гіпотеза полягає в тому, що білки AJ взаємодіють з актиновими волокнами стресу, і ця взаємодія призводить до дезорганізації AJ та змін клітинної морфології. Фосфорилювання β-катеніну, який, як відомо, пов'язує VE-кадгерин з актиновим цитоскелетом (14), може бути вирішальною сигнальною подією, що спрямовує на такі структурні зміни. Запропонований механізм фосфорилювання β-катеніну тирозину при дезорганізації AJ паралельний сигнальному шляху Wnt/β-катеніну, в якому виявлено, що Wnt стабілізує β-катенін, блокуючи його фосфорилювання серин/треонін та подальше націлювання на деградацію, що призводить до β- локалізація ядра катеніну та активація транскрипції (23). І навпаки, відсутність Wnt призводить до фосфорилювання серин/треонін β-катеніну та протеасомної деградації (18).
Однією з цілей цього дослідження була спроба співвіднести активовані ПМН із сигнальним шляхом, що включає β-катенін, що призводить до зміни компонентів AJ. Це дослідження показало, що в умовах, стимульованих ПМН, β-катенін, коімунопреципітований з Src. Ця очевидна асоціація Src/β-катеніну була повністю заблокована при трансфекції клітин SRCi. Крім того, ми змогли продемонструвати, що ПМН-індуковане фосфорилювання β-катеніну тирозину блокується в умовах інгібування Src у культивованих клітинах ендотелію. У сукупності ці результати свідчать про необхідність взаємодії та фосфорилювання Src та β-катеніну для гіперпроникності, спричиненої ПМН. Можливо, саме Src-кіназа безпосередньо фосфорилює β-катенін у відповідь на активовані PMN; ця подія призводить до дезорганізації AJ і, зрештою, порушення функції ендотеліального бар'єру. Очевидно, що Src та β-катенін беруть участь у безлічі клітинних процесів, і подальші дослідження спробують більш повно зрозуміти зв'язок між цими двома білками та їх взаємодію з іншими компонентами, що мають центральне значення для бар'єрної цілісності в мікросудинному ендотелії.
Цю роботу підтримали Гранти Національного інституту серця, легенів та крові HL-61507 та HL-70752 (для С. Ю. Юаня) та грант VA VISN 17 (для Дж. Х. Тінслі). С. Ю. Юань є лауреатом премії Національного інституту досліджень у галузі охорони здоров’я K02 HL-03606.
СНОПКИ
Адреса для запитів на передрук та іншої кореспонденції: Дж. Х. Тінслі, департамент медичної фізіології, Техаський університет і техніки. System Health Science Center, 702 SW HK Dodgen Loop, Rm. 206F, Темпл, Техас 76504 (електронна пошта: [електронна пошта захищена] edu).
- Тазовий синдром застійних явищ - тихоокеанський судинний
- Дивне, але справжнє вживання занадто багато води може вбити - Scientific American
- Stroke Connection e новини Американська асоціація інсультів
- Росія затримала хворого американського військового аташе від від'їзду з Москви - The New York Times
- Програма зниження ваги, яку керує фармацевт, використовуючи продукт, що замінює їжу, American Journal of