Сигналізація жирової тканини ядерними рецепторами при метаболічних ускладненнях ожиріння
Девід Якобі
1 кафедра генетики та складних захворювань; Кафедра харчування; Відділ біологічних наук; Гарвардська школа громадського здоров’я; Бостон, Массачусетс США
2 CHRU де Тур; Служба медичної допомоги Interne-Nutrition; Тури, Франція
3 ІНСЕРМ U 921; Університет Франсуа Рабле; Тури, Франція
Крістофер Станя
1 кафедра генетики та складних захворювань; Кафедра харчування; Відділ біологічних наук; Гарвардська школа громадського здоров’я; Бостон, Массачусетс США
Чі-Хао Лі
1 кафедра генетики та складних захворювань; Кафедра харчування; Відділ біологічних наук; Гарвардська школа громадського здоров’я; Бостон, Массачусетс США
Анотація
В останні роки запалення жирової тканини білого кольору було визнано пов'язаним із ожирінням. Адипоцити та асоційовані з жировою тканиною макрофаги (АТМ) виділяють біоактивні молекули, включаючи адипокіни, хемокіни/цитокіни та вільні жирні кислоти, які модулюють розвиток низькоякісного запалення та резистентності до інсуліну, відповідальних за метаболічні та серцево-судинні захворювання, пов'язані з ожирінням. Ядерні рецептори, зокрема рецептори, що активуються проліфератором пероксисом, є датчиками ліпідів у їжі та контролюють транскрипційні програми ключових метаболічних та запальних шляхів в адипоцитах та макрофагах. Цей огляд зосереджений на механізмах, за допомогою яких ядерні рецептори підтримують гомеостаз білої жирової тканини. Буде представлено ідентифікацію банкоматів як активних гравців у ініціації хронічного запалення та зв’язків між запальною сигналізацією та метаболічною дисфункцією, після чого буде обговорено останні дані про наявність ядерних рецепторів у функції ATM, з акцентом на паракринній взаємодії між адипоцитами та банкоматами.
Вступ
Дослідження показали, що ядерні рецептори є внутрішньоклітинними точками зближення метаболізму та запалення. За останнє десятиліття декілька ядерних рецепторів були визначені як датчики ліпідів у їжі, які регулюють програми транскрипції ключових метаболічних шляхів. Недавні результати ще більше підкреслили роль ядерних рецепторів у патофізіології метаболічного синдрому через контроль функції адипоцитів та активацію АТМ. У цьому огляді буде обговорено механізми, за допомогою яких ядерні рецептори модулюють передачу сигналів WAT, і те, як діяльність ядерних рецепторів у WAT пов'язана з метаболічними ускладненнями ожиріння. Буде представлений звіт про зв’язок між хронічним запаленням, банкоматами та метаболічними захворюваннями, після чого відбудеться обговорення участі ядерних рецепторів у підтримці гомеостазу в рамках ВАТ. Ми також розглянемо останні дані щодо ядерних рецепторів у функції ATM, зосередившись на паракринній взаємодії між адипоцитами та ATM.
Жирова тканина: важливе джерело метаболічного запалення
Дихотомія M1/M2 макрофагів жирової тканини
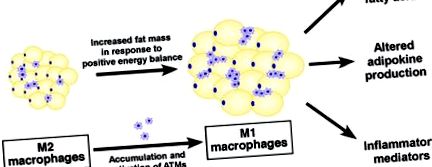
Фігура 1. Біла жирова тканина та метаболічні ускладнення ожиріння. На додаток до своєї функції накопичення енергії, жирова тканина зараз вважається ендокринним органом, виробляючи циркулюючі молекули, включаючи адипокіни (наприклад, лептин та адипонектин), медіатори запалення (наприклад, TNF-α, IL-6, IL-1β та MCP -1) та біоактивні ліпіди (наприклад, FFA), які мають важливий вплив на метаболічний гомеостаз. Дезадаптація адипоцитів у відповідь на хронічний позитивний енергетичний баланс призводить до збільшення продукування прозапальних хемокінів/цитокінів та вивільнення неестерифікованих FFA, що призводить до інфільтрації прозапальних макрофагів (M1) та зміщення балансу між pro - та протизапальні (М2) популяції макрофагів у білих жирових тканинах. Це так зване «паразапалення» або метаболічне запалення пов’язане із метаболічним синдромом, пов’язаним із ожирінням.
Зв’язок між запаленням та резистентністю до інсуліну
Докази, що підтверджують прозапальну сигнально-залежну індукцію метаболічної дисфункції, передували нашому розумінню взаємодій адипоцити/макрофаги. Існують дані, що свідчать про позитивну кореляцію між інфільтрацією макрофагами вісцерального жиру та тяжкістю ураження печінки у пацієнтів із ожирінням. 24 Конкретні експерименти з нокаутом у лінії мієлоїдів дають уявлення про участь макрофагів в аномаліях метаболічного синдрому. Однак у цих дослідженнях не було зазначено внесків банкоматів.
Придушення запалення при ожирінні покращує інсулінорезистентність
Втрата альтернативно активованих макрофагів полегшує інсулінорезистентність
За допомогою моделей мишей, у яких альтернативна активація макрофагів (М2) була генетично порушена, сприйнятливість до ожиріння, спричиненого дієтою, стеатозу печінки, резистентності до інсуліну та непереносимості глюкози. 33, 34 Ми обговоримо ці дослідження більш детально нижче.
Сигналізація інсуліну макрофагів при запаленні та метаболічних захворюваннях
Вважається, що сигналізація про інсулін впливає на функцію макрофагів. Однак механістичного розуміння у цій галузі бракує. Дослідження показали, що делеція гена Sorb1, що кодує Cbl-асоційований білок (Cap), молекулу, причетну до стимульованого інсуліном поглинання глюкози, захищає від інсулінорезистентності, індукованої дієтою, та зменшує запалення. Фенотип чутливості до інсуліну може бути переданий мишам дикого типу на дієті з високим вмістом жиру шляхом трансплантації кісткового мозку Sorb1 -/- 35, що підтримує роль сигналізації інсуліну макрофагами в модуляції системної чутливості до інсуліну. Дослідження атеросклерозу з вибиванням рецепторів інсуліну макрофагами показують суперечливі результати. На тлі мишей, що нокаутують рецептори ЛПНЩ, ці макрофаги виявляють порушену здатність справлятися з апостозом, викликаним стресом, що призводить до погіршення атеросклеротичних бляшок. 36 Навпаки, макрофаги з подвійним нокаутом рецепторів інсуліну та апоЕ були пов’язані з меншим запаленням та меншими атеросклеротичними ураженнями. 37
Походження метаболічного запалення при ожирінні
Малюнок 2. Макрофаги жирової тканини та походження метаболічного запалення. При ожирінні макрофаги, що мешкають у жировій тканині, виявляють M1/прозапальний фенотип. Вони активуються або системним хронічним запаленням перед потраплянням у жирові тканини, або місцевими медіаторами запалення. Гістологічно вони бачать, що вони зосереджені навколо відмираючих жирових клітин (вставка, верхня панель). Ці макрофаги M1 продукують прозапальні цитокіни (наприклад, TNF-α та IL-1β), які, як відомо, індукують метаболічну дисфункцію та резистентність до інсуліну в сусідніх адипоцитах через запальні сигнальні кінази (наприклад, JNK та IKK), створюючи нерозв'язну запальну реакцію.
Ядерні рецептори, що зондують ліпіди, в гомеостазі жирових тканин
Незважаючи на те, що вище обговорені результати настійно вказують на зв'язок між підвищеним ожирінням, системним запаленням та резистентністю до інсуліну через активацію банкоматів, критичним питанням без відповіді є те, чи можна фармакологічно модулювати активацію ATM. Оскільки певні ядерні рецептори діють як датчики для харчових жирів, а також беруть участь у регуляції запалення, вони представляють привабливі мішені, що піддаються лікарським препаратам, для контролю метаболічного запалення та супутніх захворювань. Ми зупинимося на представниках сімейства, що активує проліфератор, активований проліфератором жирних кислот (PPAR), оскільки вони, як відомо, регулюють функцію адипоцитів та імунну відповідь макрофагів, і як такі відіграють важливу роль у гомеостазі WAT.
Транскрипційна дія ядерних рецепторів
Ядерні рецептори та функція адипоцитів
Ядерні рецептори та активація макрофагів
Подання про те, що PPARγ є критичним для диференціації адипоцитів, спонукало до дослідження подібних функцій у інших типів клітин. Ранні дослідження показали, що PPARγ брав участь у сигнальному шляху, що контролює диференціацію в моноцитарних клітинах, 75, 76, хоча пізніші роботи з використанням генетичних моделей мишей PPARγ -/- показали, що диференціація макрофагів не залежала критично від PPARγ. 77, 78 Ці дослідження започаткували нову область досліджень, що вивчає регуляторний вплив ядерних рецепторів на запалення. Зараз ми знаємо, що на додаток до добре охарактеризованої імуносупресивної активності глюкокортикоїдного рецептора, активація кількох ядерних рецепторів, зокрема PPAR та LXR, здатні модулювати активацію макрофагів за допомогою декількох протизапальних механізмів або поляризації Th2.
Протизапальні механізми
Th2 поляризація
Цитокіни Th2, особливо IL-4 та IL-13, опосередковують активацію M2. 26 Спостереження, що рівні PPARγ та PPARδ у макрофагах підвищуються за допомогою IL-4/IL-13, ініціювало більш ретельне вивчення ролі PPAR макрофагів у мишачих моделях ожиріння, спричиненого дієтою. 33, 34, 92 - 95 У макрофазі індукована IL-4/IL-13 альтернативна активація пов'язана з підвищеним β-окисленням жирних кислот та окислювальним метаболізмом, програми, які транскрипційно контролюються PPARγ та PPARδ. 33, 34, 94, 96, 97 Відповідно, було показано, що PPARδ та PPARγ регулюють експресію певних генів М2 та контролюють альтернативну активацію в макрофазі. 33, 34, 93 Миші з мієлоїдно-специфічною делецією PPARδ або PPARγ виявляють підвищений M1 та знижені маркери M2 у ВАТ та печінці. 33, 34, 92, 93, 98 Слід зазначити, що в окремому дослідженні миші, у яких відсутній PPARγ або PPARδ у клітинах кровотворення, не виявляли очікуваних метаболічних фенотипів. 99 Цікаво, що було показано, що STAT6, фактор транскрипції Th2, полегшує відповідь PPARγ на IL-4 на рівні транскрипції в макрофагах, при цьому чистий ефект - збільшення кількості регульованих генів та величини відповідей. 100
Ядерні рецептори в паракринній взаємодії макрофагів жирної тканини з адипоцитами
Малюнок 4. Роль PPAR у паракринній взаємодії між адипоцитами та макрофагами жирової тканини. Як датчики дієтичних жирних кислот, PPAR відіграють важливу роль у підтримці гомеостазу білої жирової тканини. В адипоцитах активація PPARγ зменшує відтік жирних кислот, сприяючи накопиченню жиру та збільшуючи вироблення адипонектину, що покращує системний метаболізм ліпідів та глюкози. У макрофазі PPAR можуть пригнічувати запальні реакції за допомогою протизапальних механізмів або поляризації Th2, що збільшує продукцію протизапального цитокіну IL-10. Цитокіни Th2 продукуються локально багатьма типами клітин (еозинофілами, Т-лімфоцитами, тучними клітинами та адипоцитами) для активації факторів транскрипції нижче за течією в макрофазі, включаючи STAT6 та PPARδ/PPARγ. Дослідження продемонстрували, що порушення паракринного шляху IL-13-PPARδ призводить до запалення білої жирової тканини та резистентності до інсуліну, підкреслюючи важливість сигналізації PPAR у контролі ініціювання метаболічного запалення.
Висновок
На рівні сигналізації запальні та метаболічні процеси є невід’ємними частинами і пов’язані із компонентами метаболічних захворювань. Модуляція активності ядерних рецепторів є потенційною терапевтичною стратегією відновлення дисбалансу прозапальної та протизапальної сигналізації для запобігання та/або лікування пов'язаних із ожирінням метаболічних та серцево-судинних захворювань, які, як вважають, провокуються невирішеним хронічним запаленням. Насправді агоністи PPAR в даний час використовуються для лікування діабету 2 типу та дисліпідемії. Однак побічні ефекти лігандів PPARγ при серцево-судинних ускладненнях обмежили їх використання. Майбутні дослідження, спрямовані на виділення локалізованих ефектів PPAR в мікросередовищі WAT, або шляхом націлювання на специфічні для тканини коактиватори/корепресори, або визначення селективних синтетичних модуляторів, забезпечать нові терапевтичні можливості. Нові механістичні уявлення, отримані в результаті цих досліджень, також допоможуть визначити відносний внесок сигналів PPAR в адипоцитах або імунних клітинах у контролі метаболічного запалення та супутніх захворювань.
- Неоднорідність жирової тканини Вплив депо-відмінностей у жировій тканині на ожиріння
- Метаболізм коричневої жирової тканини при здоров’ї навколишнього середовища миш’яку та ожирінні - Ro - 2019 - The FASEB
- Гіпоксія жирових тканин при ожирінні та її вплив на діабетрегуляцію адипоцитокінів
- Сприятливий вплив журавлини на профілактику ожиріння та пов'язаних з цим ускладнень Метаболічний
- Сприятливий вплив імбиру Zingiber officinale Roscoe на ожиріння та метаболічний синдром огляд