Схід та Захід: етнічні відмінності в епідеміології раку простати між східними азіатами та кавказцями
Анотація
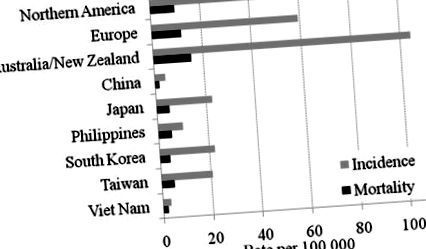
Рак передміхурової залози - найчастіший рак серед чоловіків в економічно розвинених країнах [1]. У 2008 році діагностовано 903 500 хворих на рак передміхурової залози, що становить 14% від загальної кількості нових випадків раку у світі. У 2008 р. Рак передміхурової залози також був шостою причиною смертності від раку у чоловіків. Хвороба, як відомо, є більш поширеною в західних країнах, включаючи країни Океанії, Північної Америки та Європи, ніж в країнах Азії (рис. 1). Однак при порівнянні захворюваності та смертності від раку передміхурової залози в різних країнах слід враховувати багато факторів. У цьому огляді фактори, що впливають на порівняння між країнами, включають практику скринінгу простатичного специфічного антигену (PSA) та генетичну основу.
Дані отримані з GLOBOCAN 2008 [http://globocan.iarc.fr/]. Захворюваність та смертність у всіх віках (від 0 до 75 років) були стандартизовані з використанням світового стандартного населення.
Повідомляється про випадки захворювання та скринінг специфічного для простати антигену
Незважаючи на обмежену специфічність виявлення справжніх випадків раку, простатичний специфічний антиген (ПСА) є єдиним встановленим та регулярно застосовуваним клінічним біомаркером. Рівень PSA та його зміна від вихідного рівня може бути сигналом розвитку раку передміхурової залози, прогресування, рецидиву та міри ефективності медичних процедур. Однак скринінг раку на основі PSA на практиці все ще відрізняється в залежності від країни. Європейське рандомізоване дослідження скринінгу на рак передміхурової залози (ERSPC) повідомило, що скринінг на основі ПСА значно знижує смертність від раку простати [2] - [4]. Крім того, популяційні дослідження в Тіролі показали, що скринінг на основі ПСА може зменшити смертність від раку простати [5], [6]. Однак результати все ще суперечливі [7]. У майбутньому програми скринінгу раку з кращою точністю та економічною ефективністю можуть впроваджуватися ширше, поєднуючи ПСА з сечовими біомаркерами, наприклад антиген раку простати 3 (PCA3) [8], [9], але в даний час офіційно не рекомендується, і вартість тесту не завжди відшкодовується всім чоловікам у всьому світі.
Зафіксовано, що рівень захворюваності буде нижчим у тих країнах без систематичної скринінгової програми на рак простати. Знання та доступ до скринінгу на рак, заснований на PSA, вплинуть на рівень виявлення раку передміхурової залози, який інакше не був би діагностований, що призведе до більш ранньої стадії діагностики [10] - [14]. Тут обговорюється взаємозв'язок між скринінговою практикою PSA та випадками захворюваності серед населення у материковому Китаї, Японії та Кореї. У цих репрезентативних азіатських країнах рак передміхурової залози та його скринінг були поза межами радарів, ймовірно, через відносно низький рівень захворюваності та повільніший прогрес у порівнянні з іншими видами раку. Однак азіатські іммігранти в США, Канаді, Австралії та країнах Західної Європи, де вони могли б мати кращий доступ до скринінгу ПСА, все ще демонструють менший рівень захворюваності в порівнянні з чорношкірими та європейськими кавказцями, які проживають у тих же регіонах.
Кілька досліджень повідомляли, що частота раку передміхурової залози у азіатських іммігрантів, що проживають у Північній Америці [27] - [30] та європейських країнах [31] - [35], була набагато вищою, ніж у їхніх країнах народження. Це може бути через кращий доступ до скринінгу ПСА в західних країнах?
Багато європейських країн не пропонують рутинного скринінгу ПСА; проте захворюваність набагато вища, ніж в країнах Азії (рис. 1). У Сполученому Королівстві всі чоловіки можуть робити усвідомлений вибір щодо скринінгу ПСА. У 2007 році рівень скринінгу та стандартизована за віком захворюваність оцінювались як 6,2% у чоловіків у віці від 45 до 89 років [36] та 100,5 на 100 000 відповідно. За підрахунками, якщо ввести популяційний скринінг PSA, показники діагностики раку передміхурової залози у чоловіків у віці від 50 до 69 років зросли б більш ніж у 20 разів порівняно з нинішніми показниками [11]. .
Захворюваність та смертність серед населення США (неіспаномовних білих та азіатських американців), стандартизованих із використанням стандартного населення США 2000 року та 95% довірчого інтервалу, були отримані від Miller et al. [27] на основі даних спостереження, епідеміології та кінцевих результатів за 1998–2002 роки. Норми скринінгу PSA у чоловіків у віці 50 років і старше, які чули та проходили тест на PSA, були отримані в Каліфорнійському опитуванні охорони здоров’я 2003 р. [28] .
Підсумовуючи, як показано на малюнку 1, повідомляється про захворюваність та смертність набагато нижче в країнах Азії порівняно з країнами Північної Америки, Європи та Океанії. Крім того, рівень захворюваності на азіатських іммігрантів у західних країнах мав більший рівень захворюваності на рак передміхурової залози в порівнянні з випадками в країнах народження. Швидкість скринінгу на PSA, здається, низька в азіатських країнах та деяких азіатських популяціях у західних країнах, що частково може пояснити низький рівень захворюваності серед азіатських груп. Однак, як показано на малюнку 2, американські азіати в Каліфорнії з порівнянним показником скринінгу PSA все ще мали нижчу частоту порівняно з неіспаномовними білими. Отже, низький рівень скринінгу PSA є не єдиною причиною зниження рівня захворюваності в Азії. Також можливо, що літні мігранти можуть виїхати до своїх країн народження, що може призвести до відносно меншої частки літнього населення в цих країнах [42], та/або пацієнти з раком можуть бути більш схильними до виїзду з діагностики раку. Тому складно узагальнити взаємозв'язок між показниками скринінгу ПСА та випадками захворюваності та основними причинами різниці в популяціях між Сходом та Заходом.
Виживання та прогностичні відмінності між хворими на рак простати в Азії та США
Таблиця 1.
| Автор (країна) | Рік діагностики | Населення пацієнтів | Базова різниця (азіатська та біла) | Слідувати | Результати (азіатські проти білих) | ||
| Людина [43] (Канада) | 1994– | Радикальна променева терапія, 63 азіатські та 1804 неазіатські | Більший відсоток азіатських пацієнтів має високий рівень ризику | Медіана 33 міс | Відсутність суттєвої різниці в часі до першого біохімічного збою (Р = 0,7 для тесту log-rank) та спричинення специфічної виживаності (P = 0,4 для тесту log-rank) після променевої терапії | ||
| Оклі-Гірван [44] (США, Канада) | 1987–1991 | Реєстр ракових захворювань на основі населення [45] (США, Каліфорнія) | 1995–2004 | Реєстр раку на основі населення: 108 076 білих, 8 840 азіатських (китайці, філіппінці, японці, корейці, південноазійці, в'єтнамці) | Азіатський мав профіль ризику при постановці діагнозу з приводу виживання | До кінця 2004 року | Багатофакторні коефіцієнти небезпеки для смерті (та 95% ДІ) відносно білого складали: китайці, 0,51 (0,43–0,62) японці, 0,59 (0,51–0,70) філіппінці, 0,49 (0,37–0,65) корейці, 0,60 (0,37–0,98) |
| Коен [46] (США) | 1986–1996 | SEER/Medicare, локалізований CaP у віці 65–84 років; 23 353 білі та 566 азіатські | Азіатська страждає хворобою вищого ступеня | До кінця 1998 року | Багатофакторне відношення ризику рецидивів захворювання в азіатських країнах становило 0,97 (95% ДІ, 0,68–1,38) | ||
| Холмс [48] (США) | 1992–1999 | SEER/Medicare, місцевий регіональний капітал ≥ 65 років: 53 764 кавказці, 1830 азіатів | Більш високий відсоток азіатських представників страждає гіршими показниками біопсії | До кінця 2003 року | Багатоваріантне відношення ризику для загальної виживаності було на 37% нижчим в Азії | ||
| Лін [47] (США) | 1988–1994 | SEER; 93 767 білих, 978 китайських, 1872 японських та 1471 філіппінських | Філіппінці частіше ставили діагноз: запущена стадія | До кінця 1997 року | 5-річне виживання за конкретною причиною та 95% ДІ були: білі, 89,3% (89,1% –89,6%) китайці, 91,4% (89,3% –93,4%) японці, 91,1% (89,6% –92,5%) філіппінці, 85,8% (83,8% –87,9%) | ||
| Реймундо [30] (США) | 1989–2007 | Реєстр ракових захворювань на військовій основі; 8 335 кавказців та 583 азіати | Азіатський американець мав нижчу клінічну стадію, але гірший рівень біопсії | До листопада 2008 року | Багатофакторне відношення ризику для загальної виживаності у білого референта до азіатського становило 2,92 (1,78–4,79) | ||
| Фукагай [49] (США, Гаваї) | 1992–2001 | 59 кавказьких та 105 японських американських CaP з гормональною терапією в одному центрі | Статистичної різниці не було, але вони мали тенденцію до вищого рівня PSA та балів Глісона в японо-американських | До кінця 2001 року | Японець-американець мав значно кращий загальний показник (Р = 0,001 для тестування за лог-рангом) та виживання за певною причиною (Р = 0,036 для тесту за лог-рангом). |
CaP, хворі на рак передміхурової залози; 95% ДІ, 95% довірчий інтервал; ЄЕП, соціально-економічний статус визначається як переписна освіта та переписна бідність; SEER, програма спостереження, епідеміології та кінцеві результати; RP, радикальна простатектомія.
Фактори харчування та генетична сприйнятливість раку простати у азіатів та кавказців
Як зазначалося раніше, азіатські іммігранти в західних країнах мали більший рівень захворюваності на рак передміхурової залози порівняно з тими, хто був у їхніх країнах народження. Можливо, це пов’язано з різними медичними системами, але дієту також можна віднести. Як правило, припускають, що вестернізована дієта в азіатських країнах може бути пов'язана з підвищеним ризиком раку передміхурової залози, але складно окремо обговорювати вплив дієти на покращення медичної практики та методів виявлення. Соєві продукти популярні серед азіатської культури, і цікаво, що соєві продукти, особливо неферментовані соєві продукти, постійно пов'язуються із зниженням ризику раку передміхурової залози на 25–30% [53] - [55] .
Етіологія раку передміхурової залози залишається в основному невідомою, але враховуючи, що сімейний анамнез є одним із встановлених факторів ризику раку простати [56], і цей ген та/або фактор навколишнього середовища повинні брати участь у його етіології. Особа з позитивною сімейною історією має в 2-3 рази вищий ризик раку передміхурової залози [57] - [59], і 10% –20% випадків раку простати, за оцінками, є таким неспорадичним раком простати. Лі та ін. [60] повідомив, що 11,5% (25/218) корейських хворих на рак передміхурової залози з діагнозом та/або лікуванням у великій лікарні протягом тримісячного періоду дослідження мали позитивну сімейну історію. Міжнародний консорціум з генетики раку простати провів комбінований аналіз зв’язків у великій кількості сімей (переважно білих) із раком простати [61], [62]. Ці дослідження показали значний зв'язок у 22q12 та деяких інших регіонах із "сугестивним" зв'язком. Існує мало досліджень взаємозв'язку серед азіатських груп населення. Мацуї та ін. [63] повідомив про номінальну зв'язок у хромосомі 8p23 та 1p36 на японській мові.
Хоча дослідження близнюків зі Швеції, Данії та Фінляндії припустило, що приблизно 42% ризику раку передміхурової залози можна пояснити спадковими факторами [77], алелі ризику можуть бути досить поширеними та слабо проникаючими [78]. Для того, щоб диференціювати чоловіків із високим ризиком, можливо, доведеться поєднати кілька генетичних поліморфізмів-кандидатів з сімейною історією [79] .
Було проведено багато досліджень асоціацій по всьому геному (GWAS), в основному на Кавказі. Мета-аналіз 21 дослідження виявив значну зв'язок між 31 однонуклеотидним поліморфізмом (SNP) та раком простати [80]. Серед 71 підгрупи досліджуваного населення лише двоє страчено в азіатів (китайські американці та японські американці) [81], [82], а асоціації з деякими з 31 СНП зникли в аналізі азіатських підгруп. Однак велике японське дослідження GWAS, яке не було включено в цей мета-аналіз, продемонструвало значну взаємозв'язок між ризиком раку передміхурової залози та більшістю з цих ОНП [83], включаючи дослідження на хромосомі 8q24, встановленому локусі чутливості до раку простати [84]. . Ці генетичні поліморфізми можуть взаємодіяти як між собою, так і з факторами навколишнього середовища; однак, Lindstrom et al. [85] повідомили, що на основі даних консорціуму консорціуму Національного інституту раку США по раку молочної залози та раку простати ці СНП були, скоріше, незалежними факторами ризику, і що існує мало свідчень про таку взаємодію.
Згідно з комбінованим аналізом порівняльних досліджень геномної гібридизації (CGH), хромосоми 8p та 8q були найбільш часто видаленими та отримали ділянки в геномі пухлин передміхурової залози, відповідно [86]. Етнічну різницю в показниках СГЗ між азіатами та кавказцями ще слід вивчити [87]. Заглушення генів за допомогою гіперметилювання острівця CpG в промоторній області GSTP1 відбувається у понад 90% ракових захворювань простати [88]. Також повідомлялося про інші соматичні мутації, включаючи AR-активуючі мутації [89]. Однак жоден із цих маркерів досі не застосовувався у звичайній клінічній практиці. Етнічна чутливість до місць мутації, частота та клінічні наслідки залишаються незрозумілими.
Висновки
Епідеміологія раку простати кардинально змінилася після впровадження скринінгу на основі PSA в деяких західних країнах [10]. Повідомляється, що захворюваність на рак передміхурової залози серед азіатських чоловіків набагато нижча, ніж у азіатських іммігрантів, афроамериканців та європейських кавказців у західних країнах, але вона, ймовірно, зростає разом із зміною медичної практики, режиму харчування та обізнаності про хворобу. Повідомляється, що багато сприйнятливих локусів та генетичних поліморфізмів скромно збільшують ризик раку простати. Жодних генетичних та соматичних біомаркерів, крім ПСА, не встановлено для сегрегуючої популяції пацієнтів відповідно до агресивності захворювання, частоти рецидивів, реакції на лікування або виживання. Кілька спостережних досліджень запропонували кращий прогноз та виживання у азіатських хворих на рак простати з невідомих причин. Цей висновок слід враховувати при плануванні багаторегіональних клінічних випробувань, включаючи країни Азії.
- Чи підвищує соя ризик раку передміхурової залози Чоловіче здоров’я
- Дієта після діагностики та ризик прогресування раку передміхурової залози, рецидивів та смерті (United
- Чи збільшує соя рак простати Бен; s Природне здоров'я
- Дієта після діагностики та ризик розвитку раку передміхурової залози, рецидиву та смерті (United
- Дієта та рак передміхурової залози - Мажар - 2004 - BJU International - Інтернет-бібліотека Wiley