Розуміння ожиріння та ризику раку ендометрія: можливості для профілактики
Анотація
В усьому світі ожиріння стало серйозною кризою в галузі охорони здоров’я. Надмірна вага та ожиріння не тільки збільшують ризик серцево-судинних захворювань та діабету 2 типу, але також є відомими факторами ризику для різних типів раку. Серед усіх видів раку збільшення індексу маси тіла найбільш сильно пов'язане із захворюваністю на рак ендометрія та смертністю. Молекулярні механізми, що лежать в основі того, як жирова тканина та ожиріння сприяють патогенезу раку ендометрія, стають все більш зрозумілими і виявили ряд раціональних стратегій, як поведінкових, так і фармацевтичних, для профілактики як первинного, так і рецидивуючого захворювання.
Ожиріння та ризик раку ендометрія: механізми та раціональні стратегії профілактики раку
Хоча передбачалося, що надлишок естрогену через периферичну конверсію андростендіону в естрон обумовлює підвищений ризик раку ендометрія у жінок із ожирінням, нові дослідження передбачають інші механізми, за допомогою яких ожиріння сприяє розвитку раку ендометрія. Цей огляд обговорить сучасне розуміння того, які фактори лежать в основі асоціації ожиріння та раку ендометрія, а також які стратегії доступні як для профілактики, так і для лікування.
Ожиріння та порушення гормонального балансу
Естроген сприяє зростанню ракових клітин ендометрія як за допомогою прямої, так і опосередкованої регуляції транскрипції генів. Зв’язування з цитоплазматичними рецепторами естрогену альфа та бета (ERα та ERβ) призводить до набору транскрипційних ко-факторів та безпосередньої активації широкого спектру генів, що реагують на естроген. Рецептори естрогену також можуть зв'язуватися естрогензалежним та незалежним чином з іншими факторами транскрипції та посилювати транскрипцію генів за допомогою альтернативних елементів відповіді 15, 16. Очевидно також, що сам естроген чинить швидкі, негеномні ефекти, пов'язані з різноманітними каскадами сигналізації цитоплазматичної кінази 16, 17. Лікування 17β-естрадіолом (Е2) активує шляхи PI3-кінази та MAPK, які пов’язані з клітинною проліферацією, і часто гіперактивуються при раку. Прямий зв'язок між рецепторами естрогену та рецепторами клітинної поверхні, включаючи IGF-1R та EGFR, являє собою механізм, який безпосередньо пов'язує естроген з нижчими кіназними каскадами, що сприяють росту клітин та прогресуванню пухлини.
У нормальному передменструальному ендометрії прогестерон протидіє естрогену обумовленій проліферації та індукує залізисту диференціацію та децидуалізацію строми ендометрія. Отже, умови, що супроводжуються тривалим дефіцитом прогестерону, сприяють проліферації ендометрію та збільшують ризик гіперплазії ендометрія та його прогресування до раку ендометрія 18,19. Наприклад, нуліпарність, нерегулярні менструації та тривала постменопаузальна замісна гормональна терапія неопанованим естрогеном пов’язані із збільшенням ризику раку ендометрія 18-20. У жінок із ожирінням перед менопаузою відсутність прогестерону внаслідок ановуляції, така як спостерігається при синдромі полікістозних яєчників (СПКЯ), також може сприяти ризику раку ендометрія.
СПКЯ є гетерогенним розладом, що вражає 6-8% жінок, що характеризуються надлишком андрогенів, порушеннями менструального циклу внаслідок овуляторної дисфункції, і часто асоціюється з полікістозною морфологією яєчників 21. Ожиріння виявляється приблизно у 30-70% жінок із СПКЯ 22. Основним елементом цього розладу є наявність резистентності до інсуліну, яка погіршується ожирінням. Нещодавнє австралійське дослідження випадків лікування жінок у віці до 50 років показало, що жінки з СПКЯ мали в чотири рази більший ризик раку ендометрія порівняно з жінками без СПКЯ 23. При поправці на ІМТ СПКЯ залишався незалежним фактором ризику і асоціювався з більш ніж вдвічі підвищеним ризиком раку ендометрія.
Діабет 2 типу та гіперінсулінемія
Гіперінсулінемія та інсулінорезистентний стан тісно пов’язані з ожирінням. Епідеміологічно, ряд досліджень показав помірний зв'язок діабету з ризиком раку ендометрія. Цікаво, що в трьох дослідженнях найбільш значущі ризики спостерігались у жінок, які страждали ожирінням та діабетом 24, 27, 29. Дослідження Troisi та співавт. Досліджувало рівень інсуліну у жінок з раком ендометрія порівняно з контролем, щоб визначити, чи може підвищений рівень інсуліну пояснити зв'язок ожиріння та раку ендометрію 30. Хоча підвищений рівень інсуліну в сироватці крові, вимірюваний С-пептидом, асоціювався з підвищеним ризиком розвитку раку ендометрія, підвищення рівня сироваткового інсуліну само по собі не могло бути причиною асоціації ожиріння та раку ендометрія.
Кілька нещодавніх досліджень, включаючи одне з нашої групи, демонструють зв'язок інсулінорезистентності з ризиком раку ендометрія з використанням адипонектину як сурогатного маркера для інсулінорезистентності 31-34. Цей адипокін можна вимірювати у сироватці крові або плазмі крові та демонструє рівні, пропорційно пропорційні резистентності до інсуліну. Використовуючи схему дослідження випадків та контролю, наша група виявила, що низький рівень адипонектину в значній мірі асоціюється з ризиком раку ендометрія, незалежно від ІМТ. Згодом у великому проспективному вкладеному дослідженні «контроль випадків», спонсорованому Всесвітньою організацією охорони здоров’я, було проведено дослідження щодо ризику адипонектину та раку ендометрія 34. Всі зразки були зібрані перспективно, а ті, що використовувались для аналізу, були з періоду часу до початку раку ендометрія. Це дослідження підтвердило, що низькі рівні адипонектину були пов'язані з ризиком раку ендометрія, знову ж незалежно від ІМТ, що наводить на думку, що резистентність до інсуліну є незалежним фактором ризику раку ендометрія.
Специфічний вплив гіперінсулінемії на патогенез раку, асоційованого з ожирінням, недостатньо чітко визначений. Наша група продемонструвала, що проліферативний ефект естрогену на ендометрій посилюється у ожирілих та худих тварин 35. Використовуючи модель гіперінсулінемії щурів Цукера, естроген викликав значно вищу експресію пропроліферативних генів, цикліну А та c-myc та в ендометрії щурів із ожирінням, порівняно з тим, що спостерігався у худих контрольних тварин. І навпаки, індуковане естрогеном інгібітор клітинного циклу p27Kip1 та антипроліферативні гени sFRP4 та RALDH2 більш виражені в ендометрії із ожирінням. Отже, ожиріння змінює баланс між про- та антипроліферативними сигналами на користь росту ендометрія.
Інсуліноподібні фактори росту
Системний рівень IGF також змінюється ожирінням. Шість IGFBP зв'язуються та модулюють біоактивність IGF, перешкоджаючи зв'язуванню з рецепторами. У той час як збільшене вироблення естрогену безпосередньо збільшує синтез IGF-1, 36,37 тривала гіперінсулінемія призводить до зниження синтезу IGFBP1 та 2 7. IGFBP1 найбільш сильно експресується ендометрієм людини 38, 39. Отже, ожиріння сприяє одночасному збільшенню циркулюючого IGF і зменшенню IGFBP1, що призводить до чистий приріст біодоступного IGF-1 7, 40, 41 .
Сигнальні шляхи інсуліну та IGF
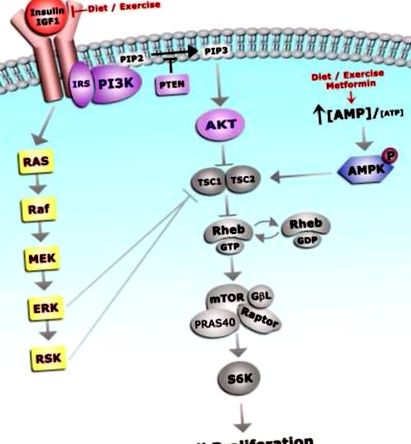
Інсулін та IGF використовують загальні сигнальні механізми 42. Як проілюстровано на малюнку 3, після зв’язування лігандів, опосередковане рецептором фосфорилювання білка рифленого субстрату 1 (IRS-1) призводить до активації сигнальних шляхів PI3K/AKT/mTOR і MAPK, що сприяють виживанню та проліферації клітин 42 .
Зв'язування IGF-1 з його рецептором призводить до автофосфорилювання IGF-1R і подальшої активації безлічі подальших сигнальних шляхів. Клітинна проліферація здійснюється через шляхи PI3K та MAPK. Поведінкові та фармацевтичні втручання, що знижують ожиріння та рівень IGF-1, активізують AMPK, а отже представляють раціональну терапевтичну стратегію для профілактики раку ендометрія.
Гіперактивність шляху PI3K/AKT/mTOR часто спостерігається при раку ендометрія. Повсюдно експресована фосфатаза та гомолог тензину (PTEN) ліпід/білок фосфатаза дефосфорилює субстрати PI3K і діє як антагоніст PI3K та ген супресорів пухлини. Інактивація або втрата PTEN спостерігається більш ніж у 40% випадків раку ендометрія I типу. Отже, в поєднанні з підвищеним циркулюючим IGF-1, втрата PTEN сприяє гіперактивності шляху PI3K/AKT/mTOR та сприяє зростанню раку ендометрія у людей із ожирінням. Крім того, рецептори інсуліну та IGF одночасно активують сигнальний шлях MAPK, інший механізм, який сприяє передачі сигналів mTOR 42 .
AMPK (5 ’аденозинмонофосфат-активована протеїнкіназа) пригнічує передачу сигналів через шлях PI3K/AKT/mTOR, слугуючи противагою активності AKT та ERK. Інактивація AMPK зазвичай асоціюється з ожирінням (надлишок енергії/калорій) та резистентністю до інсуліну. При фосфорилюванні AMPK комплекс бульбового склерозу (TSC1/2) запобігає опосередкованому mTOR проліферацію ендометрія. Отже, інактивація AMPK являє собою додатковий механізм, що сприяє гіперактивності mTOR і пухлинному генезу в ендометрії.
Адіпокіни
Жирова тканина - це складний ендокринний орган, який виділяє безліч протизапальних та протизапальних факторів, класифікованих як „адипокіни”. Стан хронічного системного запалення, пов’язаного з ожирінням, все більше пов’язаний із розвитком інсулінорезистентності та хронічної гіперінсулінемії 43–43. Наприклад, секреція адипокіну, TNFα порушує сигналізацію рецепторів інсуліну, індукуючи інгібуюче фосфорилювання білків IRS, тим самим від'єднуючи інсулін від сигнальних каскадів 44, пов'язаних з. Крім TNFα, додаткові прозапальні адипокіни, пов'язані з раком ендометрію, включають включають лептин 46, інтерлейкін-6 (IL-6) 47 і резистин 48 .
На відміну від прозапальних адипокінів, рівень адипонектину в циркуляції обернено пропорційний ІМТ та резистентності до інсуліну і відіграє роль у підвищенні чутливості до інсуліну та як протизапальний засіб. Адипонектин подає сигнали через свої рецептори (AdipoR1/2) на активацію AMPK та інгібування сигналізації 49 PI3K/AKT/mTOR, і, отже, повинен інгібувати прогресування пухлини, зумовлений шляхом PI3K. На підтвердження цієї гіпотези дослідження, проведені нашою групою та іншими, підтверджують, що рівні адипонектину незалежно та обернено пов'язані з ризиком раку ендометрію 31-34 .
Адипокіни та інші запальні білки, пов'язані з ожирінням, такі як С-реактивний білок, виявляються перспективними як біомаркери ризику раку ендометрія 50-52, однак для визначення складної ролі адипокінів у розвитку інсулінорезистентності та ожиріння будуть необхідні додаткові дослідження -асоційований рак ендометрія.
Раціональні втручання
Ці відомі біохімічні механізми, за допомогою яких надмірна вага та ожиріння сприяють ризику раку ендометрія, пропонують кілька раціональних стратегій профілактики раку. Сюди входять поведінкові, фармацевтичні та хірургічні втручання, які запобігають або скасовують гормональний та метаболічний дисбаланс, пов’язаний із ожирінням та резистентністю до інсуліну.
Оральні контрацептиви
Багаторазові епідеміологічні дослідження демонструють, що жінки, які використовують комбіновані естрогенові та прогестеронові оральні контрацептиви (OCP), знижують ризик раку ендометрія на 50% 53, 54, 55. Хоча немає даних, що підтверджують зниження ефективності захисту ендометрія від жінок із ожирінням, є дослідження, які свідчать про те, що жінки з ожирінням мають дещо знижену ефективність контрацепції порівняно з худими жінками 56. Дослідження, проведене Максвеллом та співавт., Показало, що OCP з більш високою потужністю прогестинів може бути більш ефективним для жінок з вищим ІМТ 57. Для уточнення оптимального OCP для хіміопрофілактики раку ендометрія у людей із ожирінням буде потрібно більше даних.
Левоноргестрел, що містить ВМС (LNG-IUD), також є привабливим кандидатом для профілактики раку ендометрія. Застосування внутрішньоматкової спіралі пов'язане з меншим ризиком раку ендометрія 58, і прогестин може додатково захищати ендометрій. У кількох дослідженнях повідомляється про використання спіралі СПГ для зворотного розвитку гіперплазії ендометрія та раку, проте необхідні додаткові дані, перш ніж його можна буде рекомендувати для профілактики раку.
Синтетичні гестагени зазвичай використовуються в оральних контрацептивах та внутрішньоматкових пристроях, а також для лікування менорагії, безпліддя та симптомів менопаузи. Терапія прогестином також є стандартною для лікування жінок, які страждають гіперплазією ендометрія без атипії, що є ймовірним попередником ураження раку ендометрія 59. Також була досліджена реакція складної гіперплазії на атипію та добре диференційовану карциному ендометрію на прогестин. У дослідженнях, проведених Wheeler та співавт., Повну ремісію спостерігали у 67% жінок із складною атиповою гіперплазією, тоді як 11% регресували до складної гіперплазії без атипії, а 22% мали стійке захворювання із середнім періодом спостереження 11 місяців 59. У жінок з добре диференційованою карциномою ендометрію 42% жінок продемонстрували повну ремісію, тоді як 58% мали стійке захворювання протягом 12-місячного періоду спостереження.
Поведінкові: дієта та фізичні вправи
Маса тіла та фізична активність є модифікуючими факторами ризику, якими можна маніпулювати, щоб сприятливо вплинути на результат хворих на рак. Недавнє дослідження, проведене серед 42 672 жінок у період менопаузи, які були залучені до Американського онкологічного товариства з питань профілактики раку II Когорта харчування, оцінювало частоту раку ендометрія стосовно фізичної активності та ІМТ 60. За період з 1992 по 2003 рік було діагностовано 466 нових випадків раку ендометрія. Рекреаційні та помірні фізичні навантаження були пов’язані із зниженням ризику раку ендометрія на 33%, і ефект був виражений серед жінок із надмірною вагою або ожирінням.
Циркулюючий рівень естрогену корелює з підвищенням ІМТ у жінок у постменопаузі, тоді як втрата ваги або внаслідок дієтичних змін, або фізичних вправ, або їх поєднання зменшує синтез естрогену. Як обмеження калорій, так і джерело калорій, схоже, впливають на концентрацію гормонів у сироватці крові. Показано, що дієтичні втручання з високим вмістом клітковини та низьким вмістом жиру знижують біодоступність концентрації естрадіолу у тих, хто пережив рак молочної залози, навіть за відсутності одночасної втрати ваги 61,62, 63 .
Фізична активність постійно демонструє виражений вплив на рівень гормонів як у худорлявих, так і у людей із ожирінням осіб 64-65 років і пов'язана зі зниженням ризику раку молочної залози після менопаузи, а також рецидивів раку молочної залози. Однак, як відомо, дієта та фізичні вправи запобігають рецидивам типів пухлин, які зазвичай не реагують на гормони, включаючи негативний рак молочної залози на рецептори естрогену, що свідчить про те, що додаткові шляхи, активовані фізичною активністю та дієтою, впливають на ріст пухлини 66, 67 .
Втрата ваги, як через зміни поведінки (дієта та фізичні вправи), так і за допомогою хірургічного втручання, зменшує резистентність до інсуліну, знижує рівень біоактивного IGF-1 та запобігає появі діабету 2 типу. Нещодавно Пендяла та співавтори провели профілактику експресії на біоптатах слизової оболонки ректосигмоїдів, отриманих у жінок із ожирінням до втрати ваги, спричиненої дієтою та після неї 68. Після втрати ваги на 10% тканини продемонстрували значне зниження різних запальних цитокінів, включаючи TNFα, IL-6, IL-8 та MCP-1, а також зниження регуляторів маркерів прозапальних шляхів, метаболізму простагландинів та факторів транскрипції. Це було відображено зменшенням циркулюючих TNFα та IL-8, а також рівня глюкози, холестерину та тригліцеридів у сироватці крові, а також зниженням кількості Т-клітин та макрофагів у тканинах. У сукупності ці дані свідчать про те, що втрата ваги зменшує запалення прямої кишки та роз’єднує рак, сприяючи передачі сигнальних шляхів, зменшуючи тим самим ризик розвитку раку прямої кишки. На додаток до їх впливу на інсулін, IGF та запальна сигналізація, обмеження калорій та фізичні вправи активують AMPK як наслідок системного збільшення АМФ внаслідок виснаження АТФ. Ймовірно, що втрата ваги може відігравати терапевтичну роль у профілактиці всіх видів раку, пов’язаних із ожирінням.
Метаболічна/баріатрична хірургія
Помірне зниження ваги 5-10% маси тіла за допомогою дієти та фізичних вправ зменшує частоту діабету 2 типу та інших супутніх захворювань, пов’язаних із ожирінням, і в даний час Американське товариство раку рекомендує як мету зниження ваги для тих, хто пережив рак із надмірною вагою 69 . На жаль, значні зміни способу життя, пов’язані зі зниженням ваги, важко прийняти та підтримувати багатьом людям із ожирінням та хворобливим ожирінням, і багатьом не вдається підтримувати здорову вагу.
Ці механізми дії свідчать про перспективну та нову роль цього “старого препарату” у хіміопрофілактиці первинних та рецидивних пухлин 76, 77. Дійсно, це було продемонстровано ретроспективними епідеміологічними дослідженнями. Li et al продемонстрували, що пацієнти з діабетом, які приймали метформін, мали значно нижчий ризик раку підшлункової залози порівняно з тими, хто не мав 78. Крім того, пацієнти з діабетом на рак молочної залози, які отримують метформін, демонструють більшу частоту патологічної повної відповіді на неоад'ювантну терапію 79. Вживання метформіну також пов'язане зі зменшенням ризику раку передміхурової залози 80 .
Нещодавно було показано, що метформін інгібує експресію ароматази первинними культурами жирових стромальних клітин людини 81. Якщо цей ефект буде справедливим in vivo, ми очікуємо, що метформін буде інгібувати локалізоване вироблення естрогенів у тканині стромальної тканини пухлини, а також зменшувати рівень естрогену в крові, що спостерігається у людей із ожирінням. Також було показано, що метформін підвищує експресію рецепторів прогестерону в клітинних лініях раку ендометрія 82 та у хворих на рак молочної залози 83. Отже, можливо, що метформін посилює антипроліферативні ефекти прогестинів завдяки посиленій PR-сигналізації.
Хоча різні механізми дії метформіну мають біологічну правдоподібність для його використання як хіміопрофілактичного агента проти раку загалом, він є ідеальним вибором ліків для первинної та третинної профілактики раку ендометрія.
Резюме
Сучасні дані свідчать про те, що, орієнтуючись на гормональний дисбаланс та гіперактивні проліферативні шляхи, пов'язані з ожирінням, ризик розвитку раку ендометрія протягом життя може бути значно зменшений. Хоча досягнення та підтримка здорової ваги тіла за допомогою дієти та фізичних вправ є ідеальним рішенням для профілактики раку ендометрія, реальність всесвітньої епідемії ожиріння вимагає наявності фармацевтичних та хірургічних альтернатив для зменшення впливу ожиріння на ризик раку ендометрія.
- Жінки; оздоровче ожиріння збільшує ризик раку ендометрія; Мережа новин клініки Майо
- Вплив вісцерального ожиріння на клініко-патологічні особливості у хворих на рак ендометрію
- Багато обличчя ожиріння та його вплив на ризик раку молочної залози
- Розуміння ожиріння дорослих - на здоров’я
- Розуміння ожиріння зсередини назовні Новий лабораторний метод виявляє ролі ГАМК у контролі