Роль сигналізації інсуліну в опосередкуванні специфічної для тканин харчової пластичності та стійкості у рогово-поліфенічного жука Телець-онтофаг
Анотація
1. Вступ
Коли швидкість росту різних ознак змінюється у відповідь на один і той же градієнт поживності, особини, що складаються з різнорідних чутливих ознак, зростатимуть не просто до різних загальних розмірів тіла, але також розвиватимуться різні загальні фігури. Це робить вивчення залежності від харчування зростання центральним для нашого розуміння регуляції розвитку та еволюційної диверсифікації форми. Реакції пластику на харчування та їх вплив на масштабування та форму можна дослідити шляхом вивчення статичних алометрій. Статичні алометрії дозволяють кількісно оцінювати розміри органів щодо розмірів тіла у особин тієї самої популяції [11], і численні дослідження тепер ілюструють, як диференційоване масштабування ознак всередині видів та еволюційні зміни в масштабних відносинах між видами відігравали вирішальну роль у генезі морфологічного різноманіття (наприклад, крила комах [12] та роги жуків [13]). Однак менш добре зрозумілі механізми розвитку, які регулюють точні, специфічні для органу реакції росту в межах харчових градієнтів: як організми регулюють екстремальні реакції росту деяких ознак, захищаючи інші від коливань навколишнього середовища?
Телець Онтофага це гнойовий жук, поширений у Середземному морі, а вдруге інтродукований у Північній Америці та Австралії. Самці цього виду розвиваються, як це характерно для багатьох представників цього роду, у дві альтернативні морфи залежно від живлення личинок: високе живлення личинок призводить до розвитку великих, рогатих, майор самці, які покладаються на агресивну бойову поведінку, щоб захистити самок, тоді як низькі харчові умови призводять до розвитку маленьких, безрогих, неповнолітній чоловіки, які покладаються на неагресивну поведінку, що крадеться, та конкуренцію сперми, щоб забезпечити можливості спарювання. Отримана в результаті алометрія довжини рогу - розмір тіла є сильно сигмовидною, а безрогі та рогаті морфи розділені різким порогом розміру тіла. Проміжні морфології існують у природних популяціях, але порівняно надзвичайно рідкісні [20].
Недавні дослідження в цій системі показали, що принаймні два шляхи є критичними регуляторами розміру тіла та залежності від харчування рогів. Doublesex (Dsx), основний член соматичного шляху визначення статі, сприяє зростанню рогів у великих чоловіків з високим харчуванням [21], і DSX RNAi усуває ріг рогів у великих чоловіків, що відповідає харчуванню. На противагу цьому, сигнальний шлях Їжака (Hh), найбільш широко вивчений за його роллю у формуванні візерунків передньої/задньої полярності, активно пригнічує ріг рогу у дрібних самців з низьким харчуванням та збиття згладжений (смо), ключовий активатор сигналізації Hh, індукує роги у личинок самців, інакше їм судилося перерости в безрогих неповнолітніх самців [22]. У сукупності ці дослідження продемонстрували, що як сигнали Dsx, так і Hh є критично важливими для індукції чи репресії рогів відповідно до розміру тіла, а також для належного формування порогового розміру тіла, що розділяє альтернативні чоловічі морфи. Однак, як дія будь-якого із шляхів координується у світлі стану харчування даної людини, залишається незрозумілою. Зокрема, чи пов'язані сигнали Dsx або Hh (або обидва) з компонентами сигналізації IIS, і, отже, харчування ще не вивчено.
У цьому дослідженні ми зупинились на двох паралогах рецепторів інсуліну, загальних для більшості комах, InR1 і InR2, так само, як Фоксо, для оцінки можливих функцій різноманітних членів шляху IIS у регулюванні чутливості та надійності харчування. Ми протиставили розвиток рогів, особливо чутливих до харчування, ознак чоловічих статевих органів (зокрема, едегу), нечутливих до харчування ознак. Крім того, ми перевірили, чи може сигналізація IIS діяти вище сигналів Dsx або Hh, або обох, забезпечуючи тим самим один або обидва шляхи інформацією щодо переважаючих харчових умов під час розвитку жуків.
2. Матеріал і методи
(а) Господарство жуків
Телець-онтофаг жуків збирали поблизу Блумінгтона, штат Індонезія, та Чапел-Гілл, штат Північна Кароліна, і вирощували та утримували в лабораторних колоніях, як описано раніше [23].
(b) Фоксо, InR1 і InR2 клонування та нокдаун RNAi
Грунтовки були розроблені проти О. Телець Фоксо, InR1 і InR2, і відповідні фрагменти клонували та секвенували для підтвердження ідентичності. Дволанцюгова РНК (dsRNA) для ін’єкцій RNAi була створена, як описано раніше [21]. Контрольну дРНК генерували за тією ж процедурою, використовуючи векторну послідовність. Були використані наступні концентрації дсРНК (розчинені в ін'єкційному буфері): контрольні ін'єкції та Фоксо РНКi (1 мкг дсРНК); InR1 RNAi (0,5, 1, 3, 6 або 9 мкг); InR2 РНКi (0,25, 1 мкг) та InR1+2 РНКi (0,5 мкг). У деяких випадках концентрація змінювалася, намагаючись поліпшити проникнення та знизити смертність. Всі ін'єкції були зроблені протягом останнього (= третього) періоду личинки.
(c) Кількісна ланцюгова реакція полімерази в режимі реального часу
(d) Алометричні вимірювання та аналізи
3. Результати
(а) Фоксо RNAi лінеаризує сигмоїдну розмірність тіла - алометрію розміру тіла
Нагадаємо, що розвиток рогу у самця О. Телець надзвичайно чутливий до харчування, в результаті чого утворюються дві альтернативні рогаті та безрогі морфи, розділені чітко визначеним порогом розміру тіла. Дослідити роль Фоксо у цьому чоловічому поліфенізмі з харчовою ознакою ми використовували виснаження транскриптів, опосередковане РНК-інтерференцією Фоксо після чого проводяться морфометричні оцінки довжини рогу щодо розміру тіла. Фоксо RNAi глибоко змінив цей нормально сильно сигмоподібний масштабний взаємозв'язок, індукуючи відносно довші роги у маленьких чоловіків з низьким харчуванням, одночасно поступово зменшуючи довжину рогів у кількох великих чоловіків з високим харчуванням, порівняно з особами, яким вводили ін'єкцію (рис. 1).a,b). Підгонка алометричних (сигмоїдальних) моделей до Фоксо РНК і особи, яким вводили контроль, виявили значну різницю у трьох з аналізованих параметрів: зменшення амплітуди (стор = 0,014), зміщення точки перегину до більших розмірів тіла (стор = 0,019) і висотою р-перехоплювати (стор 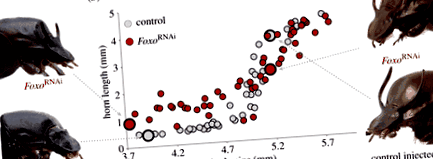
Рисунок 1. Ефект Фоксо RNAi на високочутливому до харчування, сигмовидному масштабному відношенні між розміром тіла та довжиною рогу. Фоксо РНК-індукований ріг рогу при низькому харчуванні, як правило, самці без рогів (a,b), в той час як поступово зменшує ріст рогів у деяких людей з високим харчуванням, як правило, повністю рогаті самці (b,c). Порівняння осіб, яким вводили контроль (сірий) та нокдаун (червоний), використовуючи незалежно встановлені рівняння Хілла з чотирма параметрами, за якими слідували формула Уелча т-тести для порівняння оцінок параметрів виявили значну різницю в амплітуді, точці перегину, р-перехоплення, але не нахил. Порівнюючи AIC та Р. 2 значення між сигмоїдальною та лінійною моделями для обох груп лікування виявили велику різницю у придатності для осіб, яким вводили контрольну групу, вказуючи на те, що сигмовидна модель найбільш точно фіксує масштабну залежність між розміром тіла та довжиною рогу. Навпаки, пристосування сигмовидної моделі до Фоксо Особи з RNAi лише незначно покращують придатність порівняно з простою лінійною регресією, припускаючи це Фоксо RNAi частково перетворює алометрію розміру тіла - довжини рогу від сильно сигмоїдної до більш лінійної залежності. (Інтернет-версія у кольорі.)
Для подальшої оцінки гіпотези, що Фоксо RNAi лінеаризує нормальну сигмоїдальну величину тіла - алометрію довжини рогу, ми підігнали або сигмоїдну, або лінійну модель до кожної з наших груп лікування та вивчили обидві Р. 2 та значення AIC. Як і очікувалося, Р. 2 значення максимізуються у контрольно введених тварин при застосуванні сигмовидної моделі (Р. 2, сигмоїдна = 0,943, Р. 2, лінійний = 0,671); однак ця невідповідність придатності зменшується в Фоксо РНК-самці (Р. 2, сигмоїдна = 0,884, Р. 2, лінійний = 0,759). Аналогічно, значення AIC вказують на вищу придатність сигмовидної моделі до осіб, яким вводять ін'єкцію (AIC сигмоїдна = 33,73, AIC лінійна = 115,25), але показує, що ця невідповідність зменшується в Фоксо RNAi-чоловіки як за рахунок зменшення придатності сигмоїдної моделі (AIC сигмоїдна = 61,19), так і пропорційного збільшення придатності лінійної моделі (AIC-лінійної = 95,15). У сукупності ці результати підтверджують гіпотезу про те, що Фоксо RNAi значно зменшує сигмоїдальний характер алометрії розміру тіла та довжини рогу, перетворюючи її натомість до більш лінійного масштабного співвідношення.
(b) InR RNAi не впливає на алометрію розміру тіла – розміру рогу
(c) Foxo регулює чутливість до харчування, тоді як InR регулює загальний розмір геніталій
Далі ми дослідили, чи може інгулінологічна сигналізація також відігравати роль у регуляції нечутливості до харчування, тобто до буферизації росту внаслідок харчових змін. Для цього ми зосередились на розвитку чоловічого геніталій, зокрема едегуса, структури, абсолютний розмір якої лише незначно змінюється в залежності від живлення личинок. Зокрема, ми вимірювали довжину еду у контрольно введеному, Фоксо РНКі, InR1 РНКі, InR2 РНКі і InR1+2 РНК-особини. Наші результати свідчать про це Фоксо RNAi суттєво змінив співвідношення розмірів тіла до едегуса (т = 4,011, стор = 0,0001), що призводить до подальшого зменшення схилу геніталій – алометрія розміру тіла (т = −4.122, стор RNAi привів до зменшення розміру едегуса відносно розміру тіла в поперечнику всі розміри тіла (т = −4.502, стор RNAi (малюнок 2c; електронний додатковий матеріал, таблиця S3) та InR1+2 RNAi (малюнок 2d; електронний додатковий матеріал, таблиця S3; InR2лікування: т = -2,574, стор = 0,0123; InR2розмір тіла: т = 13. 284, стор
Рисунок 2. Ефекти Фоксо РНКі, InR1 РНКі, InR2 РНКі і InR1+2 RNAi про здебільшувальну залежність між розмірами тіла та довжиною чоловічих статевих органів, нечутливими до харчування. Показані особи, яким вводять контроль (сірі) та нокдауни (червоні). (a) Фоксо RNAi призвів до значного зменшення нахилу розміру тіла - алометрії геніталій, тоді як (b) InR1 RNAi, (c) InR2 RNAi та (d) InR1+2 RNAi суттєво зменшив розмір геніталій для всіх розмірів тіла. На всіх чотирьох панелях показано однакові контрольні особи. (Інтернет-версія у кольорі.)
(d) DSX і смо рівні експресії можуть регулюватися сигнальним шляхом інсуліну
Малюнок 3. Личинка DSX і смо рівні експресії у контрольно введених осіб та наступних Фоксо РНКі, InR1 РНКі, InR2 РНКі і InR1+2 РНКі. (a) qRT-ПЛР із використанням личинок всього тіла показує це DSX на рівні вираження не впливає Фоксо РНКаі або InR1 RNAi, але суттєво знижений після InR2 RNAi і незначно суттєво знижується після InR1+2 РНКі. Це говорить про те, що InR2, але ні InR1, сприяє DSX експресія у особин дикого типу. (b) смо рівні експресії значно знижуються після Фоксо RNAi, але не зазнає впливу InR1 РНКі, InR2 РНКі і InR1+2 RNAi, припускаючи це Фоксо сприяє смо експресія у особин дикого типу. Графіки вікон відображають 25% і 75% квартилів (коробки), медіани (лінії, що розділяють коробки), найвіддаленіші значення (вуса), викиди (крапки) та точки даних (крапки, що перекриваються коробками та вусами). *стор • стор
Подібний підхід на стадії лялечки дав, частково, разюче різні результати. Поки Фоксо RNAi не впливав DSX експресія через 24 год після ін'єкції личинки в отриманих лялечок DSX експресія демонструвала збільшення на 34% (електронний додатковий матеріал, малюнок S6a). Подібним чином, лялечка смо вираження зросло після обох Фоксо РНКі і InR1 RNAi, тоді як личинки демонстрували зменшення або відсутність змін у експресії, відповідно (електронний додатковий матеріал, малюнок S6b). Ці результати свідчать про те, що характер взаємодій між ними dsx, smo і члени IIS можуть змінюватися протягом розвитку та/або що на пізніші стадії розвитку можуть впливати компенсаторні корективи в динаміці експресії в результаті збурень RNAi. У більш загальному плані ці результати піднімають можливість того, що IIS може надати харчову інформацію, критичну для подальшої дієтичної залежності специфічних регуляторів росту, що залежить від харчування.
4. Обговорення
(а) ФоксоРоль у розвитку та еволюції масштабування розміру сигмоїдального рогу
(b) Фоксо регулює як пластичність, так і міцність у певних тканинах
(c) InR регулює едегус, але не ріст рогів
Наші результати також вказують на можливість розвитку взаємодій між ними InR і гормони линьки, на що вказує фенотип линьки, виявлений після високих доз InR1/ 2 ін'єкції RNAi, зазначені раніше. Попередні дослідження на комах задокументували взаємодію між IIS та двома основними гормонами линьки - екдизоном та ювенільним гормоном (JH; [38,39]). Цікаво, що екдизон також брав участь у регулюванні Дрозофіла ріст імагінального диска [40], а JH сприяє регулюванню росту, що відповідає харчуванню, у мандибулах жуків-оленів [41]. Порівняльні дослідження між таксонами та шляхами необхідні для подальшого розмежування шляхів розвитку та еволюції до різної харчової пластичності для різних типів ознак.
(г) Інсулін/інсуліноподібний сигнальний шлях взаємодіє з обома DSX і смо регулювати ріст, чутливий до харчування
І навпаки, ми також знаходимо це InR2 RNAi (але ні Фоксо RNAi, або InR1 RNAi) призводить до зменшення DSX але ні смо, узгоджується з роллю одного з паралогів рецепторів інсуліну у просуванні DSX вираження і тим самим ріст рогу. На відміну від нашого Фоксо Однак результати RNAi, InR2 RNAi робить ні фенокопія DSX Фенотипи рогів RNAi, що робить ці результати необхідними для подальшого вивчення. Таким чином, наші результати разом надають важливі докази, підтверджуючи, що сигналізація IIS може надати важливу поживну інформацію про шляхи Hh (через Foxo) та можливі Dsx (через InR2), які потім трансформують цю інформацію для інструктажу реакцій на зростання органів (рисунок 4).
На закінчення, наші результати свідчать про те, що у рогово-поліфенічного жука О. Телець, як харчова чутливість, так і нечутливість можуть регулюватися різними компонентами шляху IIS та їх взаємодією з DSX і Hh сигналізація на різних частинах тіла. Зростаюча кількість досліджень, що стосуються різноманітних компонентів IIS як у напівгемо-, так і в голометабольних комах, підтверджує гіпотезу про те, що цей шлях може бути гарячою точкою для еволюції росту ознак, чутливих до поживних речовин [5,18,19], включаючи, як пропонують результати цього дослідження, еволюційний перехід від лінійних до сильно сигмоїдальних алометрій. Однак конкретні компоненти IIS та їх взаємодія з іншими шляхами (наприклад, TOR, бегемот, Dsx та Hh) вимагатимуть подальших досліджень, щоб роз'єднати шляхи розвитку та еволюції до диференціальної харчової пластичності між різними типами ознак у різних родовідних лініях.
Етика
Усі процедури на тваринах дотримувались Керівних принципів АБС щодо використання тварин у дослідженнях. Тварин утримували в найкращих можливих умовах, виходячи з біології цього виду. У дослідженні брали участь поширені види комах, перевірка яких не вимагалась установою чи урядовим регуляторним органом.
- Чи є роль хірургічного втручання у лікуванні тиреоїдиту Хашимото Гарвардський журнал охорони здоров’я - Гарвард
- Преміум-пакет для схуднення Isagenix Знижка до 45% - Поживне очищення
- Як китайські харчові етикетки на проспекті століття
- Чи вимагає ваш ресторан законом розміщувати інформацію про харчові продукти MenuTrinfo
- Харчові цінності італійської їжі Наше повсякденне життя