Раннє старіння та вікові патології у мишей з дефіцитом BMAL1, основного компонента циркадного годинника
Роман В. Кондратов
1 Відділ біології раку, Науково-дослідний інститут Лернера, Фонд клініки Клівленда, Клівленд, штат Огайо, 44195, США;
Кондратова Анна Олександрівна
2 Відділ молекулярної генетики, Науково-дослідний інститут Лернера, Клінічний фонд Клівленда, Клівленд, Огайо 44195, США
Вікторія Юрійовна Горбачова
1 Відділ біології раку, Науково-дослідний інститут Лернера, Фонд клініки Клівленда, Клівленд, штат Огайо, 44195, США;
Олена Василівна Вихованець
1 Відділ біології раку, Науково-дослідний інститут Лернера, Клінічний фонд Клівленда, Клівленд, Огайо 44195, США;
Марина П. Антох
1 Відділ біології раку, Науково-дослідний інститут Лернера, Фонд клініки Клівленда, Клівленд, штат Огайо, 44195, США;
Анотація
Миші з дефіцитом циркадного фактора транскрипції BMAL1 (ARNT-подібний білок головного мозку та м’язів) мають порушення циркадної поведінки та демонструють втрату ритмічності в експресії генів-мішеней. Тут ми повідомляємо, що миші Bmal1 -/- зменшують тривалість життя і демонструють різні симптоми передчасного старіння, включаючи саркопенію, катаракту, менше підшкірного жиру, усадку органів та інші. Фенотип раннього старіння корелює із підвищеним рівнем активних форм кисню в деяких тканинах тварин Bmal1 -/-. Ці висновки, разом із даними щодо CLOCK/BMAL1-залежного контролю стресових реакцій, можуть надати механістичне пояснення раннього виникнення вікових патологій за відсутності BMAL1.
Результати і обговорення
Оскільки генетичний фон помітно впливає на фенотип даної одногенової мутації у мишей, для вирішення ролі BMAL1 у нормальній фізіології ми спочатку перенесли мутацію до штаму миші C56BL/6J (12 поколінь із зворотним кросом). Через безпліддя мутантів колонія Bmal1 -/- підтримувалась шляхом розведення гетерозиготних тварин, які дали потомство всіх трьох генотипів із очікуваним співвідношенням. Тварини KO та їх однолітки дикого типу спостерігали протягом усього життя на предмет розвитку всіх видів патологічних змін.
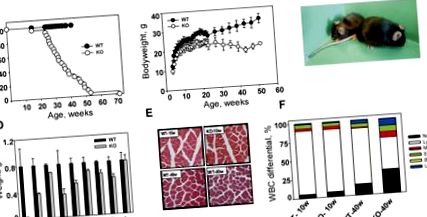
Тривалість життя тварин KO значно зменшилась у порівнянні з однолітками дикого типу (рис. (Рис. 1А). 1А). Більшість мутантів померли у віці від 26 до 52 тижнів (середня тривалість життя 37,0 ± 12,1 тижнів), тоді як жодна з мишей дикого типу та гетерозиготних не померла протягом періоду дослідження (52 тижні). Середня тривалість життя тварин C57BL/6J перевищує 2 роки (Nadon 2006); більш ніж удвічі довший, ніж той, що спостерігається для тварин KO. Найдовше живий мутант помер у віці 72 тижнів, що приблизно вдвічі коротше максимальної тривалості життя у цього штаму. Залежних від статі різниць у смертності не спостерігалося.
Передчасне старіння та рання смерть у мишей Bmal1 KO. (А) Крива виживання Каплана-Мейєра. (Замкнені кола) Миші дикого типу (WT); (відкриті кола) миші KO. Тварин дикого типу старше 1 року приносили в жертву. (B) Вікові зміни маси тіла чоловіків дикого типу (WT) та KO. (Замкнені кола) Миші дикого типу; (відкриті кола) KO миші. (C) Валовий вигляд 1-річних мишей дикого типу (WT) (праворуч) та KO (ліворуч). (D) Вага основних органів мишей, яким було 40 тижнів. (Чорні смуги) Дикий тип (WT); (сірі смуги) КО. Всі органи тварин КО, за винятком печінки, значно менші, ніж дикого типу (р -/- тварини. Фарбування гематоксиліном та еозином (H&E) поперечних зрізів чотириголового м’яза стегна у 10- та 40-тижневих тварин обидва генотипи. (F) Диференціала лейкоцитів у молодих (10-тижневих) та вікових (40-тижневих) тварин дикого типу (WT) та KO. Кожна стопка в барі відображає відсоток типу клітин. (Neutr) Нейтрофіли; (Лімфа) лімфоцити; (Моно) моноцити; (Eos) еозинофіли; (Базо) базофіли; (LUC) великі незабарвлені клітини. У вікових мишей KO відсоток лімфоцитів зменшується, а відсоток моноцитів/нейтрофілів збільшується.
При народженні тварини KO не мають жодних видимих дефектів і їх неможливо відрізнити від диких типів послідів. Однак у віці 16–18 тижнів (для самців та жінок відповідно) миші Bmal1 -/- починають спостерігати затримку росту, про що свідчить знижена маса тіла. У той час як вага тварин дикого типу постійно зростала протягом 52 тижнів дослідження, вага мутантів перестала збільшуватися у віці 16-26 тижнів, а потім почала зменшуватися (рис. (Б); 1В; Додатковий рис. 1). Як результат, 52-тижневі миші KO мають приблизно половину розміру мишей дикого типу (рис. (Рис. 1C 1C).
Щоб дослідити причину втрати маси тіла, яка спостерігається у тварин KO, ми виміряли масу основних органів та тканин у 10-, 30- та 40-тижневих тварин обох генотипів. У віці 10 тижнів усі основні органи мишей дикого типу та КО були еквівалентними за розміром, за винятком насінних бульбашок, які були меншими у тварин Bmal1 -/-. Це зменшення, яке стає більш вираженим з віком, швидше за все, відображає дефект статевого дозрівання у мишей KO, що призводить до чоловічого безпліддя.
Встановлено, що відмінності у загальній масі тіла 40-тижневих тварин дикого типу та KO носять головним чином вплив на зменшення маси жирової та м’язової тканин у мишей KO (рис. (Рис. 1D). 1D). Середня маса внутрішньочеревної жирової тканини становила 1,5 г у чоловіків дикого типу віком 40 тижнів, але лише 70 мг у вікових та статевих КО. Підшкірно-жировий шар також значно зменшився у мутантів (рис. (Рис. 2). 2). Цей фенотип надзвичайно контрастує зі схильністю до ожиріння, що спостерігається у мишей-мутантів Clock/Clock (Turek et al. 2005). Існує кілька можливих пояснень цих контрастних фенотипів. Транскрипційний комплекс CLOCK/BMAL1 не може утворитися в клітинах з дефіцитом Bmal1, тоді як у клітинах Clock/Clock мутантний білок CLOCK зберігає здатність димеризуватися з BMAL1. Як нещодавно повідомлялося, комплекс CLOCK/BMAL1 проявляє подвійну функціональну активність, працюючи як активатор транскрипції, так і репресор транскрипції, залежно від його взаємодії з CRY. Як наслідок, обидві функції комплексу втрачаються в Bmal1-дефіцитних клітинах, тоді як у мутантних клітинах Clock порушується лише трансактивація (Kondratov et al. 2006b). В якості альтернативи спостережувані фенотипові відмінності між мишами Bmal1 -/- та Clock/Clock можна пояснити взаємодією CLOCK та BMAL1 з різними функціональними партнерами.
Вікові патології шкіри у мишей KO. (A) Відростання спинного волосся через 1 місяць після гоління спостерігали у мишей дикого типу (WT) (ліворуч), але не KO (праворуч). (B) Фарбування H&E поперечних зрізів шкіри у 10-тижневих мишей дикого типу (WT) та KO не виявляє жодних морфологічних відмінностей між генотипами. (SAT) Підшкірна жирова тканина. (C) Фарбування H&E поперечних зрізів шкіри демонструє різке зниження рівня SAT у 40-тижневих мишей KO.
Сорокатижневі тварини Bmal1 -/- також демонструють вікове зменшення м’язової та кісткової маси (рис. (Рис. 1D). 1D). Обидва явища (саркопенія старіння та остеопороз) є ознаками старіння ссавців (Weiss et al. 1991; Karakelides and Sreekumaran Nair 2005). Гістологічне дослідження поперечних зрізів чотириголового м’яза стегна показало, що зменшена м’язова маса у тварин КО пов’язана зі зменшенням кількості м’язових волокон та їх діаметру. Цей дефект залежить від віку, оскільки 10-тижневі тварини не виявляють ніяких відмінностей у структурі м’язових волокон між генотипами (рис. (Рис. 1E 1E).
На додаток до жиру, м’язів та кісток, маса кількох основних органів (селезінки, нирок, яєчок, серця та легенів) значно зменшилась у 40-тижневих тварин KO (рис. 1D). 1D ). Водночас між генотипами не було відмінностей у розмірі шлунка, печінки чи кишечника. У віці 30 тижнів у КО лише селезінка була значно меншою порівняно з тваринами дикого типу (Додаткова Рис. 2). Усі інші органи знаходились лише на нижній межі норми нормальної ваги. Гістологічне дослідження KO селезінки та нирок не виявило жодних дегенеративних уражень (дані не наведені), що дозволяє припустити, що їх менший розмір не обумовлений гострим дегенеративним процесом, а скоріше наслідком систематичного зменшення. Вікове зменшення селезінки, нирок і яєчок спостерігалося під час природного старіння, а також на тваринних моделях прискореного старіння (Arking 1998; Tyner et al. 2002).
Миші Bmal1 -/- також демонструють вікові зміни складу периферичної крові. Загальна кількість клітин крові у молодих (10-тижневих) та вікових/дорослих (40-тижневих) КО та мишей дикого типу не виявляє різниці в кількості еритроцитів або тромбоцитів. Кількість білих кров'яних клітин (лейкоцитів) була однаковою у молодих тварин обох генотипів і зменшувалася з віком подібним чином, як очікувалося (Razzaque et al. 2006); однак це зниження було трохи більш вираженим у мишей KO (додаткова фіг. 3). Більш помітні BMAL1-залежні зміни спостерігались у диференціалах лейкоцитів. Загальна кількість та відсоток нейтрофілів та моноцитів у 40-тижневих мишей Bmal1 -/- були майже вдвічі більшими, ніж у контрольних груп за віком, тоді як кількість та відсоток лімфоцитів зменшувались (рис. (Рис. 1F 1F).
Ще одна відмітна риса старіння ссавців, зменшення росту волосся, також спостерігалася у мишей Bmal1 -/- (Harrison and Archer 1988; Tyner et al. 2002). Коли дорсальні сегменти шкіри голили на 30-тижневих тваринах, усі чотири випробувані миші дикого типу показали повне відростання за один місяць. На відміну від цього, лише один із п’яти КО продемонстрував часткове відростання через 3 місяці (рис. (Рис. 2А). 2А). Подібно до інших описаних фенотипів, це явно віковий дефект, оскільки 10-тижневі миші KO демонстрували міцне відростання волосся після гоління (дані не наведені).
Зменшення підшкірної жирової тканини (SAT) є основним маркером постарілої шкіри багатьох ссавців, включаючи мишей та людей (Chuttani and Gilchrest 1995). Гістологічне дослідження поперечних зрізів спинної шкіри у 10-тижневих мишей дикого типу та KO не показало істотних відмінностей у структурі шкіри (рис. (Рис. 2B). 2B). На противагу цьому, шкіра 40-тижневих мишей KO демонструвала вражаюче зниження рівня SAT (рис. (Рис. 2C). 2C). Хоча цей фенотип можна пояснити роллю BMAL1 у диференціації адипоцитів у культурі клітин, як нещодавно повідомлялося (Shimba et al. 2005), більш вірогідно, що він відображає віковий процес, оскільки різниці в SAT у молодняк. Крім того, нормальна кількість жирової тканини була в інших місцях, включаючи отвір, натоптиш та кістковий мозок у тварин усіх вікових груп (дані не наведені).
Вікові патології очей у мишей Bmal1 -/-. H&E фарбування поперечних зрізів очей мишей 30-тижневого дикого типу (WT) та KO. (Co) рогівка; (Ir) райдужка; (Le) лінза; (Пере) сітківка. (А) Патологічні зміни рогівки та кришталика мишей KO. (B) Збільшення задньої зони лінзи (синій прямокутник в A). Наконечники стріл вказують на ядра епітеліальних клітин, що проникають у задню зону лінзи KO. (C) Збільшення зазначеної зони рогівки (червоний прямокутник в А). Гостре запалення рогівки у мишей KO характеризується неоваскуляризацією (жовті наконечники стріл), інфільтрацією лімфоїдних клітин (сині наконечники стріл) та виразкою (червона стрілка).
У сукупності спектр фенотипів, що спостерігається у мишей Bmal1 -/-, з віком свідчить про те, що BMAL1 відіграє важливу роль у підтримці гомеостазу тканин. На додаток до порушення циркадної функції, дефіцит Bmal1 призводить до фенотипу, подібного до прогерії, який безпосередньо пов'язує цей фактор транскрипції з контролем процесу старіння.
Висунуто десятки теорій, що передбачають дерегуляцію різних шляхів як основну причину старіння. Незважаючи на свої відмінності, більшість сучасних теорій вважають окислювальний стрес вирішальним фактором, пов'язаним з дегенеративними процесами, що відбуваються під час старіння (Balaban et al. 2005). Реактивні форми кисню та азоту (АФК та АНС відповідно) є важливими регуляторами клітинного метаболізму, експресії генів та інших молекулярних реакцій, відіграючи ключову роль у контролі різних фізіологічних процесів. У той же час, висока концентрація вільних радикалів та реакційно-здатних видів, отриманих радикалами, таких як АФК та РНС, мають шкідливий вплив на всі основні біологічні макромолекули. Окислювальні пошкодження можуть прискорити або навіть спричинити старіння, сприяючи віковим дегенеративним захворюванням. Дійсно, було продемонстровано, що старіння пов'язане з підвищенням рівня АФК та окислених продуктів у різних тканинах (Балабан та ін., 2005).
BMAL1 бере участь у регуляції рівня АФК. (A) Рівні АФК, що вказуються відносною флуоресценцією DCF у тканинних екстрактах мишей дикого типу (WT) та КО 30-тижневого віку. (B, C) Залежне від віку підвищення рівня АФК у нирках (B) та селезінці (C) мишей KO. Було використано принаймні чотири тварини кожної вікової групи та генотипу. (*) p (рис. 4D). 4D). Як і слід було очікувати, знижений рівень BMAL1 призвів до зниження експресії відомих транскрипційних мішеней BMAL1, таких як Period1, який показав у п'ять разів нижчу експресію у 1686 клітинах, ніж у батьківських клітинах L929 (рис. (Рис. 4E). 4E). Важливо, що опосередковане siRNA інгібування BMAL1 спричинило підвищення регуляції рівнів АФК (рис. (Рис. 4F). 4F). Разом з раніше опублікованими даними, що стосуються циркадної системи в окисно-відновному контролі (Hardeland et al. 2003), наші результати свідчать про те, що циркадна система, ймовірно, є важливою системою контролю АФК, що працює як в нормальних фізіологічних умовах, так і під час окисного стресу. Дійсно, рівні зовнішніх (що генеруються їжею) та внутрішніх (метаболізм/активність) окисників змінюються протягом дня в результаті коливань споживання їжі та поведінки. Отже, контроль гомеостазу АФК/RNS циркадною системою, яка невід’ємно пов’язана з повсякденною діяльністю організму, забезпечить найефективніший захист від згубної дії окисників у будь-який час доби. У той же час дисбаланс між циркадною та генеруючими/метаболізуючими системами АФК/РНС може збільшити пошкодження внаслідок окисного стресу, сприяючи тим самим та/або ускладнюючи патогенез та старіння.
Основне питання, порушене нашими даними, полягає в тому, як дефіцит Bmal1 призводить до розвитку вікових патологій. Як повідомляється тут, контроль за гомеостазом АФК BMAL1, ймовірно, є лише одним із відповідальних шляхів. Інші потенційні механізми можуть включати BMAL1-залежний контроль стресової реакції або дисбалансу в ендокринній та/або метаболічній системах, які, ймовірно, знаходяться під циркадним контролем. Ці механізми, в свою чергу, можуть впливати на рівень АФК. Крім того, нещодавно повідомляється про роль BMAL1 у гомеостазі глюкози та порушенні толерантності до глюкози та чутливості до інсуліну у тварин Bmal1 -/- (Rudic et al. 2004) свідчить про можливий зв’язок між циркадною системою та фактором росту інсулін/інсулін (IGF) шляхи, які, як відомо, беруть участь у контролі тривалості життя у різних організмів (Bordone and Guarente 2005; Katic and Kahn 2005).
Старіння - це складний процес, на який впливають як генетичні фактори, так і фактори навколишнього середовища. Фенотипи передчасного старіння були описані у мишей з цілеспрямованим порушенням генів, що беруть участь у контролі швидкості мутації, регуляції стабільності хромосом і теломер, гомеостазі АФК, апоптозі, реакції на стрес та шляху інсуліну/IGF (Tyner et al. 2002; Mounkes et 2003; Чанг та співав. 2004; Трифунович та ін. 2004; Куйот та ін. 2005; Куросу та ін. 2005). Мишача модель дефіциту BMAL1 поширює цей список в особливо цікавому напрямку. BMAL1 - ключовий компонент циркадної системи, який бере участь у взаємодії організму з навколишнім середовищем; отже, це унікальний приклад, коли генетичні порушення нормальної взаємодії організму з навколишнім середовищем прискорюють старіння. Ефективна реакція організму на зовнішні та внутрішні подразники (включаючи генотоксичний стрес) залежить від синхронізованої активності/експресії декількох генів. Як фактор транскрипції, BMAL1 може організувати багато процесів, керуючи компонентами, що обмежують швидкість, різних шляхів. У той же час BMAL1 має потенціал діяти через незалежні від транскрипції механізми. Як ми нещодавно повідомляли, BMAL1 є важливим регулятором посттрансляційної модифікації та деградації CLOCK, NPAS2 та, мабуть, інших білків (Kondratov et al. 2003, 2006a).
Підсумовуючи, ми повідомляємо тут про численні фенотипічні зміни та патології у мишей Bmal1 -/-, які характерні для передчасного старіння. Подальші дослідження пояснять роль BMAL1 та інших компонентів циркадної системи у природному старінні мишей та людей. Поліпшення розуміння взаємозв'язку між старінням та циркадною годинниковою системою, а також виявлення транскрипційних цілей BMAL1, які беруть участь у старінні, в кінцевому підсумку може призвести до розробки стратегій запобігання та/або лікування вікових патологій.
Матеріали і методи
Тварини
Мишей Bmal1 -/- отримували від К. Бредфілда (Університет Вісконсина) і повторно перетинали до штаму C57BL/6J протягом 12 поколінь. Потім гетерозиготи були схрещені, щоб отримати тварин усіх трьох генотипів. Мишей генотипували методом ПЛР, як описано раніше (Bunger et al. 2000). У всіх експериментах в якості контролів використовували однолітки дикого типу. Всім тваринам витримували цикл 12 год: 12 год світло: темно. Для моніторингу збільшення/втрати маси тіла тварин зважували раз на тиждень. Мишей спостерігали щодня для оцінки смертності. Для характеристики росту волосся спини мишей голили і спостерігали за відростанням волосся протягом 3 місяців. Усі дослідження на тваринах проводились відповідно до норм Комітету з догляду за тваринами та використання при Фонді клініки Клівленда.
Загальний аналіз клітин крові
Загальний аналіз клітин крові проводили на зразках, отриманих шляхом ретро-орбітальної кровотечі, як описано раніше (Горбачова та ін., 2005).
Збір тканин та гістологія
Збір тканин та гістологічний аналіз проводили із застосуванням стандартних методик (див. Додатковий матеріал).
Культура клітин, Вестерн-блоттінг та конструкції siRNA
Клітини L929 підтримували у модифікованому середовищем Eagle (DMEM) Дульбекко, доповненому 10% фетальною бичачою сироваткою. Для стабільної експресії siRNAs, націлених на Bmal1, ми використовували рекомбінантний лентівірус, який містить касету експресії siRNA в області U3 правої LTR. Детальна інформація про генерацію лентівірусу міститься у Додатковому матеріалі.
Вимірювання рівнів АФК
Рівні АФК визначали в тканинних екстрактах із застосуванням чутливого до АФК флуоресцентного барвника дихлоргідідрофлуоресцеїну (DCF), як описано раніше (Radak et al. 2004). Деталі аналізу включені в додатковий матеріал.
- Емілі Фіореллі вагітна другою дитиною; Мої перші дні вагітності ніколи не бувають легкими; Бобр
- GNC BodyDynamix Slimvance Core комплекс для схуднення Стимулятор Безкоштовно, 60 капсул Неароматизовані в Інтернеті в
- Виконайте основні вправи Школа масажної терапії Burn Belt Fat Bancroft
- Догляд за людьми з деменцією після закінчення життя Національний інститут старіння
- Основні силові вправи з використанням м’яча для тренажерного залу, гірськолижного форуму snowHeads