Поліпшення хвороби Clostridium difficile у мишей за допомогою дієтичних добавок з індол-3-карбінолом
Уокер Джулліард
* Відділ трансплантаційної хірургії, Кафедра хірургії, Університет Вісконсинської школи медицини та громадського здоров'я, Медісон, штат Вісконсин, США
Тревіс Де Вульф
† Департамент харчових наук Університету Вісконсіна, Медісон, штат Вісконсин, США
Джон Х. Фехнер
* Відділ трансплантаційної хірургії, Кафедра хірургії, Університет Вісконсинської школи медицини та громадського здоров'я, Медісон, штат Вісконсин, США
Насія Сафдар
‡ Відділення інфекційних хвороб, кафедра хірургії, Університет Вісконсинської школи медицини та громадського здоров’я, Медісон, штат Вісконсин, США
Рашмі Агні
§ Кафедра патології та лабораторної медицини, Університет Вісконсинської школи медицини та громадського здоров'я, Медісон, штат Вісконсин, США
Джошуа Д. Мезріч
* Відділ трансплантаційної хірургії, Кафедра хірургії, Університет Вісконсинської школи медицини та громадського здоров'я, Медісон, штат Вісконсин, США
Пов’язані дані
Анотація
Об’єктивна
Визначити терапевтичний ефект дієтичних добавок на інфекцію C. difficile (CDI).
Передумови
Завдяки обмеженим можливостям лікування зростання захворюваності на Clostridium difficile стимулювало пошук нових методів лікування. Останні дані визначають роль арильних вуглеводневих рецепторів (AHR) та лігандів AHR, отриманих з дієти, у імунітеті слизової. Ми досліджували ефективність індол-3-карбінолу (I3C), харчової добавки та ліганду-попередника AHR, на мишачій моделі CDI.
Методи
Мишей C57BL/6 (B6), AHR -/- та AHR +/− розміщували на дієтах на основі зерна або напівочищених з I3C або без неї до і під час CDI. Мишей спостерігали клінічно протягом мінімум 6 днів або евтаназували між 0 і 4 днями щеплення для аналізу запальної реакції та мікробіоти.
Результати
Миші В6, які харчуються напівчищеною дієтою з дефіцитом ліганду AHR, суттєво збільшують ступінь тяжкості захворювання (р. 1. Порушення мікробіома кишечника після застосування антибіотиків є основним фактором ризику захворювання, асоційованого з C. difficile (CDAD) у людей 2 Інші фактори ризику включають вік, придушення кислоти, імунодепресію, шлунково-кишкові операції та запальні захворювання кишечника 3–5. Основним методом лікування гострих інфекцій є антибіотики. Однак у 20 відсотків пацієнтів спостерігається рецидив ІХС, який може бути стійким до подальшого лікування антибіотики 6. Для цих пацієнтів випробовуються нові методи лікування, такі як пробіотики та трансплантація калової мікробіоти 7, 8. Ефективність пробіотиків для запобігання інфекції нещодавно була поставлена під сумнів 9, і медична спільнота не має варіантів профілактики захворювань, які підтверджено даними, крім мінімізації вживання антибіотиків та придушення кислоти. Трансплантація калу при рецидивуючому/стійкому захворюванні показала деякі обіцяють 8, 10, але бар'єри для його прийняття включають труднощі в контролі якості, інфекційні проблеми та дозування.
Хоча мишачі моделі продемонстрували важливість цілісності мікробіомів у мінімізації CDI 11, імунні клітини хазяїна та їх реакція також виявилися критичними. Сюди входить наявність вроджених лімфоїдних клітин групи 3 (ILC3s 12) та експресія IL-22 13. Рецептор арильних вуглеводнів (AHR) має вирішальне значення для розвитку та підтримання ILC3, а також внутрішньоепітеліальних лімфоцитів (IEL) кишечника 14, 15 та мишей, які перебувають на напівчищеній дієті без фітохімічних речовин (містять мінімальний AHR ліганди) демонструють зниження кількості клітин IEL та ILC3 порівняно з мишами на стандартному чау. Додавання ліганду-попередника AHR індол-3-карбінолу (I3C) до очищеного раціону зменшує цю втрату клітин 14, 15. І IEL, і ILC3 є основними джерелами IL-22 в кишечнику 16, 17, і AHR є життєво важливим для експресії IL-22 у цих підгрупах лімфоцитів, а також у звичайних Т-клітинах 18, 19. На додаток до підтримання імунних клітин, ліганди AHR, отримані з дієти та мікробіому, показали свою ефективність у лікуванні/поліпшенні різних інфекційних захворювань (вагінального кандидозу) на поверхнях слизової оболонки у мишей залежно від IL-22 20 .
Використовуючи цю інформацію, ми висунули гіпотезу про те, що включення I3C у раціон може зменшити тяжкість CDI. Для перевірки цієї гіпотези ми використали добре усталену мишачу модель CDAD 21. Якщо це справді так, такий висновок свідчить про те, що додавання простої та безпечної дієтичної добавки, розпочатої незадовго до запланованих антибіотиків або інших заходів, що підвищують ризик розвитку ІХС, може мати ефективність у зменшенні захворюваності на цю надзвичайно поширену та сильно виснажливу хворобу.
МЕТОДИ
6–8-тижневих самців мишей C57BL/6j (B6) придбали у лабораторії Джексона (Bar Harbor ME). Для деяких експериментів мишей В6 поміщали або в чау на основі зерна, або в спеціальну чау, підготовлену до вмісту 1000 ppm I3C протягом усіх експериментів. Для тих експериментів, де бажана дієта з низьким вмістом лігандів AHR, мишей поміщали або на «напівочищену дієту» (напівчищена дієта AIN-76A; TestDiet, Сент-Луїс, Міссурі), або на «дієту I3C» (AIN- 76A, що містить 1000 ppm I3C) протягом решти досліджень. Мишей гетерозигот AHR (AHR +/−), які мають експресію AHR, рівну експресії мишей дикого типу B6, та мишей нульового рівня AHR (/ AHR -/-) на тлі C57BL/6J виводили та підтримували в конкретних умовах, вільних від патогенів. Експерименти на тваринах проводили відповідно до інституційних вказівок. Всі процедури були затверджені Університетом Вісконсинської школи медицини та охорони здоров'я IACUC.
Введення антибіотиків та зараження Clostridium difficile
Модель була прийнята з методів Chen 21. Мишей спостерігали/оцінювали двічі на день на наявність ознак клінічного захворювання та зважували щоранку. Експеримент припинявся, коли всіх мишей евтаназували на основі таких критеріїв: клінічні показники> 13, втрата ваги> 20% або на 7 день після щеплення. Усі оцінки були зроблені слідчими, засліпленими експериментальною групою. Гістологію сліпої кишки досліджував та оцінював один засліплений гістопатолог, як описано в додатку.
Збір тканин і стільця
Модифікована версія раніше опублікованого протоколу 23 була використана для підготовки сліпої кишки до гістології та RT-PCR. Кал мишей збирали і зберігали при -80 ° C до подальшої обробки та аналізу мікробіомів.
Проточна цитометрія
Клітини клітин збирали, використовуючи модифіковану версію раніше опублікованого протоколу 24. Клітини IEL та lamina propria (LM) аналізували за допомогою проточної цитометрії.
Статистичний аналіз
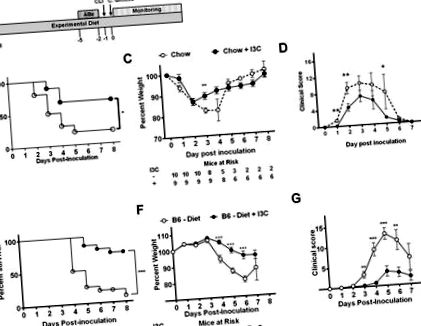
Статистичний аналіз проводили за допомогою програмного забезпечення GraphPad Prism. Для рівномірно розподілених неперервних змінних для порівняння середніх значень використовували точний t-тест Фішера. Для нерівномірно розподілених наборів даних застосовували корекцію Уелча або застосовували U-тест Манна-Уітні. Для аналізу виживання групи порівнювали за допомогою кривих виживання Каплана Мейєра. Значення р складають 5 спор C. difficile (рис. 1А). Миші на дієті з добавкою I3C мали значне збільшення виживання (66,7%) порівняно з контролем (20%; рис. 1В). Добавки I3C призвели до значно меншої втрати ваги на 3-й день після посіву та до зниження показників захворювань у дні 1, 2 та 5 (рис. 1C, D). В обох групах середній клінічний бал був представлений на 3 день після щеплення.
(A) Відсоток виживання, (B) середній відсоток ваги +/− SEM та (C) середній клінічний бал +/− SEM після щеплення 10 5 VPI 10463 C. difficile самців AHR +/− та AHR -/- мишей, яких годували стандартна чау. Дані були об’єднані в результаті двох незалежних експериментів. (D, G) Відсоток виживання, (E, H) середній відсоток ваги +/− SEM та (F, I) середній клінічний показник +/− SEM після інокуляції 10 4 VPI 10463 C. difficile чоловічої AHR +/− ( D - F) або самців мишей AHR -/- (G - I), яких годували напівочищеною дієтою (дієта) або напівочищеною дієтою, доповненою I3C (дієта + I3C), починаючи за два тижні до лікування ABx. Дані були об’єднані в результаті двох незалежних експериментів. Щоденні миші, які перебувають у групі ризику, вказані на панелях B, E, H. Для аналізу виживання використовували log-rank тест, двосторонній t-тест Стьюдента для порівняння щоденних відсотків ваги, а тест Mann-Whitney U для порівняння щоденних клінічних показників оцінка. * Р ≤ 0,05; ** Р ≤ 0,01.
Зміна імунних клітин слизової оболонки у мишей, що харчуються напівочищеною дієтою
(A та B) Відносна експресія Cyp1a1 та FoxP3, виміряна RT-PCR у напівочищених дієтах та мишах I3C порівняно з рівнями β-актину. (В) Репрезентативні ділянки ізольованих клітин сліпої кишки з відсотком батьківської популяції. (D – F) Графіки напівочищеної дієти та мишей I3C у день 0, що демонструють частоту cLP Tregs (Live/CD45 +/CD11b -/Ly6G -/CD3 +/CD4 +/FoxP3 +; D), ILC3 (Live/CD45 +/CD11b -/Ly6G -/CD3 -/CD4 -/RORγt +; E) та кількість IEL γδ Т-клітин (Live/CD45 +/CD11b -/Ly6G -/TCRβ -/CD3 +/TCRγδ +; F ). Усі дані є репрезентативними для n = 4 для кожної групи, з рядками помилок, що відображають SEM, повтореними у 2 незалежних експериментах. * Р ≤ 0,05; ** Р ≤ 0,01. Двохвостий t-тест Стьюдента або U-тест Манна-Уітні, що використовується для порівняння середніх показників.
Ми розглядали можливість того, що різні дієти можуть призвести до розбіжностей у мікробіомі, що може спричинити відмінності у виживаності після CDI. Як видно на додатковому малюнку 1, різниця у втраті різноманітності між напівчищеною дієтою та дієтою з добавкою I3C (до або після антибіотиків) невелика, і, ймовірно, не пояснює різкого поліпшення виживання при добавці I3C.
Дієтичні добавки з використанням I3C посилюють реакцію нейтрофілів, але зменшують запалення
(A) Cecal C. difficile КУО/г калу в раціоні та дієті + миші I3C на 2 та 4 день (n = 4 на групу). Межа виявлення позначається пунктирною лінією. Визначення присутності або відсутності C. difficile cfu для кожного дня визначають за допомогою аналізу хі-квадрата. (B і C) Репрезентативні ділянки потоку та% нейтрофілів cLP на клітини CD45 + на 0-й день (n = 4 на групу) та 3-й день (n = 8 на групу) після щеплення у дієті та дієті + мишей I3C. (D та E) Репрезентативна гістологія у 100x та 400x у напівочищеному раціоні та мишах I3C у день 3 (стрілки зображують нейтрофіли) та відповідні гістопатологічні показники (n = 10 на групу). (F) Відносна експресія IL-22, IL-17 та IFN-γ на 0 та 4 день, виміряна RT-PCR у напівчищеному раціоні та дієті + миші I3C, нормалізовані до β-актину (n = 4-10 на група). (G) Вимірювання загального вмісту білка IL-22 та IL-17A у сліпій кишці методом ІФА.
Додавання I3C до дієти зменшує транслокацію бактерій під час CDI
Кількість бактерій з гомогенатів тканин (А) селезінки, (В) легенів, (С) печінки та (D) нирок на 4-й день після CDI у мишей, яких годували дієтою або дієтою + I3C. (E) Виживання, (F) втрата ваги та (G) клінічні оцінки мишей на напівчищеній дієті, оброблених звичайною питною водою або питною водою з 0,125 мг/мл ципрофлоксацину, починаючи через 1 день після щеплення 10 4 VPI 10463 C. difficile (n = 10 на групу). Усі рядки помилок відображають SEM. * Р ≤ 0,05; ** Р ≤ 0,01; *** Р ≤ 0,001. Тест log-rank, що використовується для аналізу виживання та двосторонній t-тест Стьюдента або U-тест Манна-Уітні, що використовуються для порівняння середніх значень.
ОБГОВОРЕННЯ
У цьому дослідженні ми продемонстрували, що додавання I3C або до стандартної чау-їжі на основі зерна, або до напівчищеної дієти, що не містить фітохіміків, зменшує захворюваність та смертність, пов’язану з CDI, на мишачих моделях. Ця знахідка має важливі клінічні наслідки, оскільки додавання I3C до раціону пацієнтів, призначених для майбутніх процедур, що включають перипроцедурні антибіотики, або для будь-якої групи пацієнтів, яка, як відомо, має підвищений ризик розвитку CDAD, може мати ефективність у зменшенні захворюваності та/або тяжкість CDAD. Більш того, напівчищена дієта може краще представляти популяцію людей, які переживають найгірші показники при CDI, багато з яких недоїдають або НПО (nil per os) перебувають у лікарні. Крім того, існує ймовірність того, що для пацієнтів, які раніше мали ІХС, додавання I3C до їх раціону може зменшити частоту рецидивів. Вплив цих висновків посилюється тим фактом, що I3C - це безпечна дієтична добавка, яка вже пройшла клінічні випробування на людях 28–30, присутня в їжі та може бути додана до раціону пацієнтів із групи ризику без необхідності велике тестування або затвердження.
У наших дослідженнях, що вивчають механізм (-и) опосередкованого I3C контролю CDAD, використовувалася напівочищена дієта, що не містить фітохіміків, з і без I3C. Найбільш разюча різниця у фенотипі мишей на цих дієтах була виявлена в імунних клітинах кишечника. Зокрема, миші, яким було додано I3C, мали в кишечнику більше Tregs, ILC3s та γδ Т-клітин, ніж миші на дієті з дефіцитом ліганду. Збільшення рівня Tregs може обмежити імунну відповідь на C. difficile у місці зараження та зменшити патологію, спричинену хазяїном. Дійсно, в інших моделях коліту Tregs відігравали вирішальну роль у профілактиці захворювань 34, 35. ILC3 відіграють вирішальну роль у стійкості господаря до кишкових патогенів, є важливим джерелом IL-22 у кишечнику та беруть участь у запобіганні CDAD у мишей 12. Нарешті, хоча γδ Т-клітини спеціально не досліджувались у C. difficile, відомо, що вони відіграють вирішальну роль у підтримці кишкового імунітету за рахунок продукування IL-22, IL-17 та інших захисних цитокінів 18, а також їх втрати. клітин призводить до розростання бактерій 15 .
Наші дані підтверджують, що захист від захворюваності/смертності при інфекції C. difficile був вторинним для модуляції імунної відповіді, на відміну від зменшення проліферації та росту C. difficile. Ми розглядали можливість того, що дієтичний дефіцит лігандів AHR призводив до більшої дисбіозу і залишав цих мишей більш сприйнятливими до CDAD внаслідок змін мікробіому. Були певні відмінності у бактеріальному профілі у мишей з добавкою I3C, які можуть зіграти певну роль у захисті від CDAD, що спостерігається у цій моделі. Але загалом миші на обох дієтах мали більше подібностей, ніж відмінностей, і незначні помічені зміни навряд чи можуть повністю пояснити різке поліпшення результату з добавками I3C. Попереднє дослідження виявило, що пероральне додавання кишкового ферменту кишкової лужної фосфатази (IAP) під час лікування антибіотиками захищає мишей від CDAD, можливо, зберігаючи нормальну кишкову флору 36. Оскільки це, схоже, не є механізмом захисту при добавці I3C, може бути цікавим розглянути питання щодо доповнення як IAP, так і I3C для більш надійного захисту в майбутніх дослідженнях.
- Біоактивні нутрицевтики та дієтичні добавки в галузі неврологічних та мозкових хвороб ScienceDirect
- Асоціація між режимами харчування та 10-річним рівнем оцінки ризику серцево-судинних захворювань серед
- Проста дієтична модифікація може допомогти зменшити захворювання печінки у дітей, що страждають ожирінням
- Екстракт виноградних кісточок, дієтичні добавки матері покращують якість яєць і зменшують кількість яєчників
- Сприятливі ефекти дієтичних добавок аргініну при метицилінорезистентному стафілококу