Перетравлена пшенична клейковина пригнічує зв’язок між лептином та його рецептором
Анотація
Передумови
Резистентність до лептину вважається основним фактором ризику ожиріння. Існує гіпотеза, що дієтичний білок зернових злаків може викликати стійкість до лептину, запобігаючи зв’язуванню лептину зі своїм рецептором. Недеградований дієтичний білок пшениці виявлено в сироватці крові людини при середньому рівні 41 нг/мл. Тут ми повідомляємо результати випробувань, чи перешкоджає ферментативно засвоєна клейковина пшениці лептину зв’язуватися з рецептором лептину в пробірці.
Клейковина з пшениці перетравлювалася пепсином та трипсином у фізіологічних умовах. Активність пепсину та трипсину видаляли з клейковинного дайджесту спін-фільтром 10 кДа або термічною обробкою при 100 ° C протягом 30 хв. Зв'язування з рецептором лептину лептину, змішаного з переваркою глютену, у ряді концентрацій вимірювали за допомогою технології поверхневого плазмонного резонансу.
Результати
Зв'язування дайджесту клейковини з рецептором лептину не виявлено. Спін-фільтрований дайджест глютену пригнічує зв'язування лептину з рецептором лептину, із 50% інгібуванням при концентрації дайджест-глютену
10 нг/мл. Термічно оброблений дайджест клейковини не пригнічував зв’язування лептину.
Висновки
Перетравлена пшенична клейковина інгібує зв’язування лептину з рецептором лептину, з напівмаксимальним інгібуванням при 10 нг/мл. Інгібування є значним при клінічно значущих концентраціях і, отже, може служити новим шляхом для дослідження, щоб зрозуміти молекулярні основи стійкості до лептину, ожиріння та супутніх розладів.
Передумови
Лептин - це поліпептид 16 кДа, що виділяється білою жировою тканиною в кровообіг, як нещодавно переглянув Чжоу та ін. [1]. Рівні лептину в циркуляції пропорційні масі жиру в організмі і коливаються відповідно до змін харчових станів. Концентрація лептину служить ключовим сигналом ожиріння для мозку, де лептин зв'язується і активує рецептор лептину. Лептин важливий у регулюванні ситості, ваги та енергетичного гомеостазу. Більшість пацієнтів із ожирінням мають високий рівень циркулюючого лептину, що свідчить про набутий стан стійкості до лептину, що визначається зниженою здатністю лептину пригнічувати апетит та збільшення ваги [2]. Резистентність до лептину вважається основним фактором ризику патогенезу надмірної ваги та ожиріння [2], що, в свою чергу, тісно пов'язане з різними порушеннями обміну речовин, включаючи дисліпідемію, серцево-судинні захворювання, інсульт, інсулінорезистентність та діабет 2 типу. Для пояснення стійкості до лептину було запропоновано кілька механізмів, включаючи порушення транспорту лептину, сигналізацію лептину та нейронні схеми, спрямовані на лептин [2].
У цьому дослідженні ми перевірили останню пропозицію згаданої гіпотези, яка полягає в тому, що білки зерна злаків пригнічують зв’язування лептину. Вже повідомлялося, що білки зернових злаків зв’язуються з рецептором Ламмерсом та ін., який виявив, що зернові пептиди зернових, отримані в результаті ферментативного перетравлення гліадину пшениці з кишковими ферментами пепсином та трипсином, у фізіологічних умовах зв'язуються з рецептором хемокінів CXCR3, що експресується в епітелії кишок мишей та людини, що призводить до вивільнення зонуліну та збільшення проникності кишечника [11 ]. Камікубо та ін. повідомляли, що агглютинін зародків пшениці зв'язується з рецептором лептину в пробірці та інгібує зв'язування лептину з рецептором лептину [12]. Аглютинін зародків пшениці міститься в борошні звичайного пшеничного, але не в крові людини [13]. Ми вирішили дослідити зерновий білок зерна пшениці, який є основним джерелом рослинного білка в їжі людини. Основним білковим компонентом пшениці є клейковина, яка є згуртованою та еластичною масою, що залишається після видалення крохмалю з борошна зернових злаків промиванням водою. Більш конкретно, пшенична клейковина - це композиція з декількох видів білків, таких як гліадини (молекулярна маса
30 кДа) та глютеніни (молекулярна маса
30-90 кДа). Споживання глютену значно зросло за останні сто років і пришвидшилось протягом останніх кількох десятиліть [14,15]. Це збільшення значною мірою зумовлене розведенням багатих на глютен сортів зернових культур, а останнім часом - використанням додаткової клейковини у випічці та переробці харчових продуктів, щоб зробити тісто простішим у роботі, а хліб пухким [15]. Соарес та ін. встановили, що безглютенова дієта знижує лептин, ожиріння, запалення та резистентність до інсуліну у мишей, незважаючи на подібне споживання енергії [16]. Чірдо та ін. повідомляли про наявність нерозкладеного гліадину пшениці в сироватці крові людини (при середньому рівні 41 нг/мл) [17], як раніше повідомляв також про інші дієтичні білки Хусбі та ін. [18,19].
Тут ми використовували технологію поверхневого плазмонного резонансу (SPR) для моніторингу взаємодії між лептином і рецептором лептину та його інгібування ферментативно перетравленою клейковиною з пшениці.
Методи
Перетравлення клейковини
Щоб імітувати фізіологічні умови в кишечнику людини, глютен з пшениці перетравлювався згідно протоколу Де Рітіса та ін. [20] з невеликими змінами. 100 г клейковини з пшениці (Sigma-Aldrich: G5004) перетравлювали в 1 л 0,2 н. HCl (pH 1,8), що містить 2 г пепсину (Sigma-Aldrich: P6887), при 37 ° C протягом 2 годин. РН періодично перевіряли і за необхідності доводили до 1,8 за допомогою HC1 або NaOH. Потім рН доводять до 8,0 за допомогою 2 N NaOH. Перетравлена пепсином клейковина додатково перетравлюється додаванням 2 г трипсину (Sigma-Aldrich: T4799). Отриману перетравлену пепсином та трипсином клейковину енергійно перемішували при 37 ° С протягом 4 годин. РН періодично перевіряли і за необхідності доводили до рН 8,0 за допомогою HC1 або NaOH.
Видалення пепсину та трипсину
Пепсин (молекулярна маса
40 кДа) і трипсину (молекулярна маса
25 кДа) видаляли з дайджесту клейковини або спіновим фільтруванням через фільтр 10 кДа, або термообробкою при 100 ° С протягом 30 хв з наступним центрифугуванням при 13000 г протягом 10 хв. Концентрацію перетравленого глютену після фільтрування або центрифугування визначали з поглинання при 280 нм, припускаючи поглинання 1 при 1 мг/мл. Щоб перевірити, чи залишається якась активність пепсину або трипсину, 1,8 мкг/мл лептину (рекомбінантний людський лептин, R&D Systems) інкубували в клейковинному дайджесті (лише спін-фільтрованим або спін-фільтрованим та термічно обробленим) протягом 1 год або 24 год на 37 ° С Зразки розчиняли за допомогою SDS PAGE (Invitrogen) і промокали за допомогою iBlot® Gel Transfer Stacks, PVDF, міні-набору (Invitrogen) відповідно до інструкцій виробника. Після промивання помарки інкубували з кон'югованим антилептином HRP антитілом (HyTest Ltd, кат. №2LE1C) при 4 ° C протягом ночі. Антитіло використовували у розведенні 1: 1000 щодо концентрації запасу в продукті (HyTest Ltd, кат. №2LE1C). Імунореактивні смуги були виявлені за допомогою реагентів ECL (GE Healthcare Life Sciences).
Дослідження SPR
Дані фази дисоціації встановлювались за допомогою одного експоненціального спаду:
Потім значення, отримане для k off, використовувалось під час підгонки даних фази асоціації, щоб отримати оцінку k on з наступним рівнянням:
Дані інгібування аналізували, знаходячи значення плато в кінці кожної ін’єкції окремого лептину або дайджесту лептину та глютену.
Результати
Видалення пепсину та трипсину
Вестерн-блоттінг показав залишки лептину для всіх перетравлених глютену як через 1, так і через 24 години. Це показує, що спін-фільтрація та термічна обробка усували всю активність протеази в клейковинному травленні, оскільки лептин в іншому випадку погіршився б.
Дослідження SPR
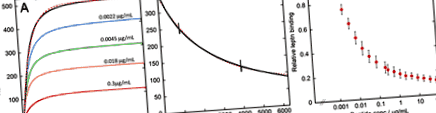
SPR-аналіз зв’язування лептину з рецептором лептину та його інгібування дайджестом клейковини. А) Приклади сенсорних діаграм, записаних під час ін’єкції 30 нМ лептину окремо (чорний) або в присутності 0,0022 (синій), 0,0045 (зелений), 0,018 (помаранчевий) або 0,3 (червоний) мкг/мл дайджесту клейковини через сенсорний чіп з іммобілізованим рецептор лептину-Fc химера. Рожева пунктирна лінія відповідає чорній лінії за допомогою рівняння 2 (див. Методи). Б) Приклад сенсограми, записаної під час буферного потоку після повного введення 30 нМ лептину (чорний). Рожева пунктирна лінія відповідає даним, використовуючи рівняння 1 (див. Методи). Дві вертикальні лінії виникають під час тривалої дисоціації часу, коли машина перемикається між двома насосами. В) Ділянка відносної інтенсивності на кінцевому плато зв’язування лептину під час ін’єкції 30 нМ лептину проти концентрації перетравлення глютену. Смужки похибки представляють стандартне відхилення трьох вимірювань.
Обговорення
Ключові висновки
Перетравлена пшенична клейковина пригнічує зв’язування лептину з рецептором лептину.
Можливі механізми
Не було виявлено зв’язування перетравлення глютену з рецептором лептину. Це може свідчити про те, що засвоєна клейковина була занадто малою для виявлення, коли вона зв’язана з рецептором лептину, або що засвоєна клейковина замість цього пов’язана з лептином. Незалежно від того, перетравлення клейковини може інгібувати зв’язування лептину безпосередньо, перешкоджаючи сайту зв’язування лептину або рецептора лептину, або опосередковано, викликаючи конформаційні зміни лептину або рецептора лептину, що порушує їх здатність зв’язувати один одного.
Порівняння з результатами інших досліджень
Ламмерс та ін. показали, що перетравлення глютену спричиняє витіснення залежного від концентрації ліганду рецептора CXCR3, із 50% витісненням ліганду з концентрацією перетравлення глютену 1 мг/мл [11]. Значно нижча концентрація перетравлення глютену 10 нг/мл, необхідна в нашому дослідженні для половинного максимального пригнічення зв’язування лептину, могла бути пов’язана з різницею чутливості відповідної моделі зв’язування досліджень. Це також може бути наслідком різниці концентрацій та/або активності між інгібуючими речовинами у відповідних дайджестах глютену.
Обмеження цього дослідження
Це в пробірці дослідження і необхідно провести більше досліджень, щоб з'ясувати можливу клінічну значимість наших спостережень. Крім того, у дослідженні вивчали ефекти клейковини пшениці, залишаючи таким чином інші білки пшениці та всі інші білки зернових злаків для подальших досліджень. Крім того, протеазну активність видаляли з клейковинного травлення шляхом спінової фільтрації через фільтр 10 кДа. Це призведе до видалення більших, можливо, активних речовин з клейковинного травлення. Такі речовини можуть бути досліджені в майбутніх дослідженнях.
Дослідження та клінічні наслідки
Концентрації, при яких перетравлена глютен пшениці пригнічує лептин у нашому дослідженні, знаходяться в тому ж діапазоні, що і концентрації гліадину та інших дієтичних білків у сироватці крові людини [17-19], що робить білки зернових злаків клінічно значущими як можливу причину лептину резистентність та ожиріння. Отримані нами результати вимагають подальших досліджень не лише щодо впливу білків із пшениці та інших зерен злаків на сигнали лептину, але й щодо впливу інших харчових білків на інші рецептори, структури та функції в організмі.
Щоб оцінити клінічні наслідки результатів дослідження, слід розглянути попередні висновки щодо взаємозв'язку між лептином у сироватці крові та масою жиру в організмі людини, що було виявлено сильною лінійною або квадратичною кореляцією (R = 0,86, P 2 та здоровішим
21 кг/м 2. Відповідне поліпшення ІМТ, ймовірно, також зменшило б пов’язані з ожирінням метаболічні розлади, такі як дисліпідемія, серцево-судинні захворювання, інсульт, інсулінорезистентність та діабет 2 типу серед населення.
Висновки
Перетравлена пшенична клейковина інгібує зв’язування лептину з рецептором лептину, з напівмаксимальним інгібуванням при 10 нг/мл. Інгібування є значним при клінічно значущих концентраціях і, отже, може слугувати новим шляхом для дослідження, щоб зрозуміти молекулярні основи стійкості до лептину, ожиріння та супутніх розладів.
Список літератури
Zhou Y, Rui L. Сигналізація лептину та стійкість до лептину. Передній мед. 2013; 7 (2): 207–22.
Pan H, Guo J, Su Z. Досягнення у розумінні взаємозв'язку між стійкістю до лептину та ожирінням. Фізіол Бехав. 2014; 130: 157–69.
Jonsson T, Olsson S, Ahren B, Bog-Hansen TC, Dole A, Lindeberg S. Аграрна дієта та хвороби достатку - чи викликають еволюційні нові дієтичні лектини стійкість до лептину? BMC Endocr Disord. 2005; 5 (1): 10.
Segurel L, Austerlitz F, Toupance B, Gautier M, Kelley JL, Pasquet P, et al. Позитивний вибір захисних варіантів для діабету 2 типу, починаючи з епохи неоліту: тематичне дослідження в Центральній Азії. Eur J Hum Genet. 2013; 21 (10): 1146–51.
Васселлі JR, Scarpace PJ, Harris RB, Banks WA. Дієтичні компоненти у розвитку стійкості до лептину. Adv Nutr. 2013; 4 (2): 164–75.
Dall M, Calloe K, Haupt-Jorgensen M, Larsen J, Schmitt N, Josefsen K, et al. Фрагменти гліадину та специфічний гліадиновий 33-мерний пептид закривають канали KATP та індукують секрецію інсуліну в клітинах INS-1E та островах Лангерганса на щурах. PLoS Один. 2013; 8 (6): e66474.
Lam NT, Cheung AT, Riedel MJ, Light PE, Cheeseman CI, Kieffer TJ. Лептин зменшує транспорт глюкози та рівень клітинного АТФ у бета-клітинах INS-1. J Mol Ендокринол. 2004; 32 (2): 415–24.
El-Shebini SM, Ghattas LA, Mohamed HI, Moaty MI, Tapozada ST, Hanna LM. Циркулюючі концентрації лептину, розчинного рецептора лептину та індексу вільного лептину у жінок, які страждають ожирінням, до і після дієтотерапії. J Med Sci. 2009; 9 (5): 219–26.
Ryberg M, Sandberg S, Mellberg C, Stegle O, Lindahl B, Larsson C, et al. Дієта палеолітичного типу спричиняє сильний специфічний для тканин вплив на ектопічне відкладення жиру у жінок із ожирінням у постменопаузі. J Intern Med. 2013; 274 (1): 67–76.
Jonsson T, Granfeldt Y, Erlanson-Albertsson C, Ahren B, Lindeberg S. Палеолітична дієта є більш ситною на калорію, ніж середземноморська дієта у осіб з ішемічною хворобою серця. Nutr Metab (Лонд). 2010; 7: 85.
Lammers KM, Lu R, Brownley J, Lu B, Gerard C, Thomas K, et al. Гліадин індукує збільшення проникності кишечника та вивільнення зонуліну шляхом зв’язування з рецептором хемокінів CXCR3. Гастроентерологія. 2008; 135 (1): 194–204 e3.
Камікубо Y, Dellas C, Loskutoff DJ, Quigley JP, Ruggeri ZM. Внесок N-зв'язаних гліканів рецептора лептину у зв'язування лептину. Biochem J. 2008; 410 (3): 595–604.
Кузьма Й.Н. Прийом всередину зародків пшениці у здорових осіб не різко підвищує концентрацію агглютиніну в зародках пшениці в плазмі. Університет штату Колорадо: Цифрові колекції бібліотек. 2009 рік.
Белдерок Б. Розвиток процесів виготовлення хліба. Рослинна їжа Hum Nutr. 2000; 55 (1): 1–86.
День L, Августин М.А., Баті Іллінойс, Wrigley CW. Використання пшеничної клейковини та потреби промисловості. Тенденції Food Sci Technol. 2006; 17 (2): 82–90.
Soares FL, de Oliveira Matoso R, Teixeira LG, Menezes Z, Pereira SS, Alves AC, et al. Безглютенова дієта зменшує ожиріння, запалення та резистентність до інсуліну, пов’язані з індукцією експресії PPAR-альфа та PPAR-гамма. J Nutr Biochem. 2013; 24 (6): 1105–11.
Chirdo FG, Rumbo M, Anon MC, Fossati CA. Наявність високого рівня неруйнованого гліадину в грудному молоці у здорових матерів. Scand J Gastroenterol. 1998; 33 (11): 1186–92.
Husby S, Jensenius JC, Svehag SE. Проникнення нерозкладеного дієтичного антигену в кров здорових дорослих. Кількісна оцінка, оцінка розподілу за розміром та відношення поглинання до рівнів специфічних антитіл. Scand J Immunol. 1985; 22 (1): 83–92.
Husby S, Jensenius JC, Svehag SE. Проникнення нерозкладеного дієтичного антигену в кров здорових дорослих. Подальша характеристика кінетики поглинання та розподілу розміру антигену. Scand J Immunol. 1986; 24 (4): 447–55.
De Ritis G, Occorsio P, Auricchio S, Gramenzi F, Morisi G, Silano V. Токсичність білків пшеничного борошна та пептидів, отриманих з білка, для розвитку in vitro кишечника із плоду щура. Педіатр Res. 1979; 13 (11): 1255–61.
Містрік П, Моро Ф, Аллен Дж. BiaCore-аналіз взаємодії рецепторів лептину-лептину: докази стехіометрії 1: 1. Анальний біохім. 2004; 327 (2): 271–7.
Maffei M, Halaas J, Ravussin E, Pratley RE, Lee GH, Zhang Y, et al. Рівні лептину у людини та гризунів: вимірювання лептину та ob РНК плазми крові у пацієнтів із ожирінням та вагою із зниженою вагою. Nat Med. 1995; 1 (11): 1155–61.
Considine RV, Sinha MK, Heiman ML, Kriauciunas A, Stephens TW, Nyce MR, et al. Концентрація імунореактивного лептину в сироватці крові у людей із нормальною вагою та ожирінням. N Engl J Med. 1996; 334 (5): 292–5.
Каро Дж. Ф., Колачинський Й. В., Найс М. Р., Оганнесіан Дж. П., Опентанова І, Голдман В. Х. та ін. Зниження співвідношення спинномозкової рідини/сироватки лептину при ожирінні: можливий механізм стійкості до лептину. Ланцет. 1996; 348 (9021): 159–61.
Подяки
Автори вдячні Анні Геделій за технічну допомогу, а також доктору Де Вінченці та доктору Сілано з Istituto Superiore di Sanità у Римі, Італія, за те, що вони люб'язно надіслали нам свій дайджест пшениці для початкових експериментів. Дослідження фінансувалося Фондами та фондами університетської лікарні Сконе (SUS stiftelser och donationer) і Доктор P Håkanssons stiftelse.
Інформація про автора
Приналежності
Центр досліджень первинної медико-санітарної допомоги, Лундський університет/регіон Сконе, Університетська лікарня Сконе, Мальме, Швеція
Томмі Йонссон, Ashfaque A Memon, Крістіна Сандквіст та Ян Сундквіст
Департамент рослинництва та екології, Університет Копенгагена, DK-1871, Frederiksberg C, Данія
Інститут біомедичних наук факультету охорони здоров'я та медичних наук Університету Копенгагена, DK-2200, Копенгаген, Данія
Датська академія діабету, Університетська лікарня Оденсе, Оденсе, Данія
Кафедра біохімії та структурної біології Лундського університету, Лунд, Швеція
Мікаель Бауер і Сара Лінз
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Відповідний автор
Додаткова інформація
Конкуруючі інтереси
Автори заявляють, що у них немає конкуруючих інтересів.
Внески авторів
TJ задумав дослідження, взяв участь у його розробці та написав статтю. AM, KS, JS, SO, AN, MB і SL брали участь у розробці та виконанні дослідження та розробці статті, а також переглянули її для важливого інтелектуального змісту. Усі автори прочитали та схвалили остаточний рукопис.
- Дієтичне обмеження метіоніну плюс темозоломід при повторних ГБМ - Повний текст
- Характеристика синдрому Прадера-Віллі та раннього патологічного ожиріння - Повний текст
- Повний текст Однорічне дослідження, що оцінює ефективність дієти з обмеженим вмістом йоду при ВМРР
- Вплив Віктози на дієтичні уподобання та звички у пацієнтів з діабетом 2 типу - Повний текст
- Вплив жиру та вуглеводів на чоловіків із ожирінням - Повний текст