p53, Окислювальний стрес та старіння
Анотація
p53 є критичним супресором пухлини
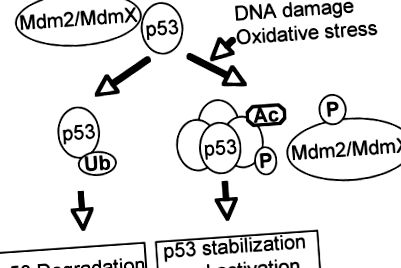
Критичний супресор пухлини р 53 відіграє важливу роль у зупинці клітинного циклу, апоптозі, старінні або диференціації у відповідь на різні генотоксичні та клітинні стреси, включаючи окислювальний стрес (73, 102, 133). Як охоронець геному, інактивація функції p53 дикого типу шляхом прямої генної мутації або порушення шляхів, важливих для активації p53, є необхідною умовою розвитку більшості ракових захворювань людини (35, 92, 127). Як фактор транскрипції p53 складається з двох N-кінцевих доменів трансактивації, основного ДНК-зв'язуючого домену та С-кінцевого домену олігомеризації (55, 92). Через свою потужну активність в індукуванні апоптозу та старіння стабільність і активність p53 жорстко регулюються посттрансляційними механізмами (47, 51, 129). За відсутності напружень р53 неактивний і нестабільний через взаємодію з Mdm2 та MdmX, які інактивують р53 та убиквінінат р53 для протеасомнозалежної деградації (рис. 1). У відповідь на стреси р53 модифікується посттрансляційно шляхом фосфорилювання, ацетилювання, метилювання та сумоилирования в різних місцях, порушуючи взаємодію між p53 та його негативними регуляторами, що призводить до активації та стабілізації p53 (68, 85, 104).
Активація p53 у відповідь на пошкодження ДНК та окислювальні стреси. За відсутності напружень негативні регулятори p53, такі як Mdm2/MdmX, пригнічують активність p53 і викликають його деградацію. У відповідь на пошкодження ДНК та окислювальний стрес p53 та його негативні регулятори посттрансляційно модифікуються, приводячи до активації p53, порушуючи взаємодію між p53 та його негативними регуляторами.
Як фактор транскрипції, p53 може безпосередньо регулювати експресію сотень генів, продукти яких опосередковують різні р53-залежні функції (рис. 2) (43, 53, 69). Наприклад, p21 та 14-3-3σ відповідають за p53-залежну зупинку клітинного циклу (30, 31, 50); p53 може також індукувати диференціацію клітин ембріональних стовбурових (ES) клітин шляхом придушення експресії Nanog, яка необхідна для самовідновлення клітин ES (64). У відповідь на високий рівень пошкодження ДНК р53 індукує апоптоз та старіння шляхом регуляції апоптотичних генів, таких як Noxa та Puma (66, 71). Ці функції р53 запобігають проходженню пошкодження ДНК до дочірніх клітин і, таким чином, підтримують геномну стабільність. У відповідь на окислювальний стрес р53 активує транскрипцію ряду генів, що беруть участь у регуляції окисного стресу, таких як Сестрін, глутатіонпероксидаза (GPX), альдегіддегідрогеназа (ALDH) та індукований ядерним білком 1 (TP53INP1) пухлинний білок (TP53) 14, 16, 115, 130). p53 також може регулювати рівень клітинного окисного стресу, модулюючи гліколіз шляхом індукції експресії TIGAR (індукований TP53 регулятор гліколізу та апоптозу) та придушення експресії фосфогліцерат-мутази (PGM) (9, 58).
Гени-мішені p53 є медіаторами різних p53-залежних функцій у відповідь на пошкодження ДНК та окислювальні стреси.
p53 та Старіння
Недавні дослідження функціонально пов’язували p53 зі старінням у різних організмах (рис. 3). Ортолог p53 у Caenorhabditis elegans, Cep-1, бере участь у негативному регулюванні тривалості життя хробака, оскільки зменшена експресія Cep-1 призводить до збільшення тривалості життя (4). Експресія домінантно-негативних версій Drosophila melanogaster p53 (Dmp53) у дорослих нейронах продовжує тривалість життя та збільшує генотоксичну стійкість до стресу на льоту (8). Оскільки експресія домінантно-негативного Dmp53 додатково не збільшує тривалість життя мух з обмеженим вмістом калорій, ці результати свідчать про те, що p53 бере участь у опосередкуванні обмеженого вмісту калорій у мух. Однак дослідження мутагенезу на C. elegans показують, що певні мутації, що продовжують тривалість життя, збільшують активність р53 та стійкість до раку (94). Отже, підвищена активність p53 пов’язана як з прискореним старінням, так і зі збільшенням тривалості життя C. elegans.
Короткий зміст модуляції впливу p53 на тривалість життя різних організмів.
Подібний складний сценарій спостерігається також при вивченні ролі р53 у старінні ссавців. Одна модель миші, в якій N-кінець p53 усічений, демонструє підвищену активність p53 та прискорене старіння (119). Однак через велику делецію геномної ДНК перед р53, яка містить 24 гени (40), залишається незрозумілим, чи відповідає якийсь із цих видалених генів за ці старіння фенотипів. Потенційна участь N-кінця усіченого p53 у старінні додатково підтверджується надмірною експресією видаленої N-кінцем ізоформи p53 p44 у мишей, що призводить до прискореного старіння (72). Це дослідження припускає, що p44 модулює тривалість життя, інгібуючи шляхи передачі сигналів PTEN та IGF (39, 75, 110). Щоб зв’язати p53 зі старінням у людей, недавнє дослідження показує, що поліморфізм p53 при кодоні 72 (заміна аргініну на пролін) зменшує активність p53, що корелює із збільшенням тривалості життя, але також з вищим ризиком раку у людей старшого віку (120). Тому існує припущення, що p53 може придушити рак ціною довголіття.
Думка про те, що підвищена активність p53 викликає старіння у мишей, оскаржується нещодавніми дослідженнями моделей мишей з підвищеною активністю p53. Наприклад, миші з гіпоморфною мутацією в Mdm2 демонструють підвищену активність p53, але нормальний термін життя (78). Крім того, миші з додатковою копією p53 та ARF виявляють посилену експресію антиоксидантної активності та зниження рівня ендогенних окисних стресів, що корелює із збільшенням тривалості життя (74). Отже, підвищена антиоксидантна активність p53 у цих трансгенних мишей запобігає накопиченню окисних стресів до високих рівнів, необхідних для індукції р53-залежного апоптозу та старіння, тим самим затримуючи старіння цих мишей. Підсумовуючи, функції p53 при старінні є складними і можуть залежати від контексту. У цьому контексті м’яка і тимчасова активація р53 у відповідь на низькі дози окисного стресу може захистити клітини від окисного пошкодження. Навпаки, стійка активація р53 у відповідь на високий рівень окисного стресу може призвести до загибелі клітин та старіння організму. На подальшу підтримку цього поняття, стійка активація p53 виснажує дорослі стовбурові клітини переважно через p53-залежний апоптоз (64).
Окислювальний стрес та старіння
Гіпотеза про вільні радикали залишається найбільш усталеною теорією механізму старіння (46). Вважається, що збільшене вироблення АФК та знижена антиоксидантна здатність сприяють процесу старіння шляхом окисної модифікації різних макромолекул, таких як ліпіди, білки та геномна ДНК (12, 20, 25, 62, 63, 65, 96, 109, 117). У контексті ДНК у старих щурів та мишей окисне пошкодження мітохондріальної та ядерної ДНК значно збільшується в різних тканинах (20, 45, 61, 67, 76, 82, 116). Рівні продуктів перекисного окислення ліпідів також збільшуються зі старінням (44, 83, 87, 97, 108, 113, 119, 123). Крім того, пов'язана зі старінням окисна модифікація різних білків викликає зміни в структурі білка, активності ферментів, транскрипційній активності та шляхах передачі сигналів (32, 70, 103, 111, 112, 124), що призводить до вікових захворювань. Підводячи підсумок, рівні окисної шкоди підвищуються під час старіння в різних організмах, включаючи C. elegans (11, 52, 121), мух (3, 64) та мишей (22, 74, 79).
На подальшу підтримку думки, що окислювальний стрес є індуктором старіння, лікування антиоксидантами може збільшити тривалість життя різних організмів і благотворно впливає на захворювання, пов'язані зі старінням (6, 29, 38, 57, 114, 119). Низька доза дієтичної добавки з антиоксидантами частково імітує ефекти обмеження калорій та затримує старіння у мишей (6), а тривале лікування вільнорадикальними очищувачами Schisandrin B, похідним дибензоциклооктадієну, виділеним із плодів Schisandra chinensis, затримує старіння пов'язане з цим функціональне порушення в різних органах та покращує рівень виживання старіючих мишей (114). Дієтична добавка цистеїну, необхідна для синтезу первинного антиоксиданту глутатіону, має очевидні переваги у затримці деяких аспектів старіння (29). Однак клінічні випробування також не виявили значних корисних ефектів від добавок з антиоксидантом вітаміном Е, що вказує на те, що не всі антиоксиданти мають антистаріючу активність (55, 107, 125).
p53 та окислювальний стрес
Рівні АФК мають значний вплив на ріст клітин, їх виживання та розвиток, а також на туморогенез (17). p53 відіграє ключову та складну роль у клітинних реакціях на окислювальні стреси (84, 100). У відповідь на низький рівень окисного стресу р53 відіграє насамперед антиоксидантну роль. У цьому контексті ряд генів-мішеней р53, включаючи сестрин, глутатіонпероксидазу (GPX) та альдегіддегідрогеназу (ALDH), бере участь у зменшенні окисних стресів (рис. 4). Наприклад, Сестрін захищає клітини від пошкодження, спричиненого перекисом водню, утворенням пероксиредоксинів (14). GPX - це основний антиоксидантний фермент, який знешкоджує пероксид водню або органічні гідропероксиди (115). Альдегіддегідрогеназа (ALDH) також сприяє антиоксидантній функції p53 (130).
Контекстнозалежна роль p53 у клітинних реакціях на окислювальний стрес шляхом включення різних генів-мішеней. При базальному або низькому рівні окисного стресу р53 регулює експресію Sestrin, GPX, ALDH, TP53INP1, SOD2, TIGAR та PGM для усунення АФК, а отже, сприяє виживанню клітин. У відповідь на високий рівень окисного стресу р53 індукує експресію прооксидантних генів і пригнічує експресію генів антиоксидантів для підвищення рівня АФК та сприяння апоптозу. Незбалансовані антиоксиданти можуть також стимулювати АФК сприяти загибелі клітин.
p53 також може знижувати внутрішньоклітинний рівень АФК, регулюючи клітинний метаболізм. У цьому контексті p53 індукує експресію TIGAR (індукований TP53 регулятор гліколізу та апоптозу), що уповільнює гліколіз та сприяє виробленню NAPDH для зниження рівня АФК (9). Крім того, p53 пригнічує експресію фосфогліцерат-мутази (PGM), що призводить до зменшення пірувату, необхідного для окисного дихання в мітохондріях, і, таким чином, зменшує продукцію АФК (10, 74).
У відповідь на високий рівень окисного стресу p53 проявляє прооксидантну активність, включаючи прооксидантні гени, такі як PIG3 та пролін-оксидаза (27, 95). Надмірна експресія цих генів призводить до більш високого рівня окисного стресу. Крім того, p53 індукує експресію BAX та PUMA, які індукують апоптоз шляхом вивільнення цитохрому c з мітохондрій (66, 71). Прооксидантна активність p53 також включає пригнічення експресії антиоксидантних генів, що призводить до посилення клітинних окисних стресів для індукції апоптозу. Наприклад, p53 може придушити експресію SOD2 та Nrf2, що призводить до чутливості до окисного стресу або індукує апоптоз (28, 34, 91). Цікаво, що індукована р53 регуляція MnSOD та GPX, але не каталази, збільшує окислювальний стрес та апоптоз (54), припускаючи, що баланс антиоксидантного ферменту та окисного стресу є важливим для виживання клітин. Підсумовуючи, p53 відіграє важливу, але залежну від контексту роль у регулюванні клітинних окисних стресів, а рівні пошкодження окислювального стресу визначають, чи буде поведінка p53 поведінкою протектора чи вбивці (100).
p53 Взаємодіє з іншими шляхами, пов’язаними з окислювальним стресом та старінням
На додаток до прямої регуляції генів, які беруть участь в окислювальних стресах, p53 також взаємодіє з іншими шляхами, які беруть участь у старінні та окислювальних стресах, які узагальнено тут (рис. 5).
Функціональна взаємодія між p53 та іншими шляхами, важливими для реакції на окислювальний стрес та старіння.
Sirt1
p66Shc
p66Shc, вихідний мішень p53, є необхідним для р53-залежного підвищення внутрішньоклітинних окисних стресів та апоптозу (118). p66Shc - це сплайсинговий варіант p52Shc/p46Shc, цитоплазматичного перетворювача сигналу, який бере участь у передачі мітогенного сигналу від активованих рецепторів до Ras (93). Однак p66Shc не бере участі в регуляції сигналу Ras, а замість цього бере участь в індукуванні апоптозу у відповідь на окислювальні стреси (80). Важлива роль p66Shc в окислювальних стресах та старінні вказується на висновки, що абляція p66Shc підвищує клітинну стійкість до апоптозу, викликаного окислювальними стресами, і продовжує термін життя мишей з дефіцитом p66Shc (79). У цьому контексті вивільнення цитохрому с після окисних сигналів погіршується в клітинах з дефіцитом p66Shc (90). Отже, p66Shc функціонально пов'язує p53 з реакцією на окислювальний стрес та старінням.
Фактори транскрипції Forkhead box O (FoxO) є важливими медіаторами сигнального шляху PI3K/Akt та регулюють клітинну реакцію на окислювальні стреси та тривалість життя (56, 105). p53 негативно регулює діяльність FoxO, індукуючи експресію індукованої сироваткою та глюкокортикоїдами кінази (SGK), негативного регулятора FoxO та PTEN (37). Крім того, Sirt1 може деацетилювати FoxO3 та FoxO4, тим самим послаблюючи індукований FoxO апоптоз та зупинку клітинного циклу (41). Отже, баланс функціональної взаємодії між Sirt1, FoxO та p53 може відігравати важливу роль у регуляції окисних стресів та старіння.
APE/Ref1
Експресія APE/Ref1 знижується у старечих мезенхімальних стовбурових клітинах, отриманих з кісткового мозку людини (hBMSC), із підвищеним рівнем ендогенних АФК. Надмірна експресія APE1/Ref-1 пригнічує вироблення супероксиду та зменшує старіння в hBMSC (48). Крім того, у старіючих мишей порушується індукція АПЕ у відповідь на окислювальні пошкодження (15). Діяльність APE/Ref1 негативно регулюється p53 (131), вказуючи на інший шлях p53 для модуляції окисних стресів та старіння.
Кавеолін-1
Експресія кавеоліну-1 індукується у фібробластах, які зазнають старіння, спричиненого окислювальним стресом, і антиоксидант запобігає старінню та підвищенню регуляції кавеоліну-1 (36, 126). Надмірна експресія кавеоліну-1 в MEF індукує передчасне старіння через залежний від p53-p21 шлях, припускаючи, що Caveolin-1 може активувати p53-залежне передчасне старіння після окисних стресів (36). У цьому контексті кавеолін-1 зв'язується з Mdm2 і порушує зв'язування Mdm2 з p53, що призводить до активації p53 у відповідь на окислювальні стреси. Активація p53 та індукція передчасного старіння порушуються в MEF Caveolin-1 – null, підтверджуючи, що Caveolin-1 є вищим активатором p53 у відповідь на окислювальні стреси (7).
Шлях FoxM1C-Bmi1
Bmi1 є негативним регулятором Ink4a/Arf та p53; FoxM1C індукує експресію Bmi1 для запобігання клітинному старінню, спричиненому окислювальним стресом, інгібуючи експресію р53 (13, 18, 33, 89). Bmi1 важливий для придушення прооксидантної активності р53 у нейронах та для придушення індукованого окислювальним стресом апоптозу та передчасних старіючих фенотипів (18). Крім того, цілеспрямоване виснаження Bmi1 сенсибілізує пухлинні клітини до опосередкованого р53 апоптозу у відповідь на променеву терапію (2).
Бах1
Що стосується факторів транскрипції, то набір ко-активаторів або ко-репресорів до цільових промоторів p53 є критичним для p53-залежної транскрипції. Bach1 індукується окислювальними стресами і утворює комплекс з p53, гістоновою деацетилазою 1 та ядерним ко-репресором N-coR, сприяючи деацетилюванню гістону та придушенню певних цільових генів p53 (26). У цьому контексті Bach1 інгібує клітинне старіння, спричинене окислювальним стресом, порушуючи р53-залежну експресію гена (26).
Висновок
Накопичення окисного стресу та окисних пошкоджень є головним індуктором старіння. Багато шляхів, що беруть участь у реакції клітин на окислювальний стрес, регулюють процес старіння та тривалість життя різних організмів. p53 відіграє важливу, але залежну від контексту роль у клітинних реакціях на низький або високий рівень окисного стресу. У відповідь на низький рівень окисного стресу р53 проявляє антиоксидантну активність та сприяє виживанню клітин; у відповідь на високий рівень окисного стресу р53 проявляє прооксидантну активність для індукування клітинного апоптозу. Обидві функції p53 можуть запобігати накопиченню окисного пошкодження в клітинах і таким чином підтримувати геномну стабільність. p53 виконує ці функції шляхом прямої транскрипційної регуляції генів, що беруть участь у реакціях на окислювальний стрес, або модулюючи інші шляхи, важливі для реакцій на окислювальний стрес.
- Добавки PRIME PubMed Coenzyme Q10 знижують окислювальний стрес та запалення печінки
- Ожиріння, спричинене пошкодженням нирок, пов'язане з окислювальним стресом через реперфузію ниркової ішемії
- Роль дієтичного білка та м’язової форми у довголітті та старінні
- Ожиріння у дорослих Портал оптимального старіння Макмастера
- Ожиріння - це форма передчасного старіння, вважають вчені, і ми повинні це переглянути