Огляд монгенського та синдромічного ожиріння у людей
Анотація
Поширеність ожиріння в США зростає: понад 65% дорослих вважається надмірною вагою та 16% дітей з ІМТ> 95 процентиля. Спадковість ожиріння оцінюється між 40 і 70%, але генетика ожиріння для більшості людей є складною і передбачає взаємодію кількох генів та середовища. Однак існує кілька синдроматичних та несиндромічних форм ожиріння, які є моногенними та олігогенними, що забезпечують розуміння основного молекулярного контролю над вживанням їжі та нейронних мереж, які контролюють поведінку та насичення під час прийому, щоб регулювати масу тіла, і які можуть взаємодіяти із впливом лікування викликати або посилити ожиріння у дітей, які перенесли рак.
Вступ
Ожиріння або підвищене ожиріння в основному є результатом чистого дисбалансу споживання калорій над витратою енергії з часом. Навіть невеликі відмінності, що призводять до позитивного енергетичного балансу - при інтеграції протягом тривалих періодів часу можуть призвести до посилення ожиріння. У деяких випадках переважне розподіл надлишкових калорій по відношенню до жиру може посилити процес. Зі збільшенням доступності дуже смачної, калорійно щільної їжі, а також посиленою механізацією та дедалі сидячим способом життя, чистий позитивний енергетичний баланс у багатьох людей призвів до тривожного збільшення ожиріння у всьому світі. У США 65% дорослих вважають надмірною вагою (ІМТ 25,0–29,9), а більше 30% дорослого населення зараз вважається ожирінням (ІМТ> 30) [1]. Проблема також стосується дітей, у яких відсоток з ІМТ> 95 процентилів у віці 6–19 років становить 16% [2].
Молекулярні елементи у контролі маси тіла
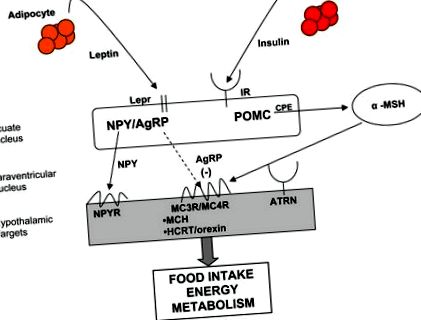
Молекулярний контроль енергетичного гомеостазу. Периферійні сигнали, включаючи лептин та інсулін, зв’язуються з рецепторами на тілах клітин дугоподібного ядра гіпоталамуса. нейропептид Y (NPY)/пов'язаний з гуті білок (AgRP) та про-опіомеланокортин (POMC)/кокаїн та амфетамінові транскрипти (CART) нейрони в дугоподібному ядрі виступають на клітинні тіла в інших ядрах гіпоталамусу, щоб впливати на енергетичний баланс через прийом їжі, витрата енергії та розподіл поживних речовин. Шлях меланокортину є невід’ємною частиною контролю енергетичного гомеостазу. α-MSH (альфа-меланотропін) отриманий в результаті протеолітичної обробки POMC і є агоністом (суцільна стрілка) для рецептора меланкортину 3 (MC3R)/(рецептора меланокортину 4 (MC4R), централізовано надаючи катаболічний ефект на енергетичний гомеостаз. AgRP є зворотним агоністом (пунктирна стрілка) на MC3R/MC4R, виробляючи анаболічні ефекти на енергетичний баланс. (BBB: гематоенцефалічний бар'єр; LEPR: рецептор лептину; IR: рецептор інсуліну; CPE: карбоксипептидаза E; ATRN: аттратин; MCH: концентрат меланіну; HCRT: гіпокретин/орексин)
Жировість людини вирішує складні взаємодії між генетичними, розвитку, поведінкою та впливами навколишнього середовища. Докази потужних генетичних внесків у ожиріння людини забезпечуються сімейним скупченням підвищеного ожиріння, включаючи 3–7-кратний підвищений відносний ризик (λs) серед братів і сестер [4], а також оцінками спадковості (частка загальної фенотипової дисперсії кількісна ознака, обумовлена генами у визначеному середовищі) для маси жиру від 40 до 70 відсотків у дослідженнях близнюків [5,6]. Очевидно, що генетичні зміни не можуть врахувати останні тенденції до збільшення ожиріння. Оскільки навколишнє середовище стає більш або менш сприятливим для розвитку ожиріння (легкість доступу до їжі, потреба у фізичних навантаженнях для її отримання, передбачуваний внутрішньоутробний та перинатальний вплив), середнє ожиріння населення відповідно змінюється. Фенотипові відмінності серед особин у цих крайніх станах ожиріння, мабуть, відображають алельні варіації в генах, які впливають на споживання енергії, витрати та хімічну форму, в якій зберігається надлишок калорій (розподіл).
В даний час, за оцінками, генетичні фактори становлять від 40 до 70 відсотків дисперсії ожиріння людини [4]. У більшості людей генетична основа ожиріння є складною і, ймовірно, передбачає взаємодію декількох генів, а також взаємодію між генами. Як і у випадку з іншими складними фенотипами, є рідкісні приклади моно/олігогенних причин ожиріння, які слугують зразком для розуміння складних гормональних та нейронних мереж, що регулюють ожиріння, і дають уявлення про шляхи, які можуть пояснювати більш поширені причини ожиріння, а також забезпечити цілі для терапевтичного втручання. У цій главі ми розглядаємо важливі генетичні та фізіологічні уявлення, отримані в результаті вивчення цих відносно рідкісних форм ожиріння.
Несиндромне моногенне ожиріння
Розуміння регулювання маси тіла у людей надзвичайно сприяло вивченню моногенних моделей ожиріння на гризунах. Для більшості генів, що спричиняють ожиріння на мишачих моделях, аналоги людини виявляли, як правило, подібну фізіологію.
Дефіцит лептину
Дефіцит рецепторів лептину
Незабаром після того, як був ідентифікований Леп, був виявлений рецептор лептину (Lepr) та виявлені мутації втрати функції в серіях алельних мишей діабету [12–14], а також у жирних щурів [15,16]. Лепр є членом сімейства рецепторів цитокінів і опосередковує передачу сигналів лептину через фосфатидилінозитол 3-кіназу та перетворювач сигналу та активатор транскрипції-3 (STAT3), переважно в нейронах гіпоталамусу [17]. Сигналізація STAT3 є вирішальною для регулювання споживання їжі, але не критичною для регуляції розмноження та росту. Шляхом скринінгу у людей, що страждають ожирінням, на підвищені концентрації лептину в сироватці крові, було виявлено родину споріднених груп, у якої три члени виявили екстремальне ожиріння на ранніх стадіях, пов’язане із затримкою природного росту, спричиненою порушенням секреції гормону росту [18]. Всі троє суб'єктів були гомозиготними щодо мутації місця сплайсингу в екзоні 16, що скорочує рецептор перед трансмембранним доменом, роблячи всі клітини нездатними передавати внутрішньоклітинний сигнал. Дефіцит рецепторів лептину у людини викликає надзвичайне ожиріння аутосомно-рецесивно. Суб’єкти, у яких недостатні рецептори лептину, мають нормальну базальну температуру, швидкість метаболізму в спокої, спонтанне, але відстрочене статеве дозрівання та нормальну концентрацію кортизолу в плазмі [18].
Дефіцит про-опіомеланкокортину
Аутосомно-рецесивний дефіцит POMC обумовлений гетерозиготністю або гомозиготністю складових мутацій втрати функції у невеликої кількості людей, що спричиняє важке ожиріння раннього віку, пов’язане з гіперфагією [23–25] через відсутність αMSH, що діє центрально на MC3R та MC4R. Через відсутність дії периферичного α MSH діти також продемонстрували блідий колір шкіри та руде волосся через відсутність периферичного агонізму при MC1R. П'ятеро дітей спочатку мали невизначувані рівні кортизолу та АКТГ на ранніх термінах, що відповідає відсутності ліганду АКТГ для кортикальної MC2R надниркових залоз. Встановлено, що у гетерозиготних осіб спостерігається проміжне збільшення маси тіла, що свідчить про ефект дозування гена для POMC [26].
Дефіцит прогормону конвертази 1
Як і миша-нокаут Pomc, товста миша є прикладом аутосомно-рецесивного ожиріння пізнішого початку та зменшення тяжкості щодо мишей із ожирінням та діабетом. Спостереження підвищених рівнів циркулюючого проінсуліну у цих мишей призвело до виявлення мутації Ser202Pro в позиційному гені-гені карбоксипептидази Е (Cpe), яка відповідає за прогормонове розщеплення основних залишків С-кінця від прогормонів та пронейропептидів, таких як проінсулін, пронейропептид Y, прогонадотропін та POMC [27]. Розуміючи, що аберрантна обробка гормону може спричинити ожиріння, Jackson et al. ідентифікував двох суб'єктів із складеними гетерозиготними мутаціями прогормон-конвертази 1 (PC1), ферменту, який розщеплює прогормони на двоосновних амінокислотах на етапі безпосередньо перед обробкою CPE [28]. У обох суб’єктів було описано ожиріння у дітей, підвищений рівень проінсуліну, гіпокортизолемія з підвищеним рівнем POMC, реактивна гіпоглікемія та гіпогонадотропний гіпогонадизм [28,29]. Фенотип ожиріння обстежуваних, ймовірно, зумовлений аберрантним POMC та іншою обробкою прогормону, а фенотип людей повторює фенотип жирової миші.
- Тривога самостійно сприяє підвищеному запаленню у людей із ожирінням - Пірс - 2017
- Чи може епідемія ожиріння у людей пояснюватися скоріше вживанням приправ, ніж поживних речовин MedCrave
- Адаптація до дієти з високим вмістом жиру прискорює спорожнення жиру, але не вуглеводних тестових страв у людей
- Бігуаніди - огляд тем ScienceDirect
- Похідна бігуаніду - огляд тем ScienceDirect