Одномолекулярне маркування для вивчення торгівлі нирковими транспортерами
Відділ досліджень гіпертонії та судин, відділ внутрішніх хвороб, лікарня Генрі Форда, Детройт, штат Мічиган
Кафедра фізіології Медичного факультету Університету Уейна, Детройт, штат Мічиган
Адреса для запитів на передрук та іншої кореспонденції: A. B. Jaykumar, 6001 Forest Park Rd., ND7.202, Dallas, TX 75235 (e-mail: [email protected]).
Відділ досліджень гіпертонії та судин, відділ внутрішніх хвороб, лікарня Генрі Форда, Детройт, штат Мічиган
Відділ досліджень гіпертонії та судин, відділ внутрішніх хвороб, лікарня Генрі Форда, Детройт, штат Мічиган
Кафедра фізіології Медичного факультету Університету Уейна, Детройт, штат Мічиган
Анотація
Здатність виявляти та відслідковувати одиничні молекули представляє перевагу візуалізації складної поведінки трансмембранних білків із часовою та просторовою роздільною здатністю, яка в іншому випадку була б втрачена за допомогою традиційних методів маркування та біохімічних методів. Розробка нових візуалізаційних зондів забезпечила надійний метод вивчення їхньої торгівлі та динаміки поверхні. Цей міні-огляд зосереджується на сучасній технології, що доступна для маркування одномолекулярних трансмембранних білків, їх перевагах та обмеженнях. Ми також обговорюємо застосування цих методів для вивчення торгівлі нирковим транспортером у світлі останніх досліджень.
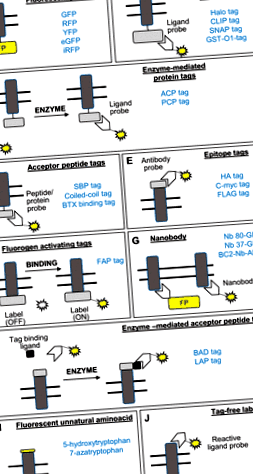
Розвиток зелених флуоресцентних білків та інших червоних/жовтих/посилених зелених флуоресцентних білків (FP), поряд з рН-чутливими версіями міток (3), забезпечив початковий прорив у здатності мітити трансмембранні білки, такі як нирковий натрій -бікарбонатний котранспортер, нирковий натрій-фосфатний котранспортер-2а), нирковий транспортер глюкози-4 (або GLUT4), серед інших (2, 6, 18, 26, 36, 46, 50, 90, 91, 95, 96) (рис. . 1A). Подальші модифікації кодуючих послідовностей FP покращили їх спектральні та біохімічні властивості. Флюорофорні властивості, такі як коефіцієнт екстинкції, квантовий вихід, фотостабільність та чутливість до рН (72), слід враховувати для різних застосувань зображень, таких як флуоресцентний резонансний перенос енергії (24), конфокальна мікроскопія (79), флуоресцентна мікроскопія із повним внутрішнім відбиттям (51) або супер -резолюційна мікроскопія (62, 78). Однак є основні недоліки використання FP для мічення мембранних білків, такі як втручання в ендогенну активність міченого білка через надмірну експресію (1), олігомеризацію, спричинену FP (68), і великий розмір мітки (
30 кДа) (100). Ці труднощі до певної міри були обійдені стратегіями, що зменшують надмірне вираження (4), оптимізацію конструкції та довжини лінкера та вибір місця для вставки послідовності FP (5, 48, 100). Незважаючи на величезний початковий внесок стандартних FP у створення мікроскопії з надвисокою роздільною здатністю, їх властивість зазнавати незворотного фотовідбілювання, низької фотостабільності та квантового виходу обмежує їх використання для довготривалих масштабних експериментів. Однак нещодавно розроблені флуоресцентні білки, такі як ближній інфрачервоний флуоресцентний білок на основі фітохрому, мають набагато вищий коефіцієнт сигналу до шуму та фотостабільність, що дозволяє проводити візуалізацію глибше в тканинах, що, таким чином, актуально для живих тварин або січених моделі тканин (33).
Рис. 1.Схематичне зображення одномолекулярних методів маркування, обговорених у огляді. Прямокутник сірим кольором являє собою трансмембранний білок, подвійні лінії - фосфоліпідний бішар, а жовта лінія - флуоресцентний елемент. АКТ, білок-ацил-носій; БАД, домен акцептора біотину; BC2, короткий лінійний епітоп, що відповідає 16–27 залишкам β-катеніну; eGFP, посилений зелений флуоресцентний білок; FAP, пептид, що активує фтороген; GFP, зелений флуоресцентний білок; GST-O1, глутатіон-s-трансфераза омега1; ГК, гемаглютинін; LAP, пептид акцептора ліпоєвої кислоти; PCP, білок-носій пептидилу; RFP, червоний флуоресцентний білок; SBP, пептид, що зв’язує стрептавідин; ТС, тетрацистеїн; UAA, неприродна амінокислота; YFP, жовтий флуоресцентний білок; α-BTX, α-бунгаротоксин. Інші назви тегів, що використовуються у прикладах, є комерційними назвами торгових марок, такими як Halo Tag, тег CLIP, тег SNAP та тег FLAG.
Альтернативою FP є Halo Tag (87), SNAP Tag (80, 89), CLIP Tag (101) та глутатіон-S-мітка трансферази-омега-1 (GST-O1) (59, 88) (рис. 1B). Ці мітки генетично вбудовані в мембранний білок і використовувались для вивчення торгівлі рецепторами фактора росту, отриманими з тромбоцитів (87), рецепторами, подібними до глюкагоноподібного пептиду-1, та торгівлею мембранами в клітинних лініях епітеліальних нирок (80, 89), β2-адренергічний рецептор та рецептор орексину-1 (101), рецептор канабіноїдів та рецептор епідермального фактора росту (59, 101) в інших моделях клітин. Потім мітки потім модифікуються, щоб дозволити зв'язування ковалентними або високоафінними зв'язками з органічним флуорофором з високою фотостійкістю та яскравістю (10, 20). Ці мітки використовувались для одночасного зображення двомембранних білків (30, 101). Нещодавно були розроблені зонди для тегів SNAP, що додають універсальності у вивченні ендоцитозу та переробки (19). Ці хімічні підходи зазвичай вимагають декількох етапів промивання для видалення непрореагованого флуорофору для мінімізації фонового сигналу. Щоб обійти цю проблему, був розроблений флуорогенний зонд SNAP, який флуоресцирує лише після прив’язки мітки (75, 92). Залишаються додаткові обмеження, такі як надмірна експресія, яка може бути зменшена за допомогою використання промоторів з низькою експресією (69) та великої молекулярної маси мітки (
20–30 кДа). Це останнє питання було покращено розробкою менших тегів (
8 кДа), такі як мітка білка ацильного носія (15, 50) та мітка білка пептидильного носія (108), серед інших (109) (рис. 1C.). Вони були використані для вивчення торгівлі рецепторами трансферину (108) та рецепторами одорантів у клітинній нирковій лінії, де їх роль починають оцінювати (50). Однак ці менші мітки все ще потребують додавання або експресії екзогенного ферменту для ковалентного приєднання флуорофору.
Значного зменшення розміру мітки було досягнуто за рахунок додавання коротких пептидних акцепторних послідовностей (
Вони складаються з генетично вбудованих епітопів, таких як гемаглютинін (HA), FLAG або c-Myc, у позаклітинні домени, а потім використовують антитіла для мічення (рис. 1Е). Мітка HA була використана для вивчення обороту мембран нирковим калієвим каналом ROMK (29) та мембранних білків на інших моделях клітин ссавців (32, 52, 76). Тег FLAG був використаний для вивчення обороту мембран рецептора вазопресину нирок типу-2 та рецептора солодкого смаку T1R2/3 у моделі клітин нирки, в якому починають оцінювати його роль (11, 85) та мітки c-myc для дослідження поверхневе накопичення аквапорину-2 при стимуляції вазопресину в мембранах, стійких до ендоцитозу, в клітинах нирок (11). Однак для видалення незв’язаного флуорофора цими методами потрібні тривалі терміни маркування та кілька етапів промивання, обмежуючи їх використання в проміжок часу мікроскопії.
Вони являють собою рекомбінантні або генетично кодовані, антиген-специфічні, варіабельні фрагменти антитіл до важкої ланцюга верблюдів, які або генетично злиті з FP, або кон'юговані з барвниками або хромогенними ферментами (83) (рис. 1).G). Їх невеликі розміри, стабільність, оборотне повторне згортання, розчинність у водному розчині та здатність розпізнавати свої ендогенні мішені в конкретній перехідній конформації з субнаномолярною спорідненістю (73) роблять їх придатними для відстеження одночастинок та маніпулювання кінетикою оболонки білка мембрани (25, 40, 41, 47, 58, 61, 71, 97, 83, 97, 103).
Нещодавній підхід мінімізує небажаний вплив міток великого розміру на функцію білка за допомогою сайт-спрямованого мутагенезу, що дозволяє включити одну флуоресцентну неприродну амінокислоту (UAA) (рис. 1Я). Цей метод був використаний для вивчення торгівлі нікотиновими рецепторами ACh (70). Однак для цього потрібна коекспресія відповідних пар тРНК та аміноацил-тРНК синтетаз, які розпізнають UAA (100).
Цей метод дозволяє мітити білки в їх рідному стані (94, 98) (рис. 1J). Потрібен відомий ліганд для поверхневого білка (наприклад, брадикінін), нуклеофільна амінокислота, що потрапляє на поверхню, і ліганд хімічної інженерії для перенесення зонда (біотин або флуоресцентний) до цікавого білка на основі типового нуклеофільна реакція заміщення ацилу (65).
Цю роботу підтримали, зокрема, Американська кардіологічна асоціація - Предокторська стипендія 16PRE27510032 Анкіті Б. Джейкумар та грант Національного інституту охорони здоров’я 1R01DK107263 01A1 та допомога Американської асоціації серця доктору Пабло А. Ортісу.
Автори не заявляють жодного конфлікту інтересів, фінансового чи іншого.
A.B.J. та P.S.C. підготовлена фігура; A.B.J. складений рукопис; A.B.J., P.S.C. та P.A.O. відредагований та перероблений рукопис; A.B.J. та P.A.O. затверджена остаточна версія рукопису.
ПОДЯКИ
Присутні адреси: А. Б. Джайкумар, кафедра фармакології, ун-т. Техаського південно-західного медичного центру, Даллас, Техас 75235; P. S. Caceres, кафедра офтальмології, Медичний коледж Weill Cornell, Нью-Йорк, Нью-Йорк 10021.
- Відповісти Вплив втрати ваги на FVC у дослідженнях ідіопатичного легеневого фіброзу нінтеданібу, Американський журнал
- Короткочасна мінливість маси тіла передбачає довгострокове збільшення ваги
- Метаболізм білка після пошкодження скипидаром щуряча модель для клінічної травми Американський журнал
- Синтез пептидів, каталізований протеазами, у журналі твердої підтримки Американського хімічного товариства
- Поліморфізм какао-масла - Wille - 1966 - Журнал американських нафтохіміків; Суспільство - Вілі