Оцінка семи різних процедур сушіння щодо загального вмісту флавоноїдів, фенольних, вмісту вітаміну С, хлорофілу, антиоксидантної активності та кольору зеленого чаю (Camellia sinensis або C. assamica)
Сахар Рошанак
Департамент харчових наук, сільськогосподарський коледж, Технологічний університет Ісфахана, Ісфахан, 84156 83111 Іран
Мехді Рахіммалек
Кафедра агрономії та селекції рослин, Сільськогосподарський коледж, Ісфаханський технологічний університет, Ісфахан, 84156 83111 Іран
Саїд Амір Хосейн Голі
Департамент харчових наук, сільськогосподарський коледж, Технологічний університет Ісфахана, Ісфахан, 84156 83111 Іран
Анотація
Ефект семи процедур сушіння (сонце, тінь, піч 60 ° C, піч 80 ° C, піч 100 ° C, мікрохвильовка та сублімаційне сушіння) оцінювали з урахуванням загальної кількості флавоноїдів (TFC), фенольних (TPC), антиоксидантної активності, вітамін С та кольорові характеристики зеленого чаю. Загалом сушіння підвищувало антиоксидантну активність, вміст TPC, TFC та хлорофілу, в той час як це призводило до зменшення вмісту вітаміну C. Найвищі TPC (209,17 мг галлової кислоти/gdw) та TFC (38,18 mg кверцитину/gdw) були отримані при сушці в печі при 60 і 100 ° C відповідно. Серед методів сушіння в духовці при 60 ° C виявило найвищу активність видалення радикалів (IC50 = 167,166 мкг/мл), тоді як мікрохвильова піч виявила найнижчу (IC50 = 505,5 мкг/мл). Подібна тенденція спостерігалася і в аналізі зменшення потужності. Найвищий вітамін С (16,36 мг/100 гДМ) та хлорофіл А (17,35 мг/л) були отримані при сублімаційній сушці. Врешті-решт, методи сушіння на сонці та заморожування вважалися найменшими та найбільш бажаними методами сушіння, відповідно кінцевим кольором листя зеленого чаю.
Вступ
Чай - один із найпопулярніших напоїв у світі (червень 2009 р.). Він (Camellia sinensis або C.assamica) використовується в різних частинах світу як зелений, чорний або улун. Серед них найвизначніший позитивний вплив на здоров’я людини спостерігається вживанням зеленого чаю (Armoskaite et al. 2011). Відмінності між зеленим та чорним чаєм полягають у процесі їх виробництва. Для отримання зеленого чаю свіжозібране листя негайно готують на пару або нагрівають, щоб знищити ферменти, що відповідають за розщеплення кольорових пігментів у листі, і дозволити чаю зберегти зелений колір під час сушіння. Ці процеси зберігають природні поліфеноли щодо їх зміцнюючих здоров’я властивостей (Mazzanti et al. 2009; Komes et al. 2010; Armoskaite et al. 2011).
В останні роки багато уваги приділяється якості продуктів харчування під час сушіння. Потреба у високоякісних сушених харчових продуктах зросла у всьому світі. Основна мета сушіння - збільшення терміну зберігання продуктів; мінімізувати вимоги до упаковки та зменшити насипну вагу. Процес сушіння збільшує термін зберігання, уповільнюючи або зупиняючи ріст мікроорганізмів та запобігаючи певним біохімічним реакціям, які можуть змінити органолептичні характеристики (Rahimmalek and Goli 2013). Крім того, зростає інтерес до пошуку природних антиоксидантів для споживання в харчових продуктах або лікарських матеріалах для заміщення синтетичних антиоксидантів, які обмежені через їх канцерогенність (Stankovic et al. 2012; Katalinic et al. 2012).
Зелений чай містить багато цінних сполук, таких як фенольні речовини, флавоноїди (катехіни), амінокислоти, мінерали, вітаміни (В, С, Е), ксантичні основи (кофеїн, теофілін), пігменти (хлорофіл, каротиноїди) та леткі сполуки (альдегіди, спирти, складні ефіри, лактони, вуглеводні) (Armoskaite et al. 2011). Варто зазначити, що численні епідеміологічні дослідження пов'язують ці флавоноїди чаю з багатьма перевагами для здоров'я людини, такими як профілактика раку, серцево-судинні захворювання, мікробні захворювання, діабет та ожиріння (Vuong et al. 2011; Prathapan et al. 2011). Було встановлено, що флавоноїди чаю запобігають перекисному окисленню ліпідів, що є основною проблемою харчової промисловості, що може спричинити несприятливу прогорклість та потенційно токсичну реакцію у продуктах (Vuong et al. 2011).
Більшість попередніх досліджень зеленого чаю проводились за обмеженими методами сушіння (Hirun et al. 2014). Крім того, сушильні процедури можуть вплинути на харчові та якісні характеристики зеленого чаю, такі як вітаміни, колір, хлорофіл, загальний флавоноїд, загальний вміст фенолу та антиоксидантна активність кінцевого продукту, але в більшості попередніх досліджень вивчався один або два якісні аспекти. Більше того, наскільки нам відомо, не було доступно вичерпних звітів про варіації вітаміну С, колірних характеристик, хлорофілу, загального флавоноїду, загального вмісту фенолу та антиоксидантної активності зеленого чаю за різних способів сушіння. Тому цілями цього дослідження було (1) вивчити вплив семи методів сушіння (сушка на сонці, сушка в тіні, сушка в духовці при 100, 80 і 60 ° C, сублімаційна сушка та мікрохвильова піч) щодо вітаміну С, загального фенольного, вміст флавоноїдів та хлорофілу, (2) для оцінки колірних характеристик висушених зразків на основі параметрів L *, a *, b * та (3) для порівняння антиоксидантної активності зразків в різних умовах сушіння.
Матеріали і методи
Рослинний матеріал
Листя зеленого чаю, отримані з чайних ферм у місті Лагіджан у північному регіоні Ірану восени, у вегетаційний період. Щоб захистити їх від ферментативного побуріння, листя бланшували парою при 90 ° С протягом 1 хв.
Методи сушіння
Листя сушили одним із наступних методів: (а) сушіння на повітрі при тіні та кімнатній температурі (25 ° С); (b) висихання на сонці; (c) сушіння в духовій шафі з гарячим повітрям при 60 ° C; (d) сушіння у пічі з гарячим повітрям при 80 ° C; (д) сушіння в гарячому повітрі при температурі 100 ° С; (f) сушіння в мікрохвильовій печі при 800 Вт; (g) сублімаційна сушка. Тіньову сушку проводили під природним потоком повітря та температурою навколишнього середовища (середня температура = 25 ° C) протягом 36 год. У разі висихання на сонці листя сушили в лотках під прямими сонячними променями при температурі від 30 до 35 ° C протягом 7,5 год у листопаді в Ісфахані, Іран. Сушіння в духовці проводили у вентильованій печі (Оск, Японія) при трьох різних температурах (60, 80 та 100 ° C). Сушіння в мікрохвильовій печі проводили у побутовій цифровій мікрохвильовій печі (Nikai, NMO-518 N, Японія) з технічними характеристиками 230 В, 800 Вт. Зразки сушили протягом 240 с. Сублімаційну сушку проводили в морозильній сушарці HeltoHolten DW8. Рослинні матеріали заморожували при -80 ° C протягом 24 годин і сушили під вакуумом і температурою конденсатора при -15 ° C протягом 24 годин.
Вимірювання кольору
П'ять грамів кожного методу подрібнювали в кавомолці протягом 10 с для отримання порошку однорідного кольору. Зразки переносили в 10-сантиметрову чашку Петрі і згодом зчитували за допомогою спектрофотометра Texflash (Datacolor, Swiss). Колориметр відкалібрували за стандартною калібрувальною пластиною білої поверхні і встановили значення CIE Standard Illuminant C. Значення L *, a * і b * визначали і усереднювали за трьома показаннями. Яскравість кольору, L * вимірює значення білості кольору і коливається від чорного на 0 до білого на 100. Координата кольоровості a * вимірює червоний колір при позитивному та зелений при негативному, а координата кольоровості b * вимірює жовтий колір при позитивному та синьому коли негативний (Arslan and Ozcan 2008).
Вміст хлорофілу
Сто мг речовини подрібнювали в ступці з 4 мл 80% ацетону. Розмелений матеріал збирали у 15 мл соколину пробірку. Розчин промивали 4 мл ацетону. Об'єм сокола доводили до 10 мл ацетоном. Соколи тримались у льоду та темному середовищі. Зразки центрифугували при 3000 об/хв (Sigma, Німеччина) протягом 10 хв при 4 ° C. Відразу після центрифугування соколи переносили на лід перед швидким вимірюванням спектрофотометром. Поглинання розчину зчитували при трьох довжинах хвиль, включаючи 663,2, 646,8 та 470 нм. Концентрації хлорофілу розраховували в мг/л ацетону за формулою:
Вміст вітаміну С.
Аскорбінову кислоту (АА) визначали методом титрування із застосуванням 2,6-дихлорфенол – індофенолів згідно з методом АОАС № 967.21 (АОАС, 2000). Вміст вітаміну С у свіжих та сушених зразках виражали у мг АА/100 г вологої основи.
Загальний вміст фенолу
2,5 г дрібно подрібненого зразка екстрагували 50 мл метанолу 80% у соколі і струшували при 240 об/хв протягом 24 годин. Зразок двічі фільтрували ватманом 0,2 мкм. Загальний вміст фенолу (TPC) визначали за допомогою методу Фоліна-Чіокальтеу (Pinelo et al. 2004). Також змішували 500 мкл розведеної екстракції (500 мкл первинної екстракції регулювали в обсязі 50 мл метанолу 80% для отримання розведення 1/250), 2,5 мл реагенту Фолін-Ціокальтеу та 2 мл 7,5% карбонату натрію. Після нагрівання при 45 ° С протягом 15 хв поглинання вимірювали при 765 нм проти метанолу 80% у вигляді порожнього матеріалу. TPC виражали як еквівалент галової кислоти/г сухої маси зразка. Калібрувальне рівняння для галової кислоти було отримано як y = 17,422x + 0,0872 (R2 = 0,998), де x - поглинання, а y - концентрація галової кислоти в мг/л.
Загальний вміст флавоноїдів у екстрактах
Загальний вміст флавоноїдів визначали спектрофотометрично, використовуючи метод, заснований на утворенні складного флавоноїду – алюмінію з деякими модифікаціями. Аликвоту (0,5 мл) розчину екстракту змішували з дистильованою водою (2 мл) і згодом з розчином NaNO2 (5%, 0,15 мл). Через 6 хв додавали розчин AlCl3 (10%, 0,15 мл) і залишали стояти ще 6 хв; після цього до суміші додавали розчин NaOH (4%, 2 мл). Негайно додали дистильовану воду для доведення кінцевого об'єму до 5 мл. Потім суміш правильно перемішували і давали постояти 15 хв. Інтенсивність рожевого кольору вимірювали при 510 нм.
Активність знищення радикалів DPPH
Здатність рослинного екстракту та еталонної речовини поглинати вільні радикали 2,2-дифеніл-1-пікрилгідразилу (DPPH) оцінювали за допомогою методу, описаного Stankovic et al. (2012). Вихідний розчин рослинного екстракту готували у метанолі 80% для досягнення концентрації фенолу 5, 3, 1 та 0,5 мг/мл. Розведення проводили для отримання фенольних концентрацій 500, 300, 100 та 50 мкг/мл (ppm). 100 мкл розведених розчинів змішували з 5 мл метанольного розчину DPPH (0,1 мМ) і регулювали до обсягу 10 мл метанолом 80%. Через 30 хв у темряві при кімнатній температурі (23 ° С) поглинання реєстрували при 517 нм. Контрольні зразки містили всі реагенти, крім екстракту. Відсоток інгібування розраховували за рівнянням:% інгібування = 100 × (А контролю - А зразка)/А контролю, тоді як концентрації екстрактів, необхідних для інгібування радикалу на 50% (IC50), оцінювали з відсотка інгібування проти концентрація сигмовидної кривої, використовуючи нелінійний регресійний аналіз. Дані були представлені як середні значення ± стандартне відхилення (N = 2) (Arslan and Ozcan 2012).
Зменшення потужності
Екстракти (2,5 мл) і бутильований гідрокситолуол (ВНТ) змішували з 2,5 мл 1% фериціаніду калію та 2,5 мл 200 мМ фосфатного буфера натрію (рН 6,6) та інкубували при 50 ° С протягом 20 хв. Потім додавали 2,5 мл 10% трихлороцтової кислоти і суміш центрифугували при 200 г протягом 10 хв. Верхній шар (2,5 мл) змішували з 2,5 мл деіонізованої води та 0,5 мл 0,1% хлориду заліза. Поглинання при 700 нм вимірювали щодо заготовки. Підвищена абсорбція реакційної суміші корелює з більшою відновлюючою силою (Ardestani and Yazdanparast 2007).
Статистичний аналіз
Кластерний аналіз та підрахунок кореляційних зв'язків між сполуками проводили за допомогою SPSS ver.11 на основі методу мінімальної дисперсії Уорда (Ward 1963). Кластерний аналіз був проведений для класифікації методів сушіння на основі їх подібності основних сполук. Статистична вер. 8 також використовували для оцінки. Значимість даних розраховували за допомогою SAS ver. 8.
Результати і обговорення
Загальний вміст флавоноїдів та фенолу
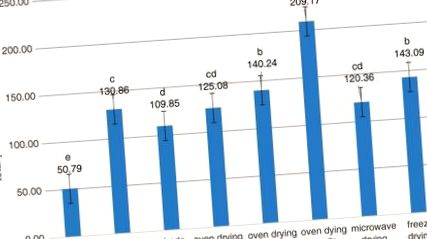
Зміни загального вмісту фенолу (TPC) у зеленому чаї з використанням семи сушильних процедур. Бари з різними літерами істотно відрізняються
Попередні дослідження також повідомляли про високу кількість TFC у зеленому чаї порівняно з іншими видами (рис. 2). Це може бути пов’язано з більшим окисленням та полімеризацією ферментами, одержуваними із заварки, під час виробництва улуну та чорного чаю із зеленого чаю шляхом ферментації (Bae et al. 2015). Крім того, попередні звіти показали, що температура понад 50 ° C призводить до зменшення врожаю ефірної олії та загального вмісту фенолів у різних видах рослин (Braga et al. 2005; Rezaeinodehi and Khangholo 2008; Rabeta and Lai 2013). Пратапан та ін. (2009) вивчали вплив термічної обробки (60–100 ° C) на TPC, значення кольору (жовтуватість та яскравість), активність поліфенолоксидази (PPO) та куркуміноїд свіжого кореневища куркуми. У їх дослідженні значення TPC поступово зростали при нагріванні зразків від 60 до 80 ° C. Більше того, РРО був повністю інактивований при 80 ° C (Prathapan et al. 2009).
Зміни загального вмісту флавоноїдів (TFC) у зеленому чаї за допомогою семи сушильних процедур. Бари з різними літерами істотно відрізняються
Під час сушіння метаболічно активні рослини повільно втрачають вологу і можуть відчувати втрату вологи як стрес. Рослини, як правило, виробляють фенольні сполуки як захисний механізм у відповідь на стрес. Повідомляється, що синтез кількох фенілпропаноїдних сполук (флавоноїдів, ізофлавоноїдів, псораленів, кумаринів, фенольних кислот, лігніну та суберину) був індукований у рослинах у відповідь на біотичний та абіотичний стрес, такий як поранення, низька або висока температура та атаки збудників (Діксон і Пайва, 1995).
Аналіз DPPH
Вимірювали здатність різних екстрактів процедур сушіння чаю гасити вільні радикали DPPH. Екстракти та BHT продемонстрували дозозалежну активність прибирання шляхом зменшення радикала DPPH (рис. 3). Побудувавши графік графіку концентрацій екстракту щодо активності очищення, була розрахована питома концентрація зразка, яка мала забезпечити 50% інгібування (IC50). Серед обробок сушіння в духовці при 60 ° C виявило найвищу активність видалення радикалів (найнижча IC 50 = 167,166 мкг/мл), тоді як мікрохвильова обробка показала найнижчу активність очищення (IC 50 = 505,5 мкг/мл). Попередні дослідження показали, що активність прибирання радикалів була підвищена при більш високих температурах сушіння за допомогою обробок сушіння в печі (Lee Mei Ling et al. 2013; Rodriguzer et al. 2014). Вважається, що високий загальний вміст фенолу може сприяти високій антиоксидантній активності завдяки високотемпературній сушці (Lou et al. 2015).
- Оцінка сухого сезону вирощування африканських гігантських равликів Archachatina marginata на Різне
- Екстракт насіння грейпфрута 90 капсул 125 мг від NutriBiotic Total Health Inc Menomonee Falls; Новий
- Сканер ES-Teck, захоплююча технологія для повного сканування тіла
- Репресії щодо доступу до суперплатників для оплати медичних процедур
- Каталізатори Co-Ru з різними композитними оксидними носіями для досліджень Фішера – Тропша на 3D-друці