Неосубстрат, який підсилює каталітичну активність кінази PINK1, пов’язаної з хворобою Паркінсона
Ніколас Т. Герц
1 Медичний інститут Говарда Х'юза та кафедра клітинної та молекулярної фармакології Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія, 94158, США
2 аспірантура з хімії та хімічної біології, Каліфорнійський університет, Сан-Франциско, Сан-Франциско, Каліфорнія, 94158, США
Амандін Берт
3 Інститут неврологічних захворювань Гладстона, Каліфорнійський університет, Сан-Франциско, Сан-Франциско, Каліфорнія 94158, США
Мартін Л. Сос
1 Медичний інститут Говарда Х'юза та кафедра клітинної та молекулярної фармакології Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія, 94158, США
Курт С. Торн
6 Кафедра біохімії Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія 94158, США
Ел Л. Берлінгейм
5 Кафедра фармацевтичної хімії Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія 94158, США
Кен Накамура
3 Інститут неврологічних захворювань Гладстона, Каліфорнійський університет, Сан-Франциско, Сан-Франциско, Каліфорнія 94158, США
4 Кафедра неврології та аспірантури з неврології та біомедичних наук, Каліфорнійський університет, Сан-Франциско, Сан-Франциско, Каліфорнія 94158, США
Кеван М. Шокат
1 Медичний інститут Говарда Х'юза та кафедра клітинної та молекулярної фармакології Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія, 94158, США
Пов’язані дані
Резюме
Мітохондрії вже давно беруть участь у патогенезі хвороби Паркінсона (БП). Мутації мітохондріальної кінази PINK1, що знижують активність кінази, пов'язані з мітохондріальними дефектами і призводять до аутосомно-рецесивної форми раннього початку PD. Терапевтичні підходи для посилення активності PINK1 не розглядались, оскільки не відомі алостеричні регуляторні сайти для PINK1. Тут ми показуємо, що альтернативна стратегія, підхід до нео-субстрату, що включає аналог АТФ кінетину трифосфату (KTP), може бути використана для збільшення активності як мутантного, пов'язаного з PD, PINK1 G309D, так і PINK1 wt. Більше того, ми показуємо, що застосування кінетину-попередника KTP до клітин призводить до біологічно значного збільшення активності PINK1, що проявляється у підвищенні рівня набору Паркіна в деполяризовані мітохондрії, зниженні рухливості мітохондрій в аксонах та нижчому рівні апоптозу. Відкриття нео-субстратів для кіназ може забезпечити раніше недооцінений спосіб регулювання активності кіназ.
Вступ
Хвороба Паркінсона (PD) характеризується втратою дофамінергічних (DA) нейронів у чорній речовині, області середнього мозку, що є критично важливою для моторного контролю (Lang and Lozano, 1998). Мітохондріальна дисфункція була тісно пов'язана з ПД за допомогою декількох механізмів (Nunnari and Suomalainen, 2012; Rugarli and Langer, 2012), включаючи мутації мітохондрій-специфічної кінази PTEN-індукованої кінази 1 (PINK1) (Valente et al., 2004) та мітохондрій -асоційована Е3 убиквитин-лігаза Паркін (Kitada et al., 1998). PINK1 відіграє важливу роль у відновленні дисфункції мітохондрій, реагуючи на пошкодження на рівні окремих мітохондрій. У здорових мітохондріях PINK1 швидко руйнується протеазою ParL (Meissner et al., 2011); але за наявності деполяризації внутрішньої мембрани PINK1 стабілізується на зовнішній мембрані, де завербує і активізує паркін (Narendra et al., 2010), блокує злиття і торгівлю мітохондріями (Clark et al., 2006; Deng et al., 2008; Wang et al., 2011) і, зрештою, викликає мітохондріальну аутофагію (Geisler et al., 2010; Narendra et al., 2008; Youle and Narendra, 2011). Шлях PINK1 також був пов'язаний з індукцією біогенезу мітохондрій та зменшенням індукованого мітохондріями апоптозу в нейронах, останній фенотип принаймні частково обумовлений впливом PINK1 на рухливість мітохондрій, нейроноспецифічний фенотип (Deng et al., 2005; Petit et al., 2005; Pridgeon et al., 2007; Shin et al., 2011; Wang et al., 2011).
Особи, гомозиготні для мутацій втрати функції PINK1, можуть розвинути форму раннього початку ПД, що є результатом високоселективної втрати нейронів ДА, і, принаймні в одному клінічному випадку, поділяють патологію спонтанної БД Леві-тіла (Gautier et al., 2008; Geisler et al., 2010; Haque et al., 2008; Henchcliffe and Beal, 2008; Petit et al., 2005; Samaranch et al., 2010). Недавня робота показала, що із 17 клінічно значущих мутацій PINK1 ті мутанти, які впливають на каталітичну активність, але не впливають на розщеплення або субклітинну локалізацію, мають найбільш значний вплив на життєздатність нейронів, додатково підтримуючи роль діяльності PINK1 у профілактиці нейродегенерації (Song et al., 2013). Один з найпоширеніших каталітичних мутантів, PINK1 G309D, показує a
Зменшення активності кінази на 70% і скасовує нейропротекторний ефект PINK1 (Petit et al., 2005; Pridgeon et al., 2007). Однак нижчу каталітичну активність PINK G309D можна врятувати надмірною експресією PINK1 wt, а підвищення активності PINK1 за допомогою надмірної експресії PINK1 wt зменшує апоптоз, спричинений ставроспорином та окислювальним стресом, у багатьох клітинних лініях, що припускає, що посилена активність PINK1 може ефективна терапевтична стратегія для БД (Arena et al., 2013; Deng et al., 2005; Kondapalli et al., 2012; Petit et al., 2005; Pridgeon et al., 2007).
Визнаючи терапевтичний потенціал активації шляху PINK1/Паркін, ми розпочали дослідження механізмів фармакологічної активації PINK1. Активація малих молекул кіназ, як правило, здійснюється шляхом зв'язування алостеричних регуляторних ділянок: наприклад, природні продукти, такі як ефіри форболу, зв'язуються з домом зв'язування ліпідів ПКС і рекрутують кіназу до мембрани (Castagna et al., 1982; Nishizuka, 1984); окремо АМФ-активована протеїнкіназа (АМРК) активується шляхом зв'язування АМФ з алостеричним сайтом (Ferrer et al., 1985; Hardie et al., 2012). Однак PINK1 не містить відомих сайтів зв'язування малих молекул. Інша потенційна стратегія може включати маніпуляції з ділянками взаємодії білка або активним сайтом, враховуючи те, що були ідентифіковані синтетичні ліганди, які зв'язуються з місцями стикування білка на кіназі PDK1 (Hindie et al., 2009; Wei et al., 2010), і, окремо, що активність Src можна контролювати хімічним доповненням каталітичного залишку з активним центром, що дозволяє приймати АТФ лише тоді, коли мутантному Src був наданий імідазол (Ferrando et al., 2012; Qiao et al., 2006). Однак ці підходи не застосовувались до PINK1, оскільки відсутні структурні дані для PINK1.
Далі ми звернули свою увагу на сайти в межах PINK1, які, як відомо, змінюють його функцію або стабільність. Чотири мутації, пов'язані з хворобою PINK1, включаючи G309D, виникають при незвичній вставці в складку канонічної кінази. PINK1, як і декілька ортологів, мають 3 такі великі (> 15 AA) вставки в домені N-кінцевої кінази (малюнок S1A) (Cardona et al., 2011; Mills et al., 2008), що забезпечує більшість контактів до аденінового кільця АТФ. Встановлено, що вставки в активний центр кількох ферментів змінюють специфічність субстрату. В одному прикладі деубіквітиназа UCH-L5 може гідролізувати більші ланцюги убиквітину лише тоді, коли в активному центрі присутня петля> 14 АА (Zhou et al., 2012). В іншому прикладі, білкова інженерія алкілгуанінової ДНК-алкилтрансферази шляхом введення петлі в активний центр дозволяє розпізнати збільшений O 6-модифікований гуаніновий субстрат, не прийнятий ферментом без вставки петлі (Heinis et al., 2006). У світлі цих висновків три вставки в зв'язуючий аденин N-кінцевий субдомен PINK1 змусили нас думати, що PINK1 також може виявляти змінену специфічність субстрату.
Розглядаючи можливість того, що нуклеотиди, крім АТФ, можуть бути субстратами для кіназ, ми помітили, що СК2 може використовувати кілька субстратів як фосфодонорів: ГТФ, а також АТФ, хоча його активність з ГТФ набагато нижча (Niefind et al., 1999) . Незважаючи на те, що еукаріотичні протеїнкінази приймають альтернативні субстрати в місці зв'язування АТФ, кінази, сконструйовані з єдиною мутацією до залишку воротаря, часто переносять аналоги АТФ із замінами в положенні N 6 (Liu et al., 1998; Shah et al. ., 1997). Важливо, що жодна з раніше вивчених нами кіназ дикого типу не продемонструвала здатності приймати модифіковані N 6 аналоги АТФ (Рисунок S1B).
Ми виявили, що, на відміну від будь-якої вивченої нами кінази, PINK1 приймає неосубстрат N 6 фурфурил АТФ (кінетин трифосфат або КТР) з більш високою каталітичною ефективністю, ніж його ендогенний субстрат АТФ. Ми також виявили, що метаболічний попередник цього нео-субстрату (кінетину) може бути зайнятий клітинами і перетворений у нуклеотидну трифосфатну форму, що призводить до прискореного відбору Паркіна до деполяризованих мітохондрій, зниження рухливості мітохондрій в аксонах та придушення апоптозу в похідні від людини нервові клітини, все в залежності від PINK1.
Результати
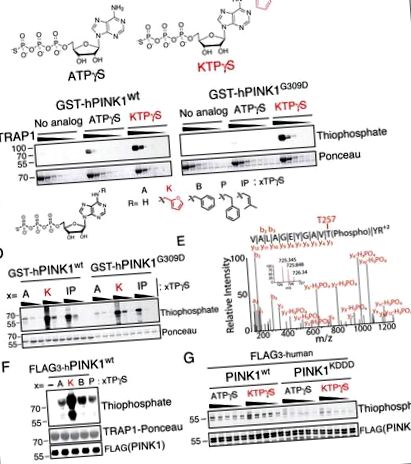
PINK1 приймає модифікований N6 аналог ATP-кінетину трифосфату (KTP)
Ми експресували як домінований кіназний домен PINK1 wt, так і PINK1 G309D GST (156–496PINK1) в E. coli (рис. S2A) та проводили аналізи кінази з низкою аналогів нео-субстрату. Як і слід було очікувати, PINK1 G309D демонстрував знижену активність з АТФ; що цікаво, однак, інкубація з N 6 фурфурил АТФ (кінетин трифосфат або KTP) (рис. 1А) призвела до підвищення рівня трансфосфорилювання мітохондріального шаперону hTRAP1 (залишки 60–704) (рис. 1В) та автофосфорилювання як з PINK1 G309D, так і з PINK1 (Рисунки 1C, D). Використовуючи стратегію захоплення та вивільнення фосфопептиду (Blethrow et al., 2008; Hertz et al., 2010), нам вдалося ідентифікувати сайт автофосфорилювання T257 (Kondapalli et al., 2012), використовуючи KTP як фосфо-донора для PINK1 ( Малюнок 1E), який показав, що цей нео-субстрат здатний підтримувати добросовісне фосфорилювання субстрату, залежного від PINK1.
(A) Хімічна структура кіназного субстрату аденозинтрифосфату з гамма-тіофосфатом (ATPγS) та нео-субстрату кінетину трифосфату гамма-тіофосфату (KTPγS).
(B – D) Аналіз кінази PINK1 (B), із субстратом 60–704TRAP1 (1 мг/мл зменшується на 1/3) та 500 мкМ зазначений нуклеотид (C) або (D), Тільки PINK1 (4,3 мкМ) 100, 200, 400 мкМ нуклеотид, аналізований за допомогою імуноблотингу на мічені тіофосфо TRAP1 та PINK1.
(E) Сайт автофосфорилювання PINK1, ідентифікований за допомогою специфічного захоплення пептидів, та LCMSMS, знайдений лише за допомогою PINK1 wt і KTPγS, що вказує на те, що цей нуклеотид використовується як добросовісний субстрат
(F) Вироблений SF21 PINK1 інкубували з 60–704TRAP1 та зазначеним нуклеотидом (структура показана на панелі C.) та аналізується як у (B – D)
(G) Аналіз кінази PINK1 із зазначеним нуклеотидом (від 250 до 1250 мкМ з кроком в 250 мкМ), аналізований як у (B – D) виявляє значно знижену активність фосфорилювання з PINK1 KDDD (смуги 11–20), посилене аутофосфорилювання спостерігалося у нео-субстрату KTPγS над ендогенним субстратом ATPγS.
Оскільки KTP повинен був би конкурувати з мілімолярними внутрішньоклітинними концентраціями АТФ, щоб функціонувати, ми провели конкурентний аналіз з γ-тіофосфатом, міченим KTP, проти ATP. Ми виявили, що сигнал KTPγS зберігався навіть тоді, коли АТФ був у 4 рази більшою концентрацією, ніж KTPγS (2 мМ проти 0,5 мМ) (Рисунок S2H), що припускає, що PINK1 може активуватися KTP у присутності клітинного АТФ.
KTP виробляється в клітинах людини при обробці кінетином-попередником KTP
Наші результати, що показують збільшення in vitro активності PINK1 за допомогою KTP, змусили нас дослідити здатність досягти посиленої активності PINK1 у клітинах. Однією з основних проблем активації PINK1 в клітинах є те, що аналоги АТФ, такі як KTP, не пропускають мембрану; однак попередня робота показала, що певні цитокініни можуть поглинатися клітинами людини і перетворюватися в нуклеотидну трифосфатну форму (Ishii et al., 2003). Крім того, нещодавня робота в клітинах, що експресують гіпоморфні мутантні алелі CDK2, показала, що активність CDK2 може бути підвищена в клітинах, забезпечуючи аналогичні попередники нуклеотидів, які можуть бути перетворені в нуклеотидну трифосфатну форму і здатні вписуватися в гіпоморфний активний сайт CDK2 (Merrick et al., 2011).
Першим етапом біоконверсії є рибозилювання цитокініну до 5'-монофосфатної форми, яка може бути опосередкована аденін фосфо рибозилтрансферазою (APRT) (Kornberg et al., 1955; Lieberman et al., 1955b) (Рисунок 2A). Дотримуючись встановлених протоколів (Parkin et al., 1984), ми інкубували аденин, кінетин або негативний контроль N 9-метил-кінетин (9MK) з 5'-фосфорибозилпірофосфатом (PRPP) та APRT та аналізували реакцію за допомогою LCMS (рис. 2B). . Аденин швидко перетворюється на АМФ, досягаючи майже повної конверсії (84%) через 10 хвилин часу реакції; перетворення кінетину в KMP (Малюнок 2B, C) було помітно повільнішим, що вимагало 150 хвилин для перетворення половини. Контрольна сполука 9MK не перетворюється на KMP навіть після 16 годин інкубації (Малюнок 2B), тоді як кінетин повністю перетворювався на KMP за цей проміжок часу. Цей експеримент продемонстрував, що рибозилювання кінетину біосинтетично можливо за допомогою ферментативного шляху виробництва АМФ.
(A) Схема реакції рибозилювання кінетину до KMP через APRT та PRPP з наступним клітинним перетворенням у KTP.
(B) LCMS-аналіз виробництва або AMP (аденин), або KMP (кінетин та 9MK) за допомогою LCMS-аналізу показує, що кінетин може піддаватися APRT-опосередкованому рибозилюванню до KMP, але N 9-метил-кінетин не може.
(C) LCMS-аналіз реакції кінетину; основний пік являє собою KMP + H пік при 428,3 м/з.
(D) ВЕРХ-аналіз стандартів (ADP, GTP, ATP, KDP, KTP, BTP) або клітинний лізат DMSO або кінетину, оброблених клітинами HeLa з додаванням 250 мкМ BTP *, виявляє новий пік, присутній у клітинах, оброблених кінетином, за 31,39 хв.
(E) Спектр поглинання піку на 31,39 хв у клітинах, оброблених кінетином, порівняно із спектром поглинання КТР у стандартному.
(F) Масштаб ВЕРХ-аналізу DMSO або лізету клітин, оброблених кінетином з додаванням BTP, або лізату клітин кінетину з додаванням BTP і додаванням KTP виявляє збільшення піку, який спільно елююється з KTP (186%), де BTP зменшується до 76% від початкової площі припускаючи, що піком є KTP.
(G) Імуноблот-аналіз із зазначеними антитілами для фосфорилювання на серині 62 Bcl-xL виявляє збільшення після лікування кінетином.
Таблиця 1
Виміряна концентрація нуклеотидів у лізатах клітин HeLa. Див. Також Рисунок 2 і Рисунок S3
- Надутий гузовий гупі - Питання про годування та голодування хвороби прісноводних риб та риб
- 10 прихованих функцій програми Activity, які піднімуть вашу фізичну форму на новий рівень
- Про нас - Лікування серцевих захворювань
- 5 основних проблем харчування дітей дошкільного віку
- Діяльність; Bellabeat