М’який негідротермальний синтез олігосахаридів, покритих наночастинками магнітного оксиду заліза до 5 нм із подвійним ефектом підсилення контрасту МРТ
Цзин Хуан
кафедра радіології та візуалізації наук, Медична школа Університету Еморі, Атланта, штат Джорджія, 30322, США
Лія Ван
кафедра радіології та візуалізації наук, Медична школа Університету Еморі, Атланта, штат Джорджія, 30322, США
Сяодун Чжун
b MR R & D Collaborations, Siemens Healthcare, Атланта, Джорджія 30322, США
Юаньчен Лі
кафедра радіології та візуалізації наук, Медична школа Університету Еморі, Атланта, штат Джорджія, 30322, США
Лілі Ян
c Хірургічний факультет Медичної школи університету Еморі, Атланта, штат Джорджія, 30322, США
Хуей Мао
кафедра радіології та візуалізації наук, Медична школа Університету Еморі, Атланта, штат Джорджія, 30322, США
Пов’язані дані
Анотація
Надзвичайно тонкі наночастинки магнітного оксиду заліза до 5 нм, покриті олігосахаридами (SIO) з подвійним зваженим ефектом посилення контрасту T1-T2 та швидким кліренсом, розроблені як контрастна речовина для магнітно-резонансної томографії (МРТ). Відмінна розчинність у воді, біосумісність та висока стабільність таких наночастинок SIO до 5 нм були досягнуті за допомогою методу покриття “in-situ полімеризація”, який дозволяє олігосахариди, що утворюють глюкозу, безпосередньо на поверхні гідрофобних нанокристалів оксиду заліза. Повідомлені ультрадисперсні наночастинки SIO демонструють поздовжню релаксивність (r1) 4,1 мМ -1 s -1 і співвідношення r1/r2 0,25 при 3 T (напруженість клінічного поля), що робить покращений T1 або "яскравіше" посилення контрасту в T1-зваженому МРТ на додаток до типового Т2 або контрасту "затемнення" звичайних наночастинок оксиду заліза. Такий подвійний контрастний ефект може бути продемонстрований на візуалізації печінки з контрастом "затемнення" Т2 в паренхімі печінки, але "яскравим" контрастом Т1 у судинній печінці. Що ще важливіше, цей новий клас ультрадисперсних наночастинок оксиду заліза до 5 нм показав набагато швидший кліренс тіла, ніж ті, що мають більші розміри, обіцяючи кращу безпеку для клінічних застосувань.
1. Вступ
На сьогодні для МРТ розроблено різні форми IONP, з яких FDA схвалили лише два засоби (Feridex ®, Resovist ®), розроблені з декстрановим покриттям, для клінічного використання. 12 Обидва мають середній розмір серцевини понад 5 нм і загальний розмір 60–150 нм. 5, 13 Частинки з таким загальним розміром швидко затримуються в органах системи ретокулоендотелію (ВДЕ) і можуть зайняти кілька тижнів або навіть місяців, щоб деградувати і очиститись від організму. 14 Повільний кліренс не тільки викликає занепокоєння щодо довгострокових побічних ефектів таких ІОНП, але також обмежує їх повторне використання в дослідженнях поздовжньої візуалізації. Більше того, більший загальний розмір заважає IONP підтримувати властивості покращення контрасту T1. 15, 16
Тут ми повідомляємо про новий клас ультрадисперсних наночастинок оксиду заліза із покриттям олігосахаридів (SIO-3, середній розмір серцевини 3,5 нм), приготованих шляхом полімеризації глюкози на поверхні частинок in-situ. Повідомлений суб-5 нм SIO-3 є високостійким у водному розчині та демонструє покращене співвідношення r1/r2 у порівнянні з IONP із більшими загальними розмірами, що призводить до чудового підвищення контрастності МРТ T1 та нового подвійного контрастного ефекту T1-T2 для нових застосувань. Крім того, SIO-3 продемонстрував скорочений час очищення організму з частковою нирковою секрецією порівняно з ІОНП більших розмірів, отже, обіцяє вирішити тривалу стурбованість можливою довгостроковою токсичністю, пов’язаною з ІОНП.
2. Експериментальний розділ
Синтез гідрофобних наночастинок оксиду заліза (IONP)
Гідрофобні наночастинки оксиду заліза синтезували терморозкладанням. Коротко кажучи, олеат заліза (III) вперше був приготований модифікованим опублікованим способом. 20 Як правило, 4,04 г нітриду заліза (10 ммоль) та 9,13 г олеату натрію (30 ммоль) розчиняють у розчиннику, змішаному з 40 мл дистильованої води, 50 мл гексану та 10 мл абсолютного етанолу. Суміш олеату заліза перемішували при кімнатній температурі протягом 4 годин і потім витримували протягом ночі. Отриманий червоно-буруватий шар гексану використовували як джерело заліза для терморозкладу. У типовій реакції 5 мл олеату заліза змішували з 5 мл 1-октадецену при кімнатній температурі та дегазували надвисоким аргоном протягом 20 хв. Після випаровування гексану при 70 ° C реакційну суміш нагрівали до 320 ° C зі швидкістю нагрівання 0,6 ° C · s -1. Час реакції регулювали для контролю розміру IONP, який становив близько 5 хв для IONP з розміром ядра 3,5 нм, і нагрівав приблизно 10, 15, 20, 30 хв для IONP з ядром 4,8, 9,9, 15,6, 19,9 нм розмір. Після охолодження до кімнатної температури додавали етанол для осадження наночастинок. Продукти збирали центрифугуванням і кілька разів промивали гексаном і етанолом.
Синтез наночастинок оксиду заліза (SIO), покритих олігосахаридом
Олігосахаридне покриття було введено на гідрофобні ІОНП методом полімеризації in situ. Коротко кажучи, покриті олеїновою кислотою IONP повторно диспергували у хлороформі після очищення центрифугуванням та обережно додавали по краплях у попередньо нагрітий розчин глюкози в диметилформаміді (DMF). Суміш нагрівали до 120 ° С і витримували при цій температурі протягом 2,5 годин. Після охолодження до кімнатної температури продукт осаджували додаванням етанолу. Осад промивали і кілька разів центрифугували. Кінцевий продукт збирали та повторно диспергували у дистильованій воді для інших характеристик та застосування.
Характеристика наночастинок SIO
Морфологію та розмір наночастинок SIO вивчали за допомогою просвічуючого електронного мікроскопа (ТЕМ, Hitachi H-7500, прискорювальна напруга 75 кВ). Як правило, зразки ТЕМ готують шляхом опускання розведених розчинів наночастинок на мідну сітку з вуглецевим покриттям і сушать на повітрі. Гідродинамічний розмір і поверхневі заряди наночастинок у водному розчині оцінювали за допомогою приладу динамічного розсіяння світла (DLS) (Malvern Zeta Sizer Nano S-90), оснащеного He-Ne-лазером потужністю 22 мВт, що працює при 632,8 нм. Структурний аналіз наночастинок SIO проводили за допомогою порошкової дифракції рентгенівських променів (XRD, порошковий дифрактометр Bruker D8 DIFFRAC, Co Kα). Для вивчення покриття наночастинок спектри інфрачервоної спектроскопії з перетворенням Фур'є (FTIR) були зібрані на спектрометрі PerkinElmer Spectrum 100 FT-IR (Bucks, Великобританія). Спектри поглинання УФ-візу отримували за допомогою скануючого спектрофотометра (Shimadzu UV-2401PC) з шириною щілини 1,0 нм.
Вимірювання часу релаксації та обчислення релаксивності
Для оцінки можливості посилення контрастності МРТ розчини SIO з різними концентраціями досліджували за допомогою МР-сканера 3T (Magnetom Tim Trio, Siemens Medical Solutions, Ерланген, Німеччина) з використанням T1- і T2-зважених послідовностей швидкого спінового ехо-сигналу, інверсійного відновлення турбо-спінової ехо-послідовності і багатоехо-Т2-зважена послідовність спінових ехо-сигналів. Для порівняння ефекту посилення контрастності МРТ використовували комерційну контрастну речовину для підсилення Т1 Multihance ® (Gd-BOPTA). Кожну пробу готували з концентрацією Fe або Gd, що варіювалась від 0,004 до 40 мМ. Для вимірювання часу поздовжньої релаксації T1 для отримання зображень використовували послідовність інверсійного відновного турбоспінового ехо (TSE) з довжиною ехо-сигналу (ETL) 3, часом ехо (TE) 13 мс і часом повторення (TR) 1500 мс при різному часі інверсії (TI) 23, 46, 92, 184, 368, 650, 850, 1100 та 1400 мс відповідно. Для вимірювання часу поперечної релаксації T2 використовували послідовність багатоехового спінового відлуння з TR 2400 мс та 15 TEs, починаючи з 11 мс з кроком 11 мс. Для зразків кожної концентрації вимірювали інтенсивність сигналу (SI) кожного регіону інтересу (ROI) при різних TI або TE.
МРТ мишей, яким вводять наночастинки SIO
Всі експерименти на тваринах проводились згідно протоколу, затвердженого Інституційним комітетом з догляду та використання тварин (IACUC). Мишей BALB/c знеболювали шляхом внутрішньочеревної ін'єкції кетамін-ксилазинової суміші (95: 5 мг/кг). Розчин фізіологічного розчину SIO-3 внутрішньовенно вводили у дозі 2,5 та 10 мг Fe на кг ваги миші. Для порівняння, Gd-BOPTA та SIO-20 (розмір ядра 20 нм) вводили у дозі 2,5 мг/кг та 0,2 ммоль/кг відповідно. Придушені жиром Т1-зважені спінові ехо-зображення були отримані для дослідження змін контрасту в різних органах та анатомічних структурах, таких як печінка, нирки та клубові артерії, у різні моменти часу. Параметри зображення включали: TR) = 724 мс, TE = 10 мс, матриця = 320 × 134, поле зору (FOV) = 120 × 60 мм 2, кут перекидання = 70 і товщина зрізу = 1,00 мм. Відношення сигнал/шум (SNR) розраховували за рівнянням: SNR = SImean/SDnoise. Відносне посилення контрасту в різні моменти часу було визначено як зменшення сигналу ΔSNR = (SNRpre − SNRpost)/SNRpre. Відношення контрасту до шуму між паренхімою печінки та судинною системою розраховували як CNR = (SNRpost (судинна система) −SNRpost (паренхіма печінки))/SNRpre (паренхіма печінки).
Очищення тіла наночастинок SIO у мишей
3. Результати та обговорення
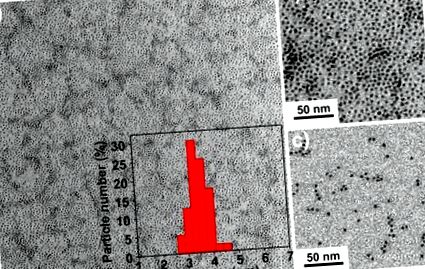
(a) Мале збільшення та (b) зображення ТЕМ із великим збільшенням гідрофобних IONP розміром 3,5 нм (IO-3). Вставка (а) - це розподіл за розміром після вимірювання 100 частинок. (c) ТЕМ-зображення гідрофільних IONP, покритих олігосахаридами (SIO-3).
Порошкові рентгенограми (XRD) IO-3 та SIO-3 були показані на малюнку 2а. Розширені дифракційні піки спостерігалися для обох зразків завдяки кристалам ультрфінового нанорозміру. Розширені дифракційні піки стали чіткішими після нанесення покриття завдяки перестановці нахиленої поверхні в процесі нагрівання. 31 Однак розмір зерен мало змінювався відповідно до половинної ширини дифракційних піків. Обидва піки XRD IONP до і після покриття були віднесені до спінальної магнетитової або маггемітової структури. Утворення покриття олігосахаридів на поверхні ІОНП було додатково підтверджено інфрачервоною спектроскопією Фур'є-Трансформа (FTIR) (рис. 2b). Характерні смуги олеїнової кислоти, включаючи розтягнення СН (2923, 2852 см -1), вигин СН2 (1457, 1375 см -1) та розтягування С = О (1540 см -1), ослаблені після заміни олігосахаридами на поверхні. Виникла різка смуга C = C при 1653 см -1 свідчила про наявність ароматичних структур олігосахаридів на поверхні частинок. 32, 33
(a) Порошковий XRD-малюнок та (b) FTIR-спектри IO-3 та SIO-3. (c) Моніторинг стадії реакції викидом FL. Врізка (c) - це фотографії реакційної суміші, зібраної за різного часу реакції при нормальному світлі (ліворуч) та 365 нм УФ-світлі (праворуч). (d) Фазовий перехід ІОНП з розчинника від органічної фази гексану до водного розчину з часом.
Слід зазначити, що температура, яку ми використовували для полімеризації глюкози in-situ на поверхні наночастинок, значно нижча (
Ефекти посилення контрастності МРТ при СІО досліджували в клінічно значущому магнітному полі (3 Т). На рис. 3а і b показано Т1- і Т2-зважені МР-зображення водних розчинів SIO з різною концентрацією Fe. SIO-3 демонструє найвищий коефіцієнт контрастності T1, тоді як SIO-20 демонструє найвищий коефіцієнт контрастності T2. Це спостереження очікується, оскільки SIO-3 має найвище відношення поверхні до об’єму завдяки надтонкому розміру. Вважається, що для контрастних речовин з наночастинками посилення контрасту Т1 головним чином сприяє релаксивності внутрішньої сфери, яка походить від прямої координації між молекулами води та магнітними іонами на поверхні частинок. 5, 27, 39 Високе відношення поверхні до об'єму в поєднанні тонкого гідратованого шару покриття олігосахаридів для SIO-3 полегшить взаємодію молекул води з внутрішнім шаром.
(a) T1- та (b) зважені за T2 МР-зображення розчинів SIO з різними концентраціями, а відповідне значення (c) r1 та d) r2 змінюється із розміром частинок.
Для подальшої оцінки ефективності посилення контрастності та поведінки SIO ми розрахували профіль інтенсивності сигналу контрастної речовини (рис. 4а, b), використовуючи рівняння, що описує еволюцію інтенсивності сигналу (SI) із зваженої за Т1 послідовності спінового відлуння. Враховуючи однакову концентрацію Fe (тобто 1 мМ) та параметри отримання зображення (тобто TR = 500 мс, TE = 12 мс), як правило, використовувану для Т1-зваженого спінового ехо-МРТ, найвищий контраст T1, тобто найяскравіший сигнал, для заданий r1 можна отримати лише тоді, коли r2 досягне нуля. Крім того, SI є більш чутливим до зміни r2, ніж у r1 для контрастних речовин з r1, більшим ніж 4,5 мМ -1 с -1. Наприклад, хоча SIO-3 має нижчий рівень r1, він має набагато вищу ефективність підвищення T1, ніж SIO-20 через більш різке зменшення рівня r2.
(a) Прогнозування SI на Т1-зважених МР-зображеннях, визначених r1 та r2, і (b) вид зверху. (c) Максимальний SI кожного рішення SIO, що стосується співвідношення r1/r2. (d) співвідношення r1/r2 змінюється з гідродинамічними розмірами.
Ранні дослідження припустили, що відношення r1/r2 може диктувати властивості посилення контрасту T1 магнітних нанозондів. 5, 16 Збільшення максимального СІ на Т1-зважених МР-зображеннях спостерігалось із збільшенням співвідношення r1/r2, як показано на малюнку 4c. Теоретично досліджено, що відношення r1/r2 монотонно зростає щодо часу поступальної дифузії τD, 24, що пов'язано з радіусом ІОНП, водопроникністю шару покриття та товщиною покриття. Не дивно, що SIO-3 має найвищий коефіцієнт r1/r2 0,25 порівняно з аналогами різних розмірів (Рисунок 4г).
Оскільки більшість наночастинок T1-контрастних речовин, про які повідомлялось до цього часу, мають r1 більше 4,5 мМ -1 s с −1, але також істотно високий r2, 16, однією альтернативною стратегією майбутнього розвитку магнітно-магнітно-томографічних контрастних речовин, зважених на основі Т1, є ослаблення r2, тоді як спроба збільшити r1. Наприклад, магнітний катіон з неспареними електронами (наприклад, Mn 2+, Gd 3+) було введено в наноструктури оксиду заліза для збільшення r1, таким чином для реалізації позитивного посилення контрасту. 6, 42, 44 Незалежно від токсичності металів, легування Gd може розглядатися як більш ефективний спосіб через більш незначне збільшення r2. 6 Більше того, зменшення r2 може дозволити збільшенню концентрації IONP для посилення T1 SI, що часто порушується при вищих концентраціях IONP.
Знижені жиром Т1-зважені МР-зображення мишей до та після введення SIO-3 у дозі 10 мг/кг. Позитивне посилення контрасту спостерігали в серці, селезінці (червоне пунктирне коло), нирках (зелене пунктирне коло) та судинах печінки.
- Повна стаття Термодинамічна оцінка відновлення частинок руди оксиду заліза у високому
- Зшитий полі (етиленоксид) для систем вивільнення лікарських засобів - Панайотов - 1996 - Макромолекула
- Випадіння волосся, темні кола під очима, лущення нігтів, які потрібні вам заліза - розумні рішення від Lorna
- Китайський новий знімний магнітотерапевтичний масажний обруч Hula Hoop з прищами - Китайський масажний обруч Hula Hoop
- Доппельгерц активний залізо життєво важливий - Охорона здоров’я - Здоров’я; Краса