Мілдронат покращує пізнання та зменшує патологію амілоїд-β у трансгенних мишей із хворобою Альцгеймера
Ульріка Бейтнере
1 Кафедра фармакології медичного факультету Латвійського університету, Рига, Латвія
Томас ван Грін
2 Відділ клітинної, розвитку та інтегративної біології, Університет Алабами в Бірмінгемі, Бірмінгем, Алабама
Ашиш Кумар
2 Відділ клітинної, розвивальної та інтегративної біології, Університет Алабами в Бірмінгемі, Бірмінгем, Алабама
Байба Янсоне
1 Кафедра фармакології медичного факультету Латвійського університету, Рига, Латвія
Вія Клуса
1 Кафедра фармакології медичного факультету Латвійського університету, Рига, Латвія
Інга Кадіш
2 Відділ клітинної, розвивальної та інтегративної біології, Університет Алабами в Бірмінгемі, Бірмінгем, Алабама
Анотація
Раніше було показано, що мілдронат, ліки, що містять карнітин, забезпечує нейропротекцію в індукованій азидотимідином мишачої моделі нейротоксичності та на моделі щурів хвороби Паркінсона. Метою цього дослідження було дослідити вплив лікування мілдронатом на когніцію та патологію у мишей-моделей хвороби Альцгеймера (AD) (APPSweDI). Мілдронат вводили внутрішньовенно. щодня по 50 або 100 мг/кг протягом 28 днів. В кінці лікування тварини проходили поведінкові та когнітивні тести, а мозок оцінювали на патологію, пов’язану з АД, запалення, синаптичні маркери та ацетилхолінотеразу (AChE). Дані показують, що лікування мілдронатом значно покращувало продуктивність тварин у водному лабіринті та тести соціального розпізнавання, знижувало відкладення амілоїду β в гіпокампі, збільшувало експресію маркера мікроглії Iba-1 та зменшувало фарбування AChE, хоча це не змінювало експресію білків бере участь у синаптичній пластичності (GAP-43, синаптофізин та GAD67). У сукупності ці висновки вказують на здатність мілдронату покращувати пізнання та зменшувати патологію амілоїд-β на мишачій моделі АД та його можливу терапевтичну користь як препарату, що модифікує захворювання у хворих на АД.
Хвороба Альцгеймера (БА) пов’язана із зниженням когнітивних функцій, що призводить до функціональних порушень та втрати незалежності. Широко визнано, що АД представляє виклик для суспільства та медичних працівників (Wimo et al., 2011). Отже, необхідність у розробці ефективних методів лікування для лікування та/або відстрочки початку цієї хвороби залишається нагальною.
Двома патологічними ознаками мозку АД є позаклітинне накопичення амілоїд-β-пептиду (Aβ) у невритичних бляшках та внутрішньоклітинні нейрофібрилярні клубки, що складаються з гіперфосфорильованого білка тау (Karran et al., 2011). Крім того, спостерігається зменшення кількості нейронів, особливо в гіпокампі та енторіальній корі (Lippa et al., 1992; West et al., 1994) та синапсах (Terry et al., 1991), при цьому нейрохімічні зміни впливають на холінергічні шляхи (Craig et al., 2011). Крім того, запальні процеси та дисфункція мітохондрій можуть відігравати важливу роль у прогресуванні захворювання (Ballard et al., 2011).
В даний час існуючі препарати від Альцгеймера надають деякі симптоматичні переваги протягом 12 місяців, але досі відсутні засоби, що модифікують захворювання (Corbett et al., 2012). Нещодавно невдачі численних нових методів модифікації захворювань у клінічних випробуваннях вказують на те, що додаткова стратегія, що базується на репозиції лікарських засобів, схвалених для інших показань, може бути більш перспективною. Репозиціонування лікарських засобів - це застосування встановлених лікарських сполук до нових терапевтичних показань і було основою успішних методів терапії (Hubsher et al., 2012), особливо завдяки їх встановленим записам безпеки, що є важливою перевагою перед новими сполуками (Ashburn and Thor, 2004).
У цьому дослідженні вперше досліджено дію мілдронату на трансгенних AD мишей APPSweDI. Ці миші експресують людський амілоїдний білок-попередник (APP) із шведською, голландською та айовською мутаціями на фоні C57BL/6. Ця модель миші розвиває раннє та надійне накопичення β у мозку з високим зв’язком з мозковими мікросудинами, а також розвиває ранні когнітивні дефіцити (Davis et al., 2004). Ми тестували мишей у різних поведінкових (відкрите поле, нульовий лабіринт) та когнітивних (соціальне визнання та водний лабіринт) завданнях. Крім того, патологію АД оцінювали в гіпокампі імуногістохімічно та вестерн-блот. Патологію AD оцінювали на вміст Aβ, GFAP, Iba-1, глутаматдекарбоксилази 67 (GAD67), білка, пов’язаного з ростом 43 (GAP-43), синаптофізину та ацетилхолін-терази (AChE). 28-денне лікування мілдронатом суттєво покращило когнітивні показники у водному лабіринті та завдання соціального розпізнавання та знизило патологію Aβ та експресію AChE.
МАТЕРІАЛИ І МЕТОДИ
Тварини
Оригінальні миші Tg APPSweDI були отримані від доктора Ван Ностранда (SUNY Stony Brook, Stony Brook, NY) і містяться на місцях у колонії. Для цього дослідження ми використовували три групи самок мишей віком 4 місяці (n = 36). Тварин утримували по п’ять кліток у контрольованому середовищі в Університеті Алабами в Бірмінгемському центрі догляду за тваринами (температура 22 ° C, вологість 50–60%, з 12-годинним циклом світло/темрява); їжа та вода були доступні за бажанням. Всі зусилля були докладені для мінімізації страждань тварин та зменшення кількості використовуваних тварин. Експерименти проводились відповідно до місцевих керівних принципів Комітету з догляду та використання тварин (IACUC).
Хімікати
Мілдронат [3- (2,2,2-триметилгідразіній) пропіонат дигідрат] був отриманий від Акціонерного товариства «Гріндекс» (Рига, Латвія), розчинений у фізіологічному розчині та приготований у вигляді 1% -ного маточного розчину.
Експериментальний дизайн
Мишей рандомізували в одну з трьох експериментальних груп, що відповідають вазі (n = 12/група); середня вага становила 21 ± 2 г; і мілдронат у дозах 50 мг/кг (група М50) або 100 мг/кг (група М100) або контроль (фізіологічний розчин) вводили внутрішньочеревно (внутрішньочеревно) щодня протягом 28 днів. Через два тижні після початку лікування тварин тестували за двома поведінковими завданнями, тобто тестом на відкритому полі та нульовим лабіринтом. Протягом наступного тижня вони проходили тести на соціальне визнання та тести на водний лабіринт. По закінченні поведінкових тестів, тобто через 4 тижні після початку лікування, тварин забивали для гістопатологічного та біохімічного аналізу.
Мишей глибоко знеболювали і жертвували закаркальною перфузією холодним сольовим розчином. Мозок видаляли відразу після обезголовлення і розрізали навпіл у сагітальній площині. Ліву півкулю розсікали на чотири частини (ростральна кора, каудальна кора, гіпокамп та середній мозок/стовбур мозку) і зберігали при -80 ° C для аналізу Вестерн-блот (WB). Праву півкулю занурення зафіксували у 4% параформальдегіді протягом 24 годин, кріозахистили в 30% сахарозі в 0,1 М фосфатному буфері протягом додаткових 24 годин і зберігали в розчині антифризу при −20 ° C до часу секціонування.
Поведінкова та когнітивна оцінка
Коротко, тест на відкритому полі та нульовий лабіринт використовували для оцінки руху, пошукової діяльності та тривоги. Соціальне визнання та тест на водний лабіринт використовувались для вимірювання когнітивних здібностей тварин. Тварин виводили на арену і спостерігали за ними за допомогою камерної системи відстеження, тобто Ethovision (Noldus, Нідерланди). Лабіринт відкритого поля - це арена площею 42 на 42 см із чіткими граніними оргсклом (висота 20 см). Арена поділяється на дві зони, відкриту центральну зону та бік біля стіни. Цей тест вимірює активність та тривожність, тобто час, проведений у „відкритому” центрі проти „безпечної” сторони. Нульовий лабіринт складається з кругового лабіринту (діаметром 70 см), який піднімається на 40 см над столом і розділений на чотири рівні частини. Дві частини мають сторони з непрозорого матеріалу висотою 15 см, а дві частини мають лише стінку висотою 0,5 см, тобто дві відкриті зони та дві закриті зони. Тест вимірює тривожність у тварини; тобто скільки часу тварина проводить у відкритих проти закритих, «безпечних» зонах?
Соціальне визнання тестували у прямокутній трикамерній коробці з прозорого полікарбонату. Кількісна оцінка записів та тривалості в камерах автоматично реєструвалася протягом 10 хв у перший день та протягом 4 хв у другий день. Тваринами, що використовувались в якості досліджуваних, були миші-самці C57BL6, яких поміщали під дротяну чашку в кожній бічній камері. Першого дня під дротяними чашками на арені були присутні дві «миші»-миші; наступного дня під дротяними чашками були присутні одна із “старих” мишей та “нова” миша. Проведені вимірювання включали час, проведений у кожній камері, час, витрачений на обнюхування кожної випробовуваної миші, і кількість записів у випробувальні камери.
Наша версія водного лабіринту складалася з блакитного кругового резервуару з чистою водою (23 ° C ± 1 ° C). Під час тесту на водний лабіринт мишей тренували протягом трьох 60-секундних випробувань на день, щоб плавати з однієї з трьох вихідних точок басейну, щоб знайти нерухому, приховану платформу, занурену під воду (0,5 см) в одному з квадрантів басейну. Якщо тварина не знаходила платформу протягом цього часу, експериментатор клав її на неї і залишав там на 10 сек. Після того, як миша вивчила завдання (день 5, випробування 15), на день 8 було проведено випробування зонда. Під час випробування зонда (тобто випробування 16) платформа була вилучена з басейну, і тваринам було дозволено плавати протягом 60 сек. Миші з цілісною функцією пам'яті зазвичай залишаються шукати набагато довший час у “правильному” квадранті, тоді як миші з порушеннями досліджують більш рівномірно серед чотирьох квадрантів. Всі поведінкові тести проводила особа, яка була засліплена для груп лікування тварин. Дані аналізували за допомогою одностороннього дослідження ANOVA та проводили посттест багаторазових порівнянь Бонферроні для визначення джерела значущого основного ефекту або взаємодії.
Імуногістохімія
Кількісна оцінка
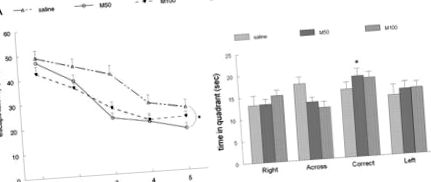
Три лінійні графіки, що показують криві навчання трьох груп мишей. A: Середня щоденна продуктивність у водному лабіринті; на 5-й день група М50 (50 мг/кг мілдронату) знайшла знахідну платформу в значній мірі (* P Рис. 3. AA, B). Подібним чином спостерігалося значне зменшення відкладення Aβ у зубчастій звивині у групі M50 (M50 проти сольового розчину; P Рис. 3. AA, B). Середня щільність у групах була фізіологічним розчином 174,4 ± 2,3, M50 183,2 ± 1,5, M100 186,6 ± 1,9, при цьому суттєва різниця між групами M50 та фізіологічним розчином (P Рис. 3. AA, B) не показала суттєвих відмінностей серед групи із середньою щільністю експресії GFAP (фізіологічний розчин 179,3 ± 2,4, M50 173,5 ± 1,6, M100 176,9 ± 1,6). Також не було значущої різниці між середньою щільністю фарбування AChE, виміряною в радіусному шарі (фізіологічний розчин 174,5 ± 2,0, M50 165,7 ± 3,9, M100 169,5 ± 3,4) в гіпокампі. Однак середня щільність фарбування для AChE у пірамідальному шарі була достовірно (P Рис. 3. AA, B).
Аналіз СБ
Щоб зрозуміти молекулярну основу, яка призвела до поліпшення когнітивних функцій, було проведено аналіз WB для GAD67, синаптофізину та GAP43. Аналіз СБ не виявив суттєвих змін між сольовим розчином та групами лікування в жодному з цих білків (рис. 4).
Репрезентативні вестерн-плями гомогенатів гіпокампа з фізіологічного розчину (sal) -, M50 (50 мг/кг мілдронату) - та оброблених M100 (100 mg/kg мілдронату) мишей, забарвлених на GAD67, GAP43, син-аптофізин та α-тубулін. Не було значущих відмінностей у жодному з цих маркерів між фізіологічним розчином та групами лікування.
ОБГОВОРЕННЯ
Основною метою цього дослідження було оцінити, чи зможе мілдронат покращити пізнання у трансгенних мишей APPSweDI та полегшити патологію мозку. Раціон елю для проведення такого дослідження полягав у тому, що раніше мілдронат демонстрував властивості, що покращують пам’ять; аналогічним чином було показано, що воно сприяє проліферації нейрональних клітин-попередників та посилює експресію синаптичного білка (Klusa et al., 2013). Лікування мілдронатом знижувало експресію білка, пов’язану із запаленням та апоптозом, але збільшувало експресію ендогенного шаперону Hsp70 на моделі щурів хвороби Паркінсона (Isajevs et al., 2011) та на моделі нейротоксичності азидотимідину у мишей (Pupure et al., 2010).
Подібним чином, у трансгенних мишей, які надмірно експресували лише трансген APP, після лікування ібупрофеном було виявлено зменшену кількість бляшок та знижений рівень маркерів запалення IL-1β та GFAP (Lim et al., 2000). У нашому дослідженні мілдронат не впливав на експресію GFAP. Однак можливо, що порівняно великі коливання щільності фарбування для GFAP між тваринами заважали нам побачити будь-які суттєві відмінності між групами.
Мілдронат не змінив рівні жодного із виміряних нами маркерів синаптичної пластичності (тобто GAP-43, синаптофізину та GAD67). Швидше за все, суттєвих змін не відбулося, оскільки вестерн-блот проводився на всьому гіпокампі, а зміни, виміряні в імуногістохімії, були наявні лише на окремих частинах областей гіпокампу, наприклад, на пластових орієнтах CA1 або пластовому пірамідалі CA1.
Дисрегульована холінергічна сигналізація є ранньою ознакою АД і спричинена втратою холінергічних нейронів, ймовірно, через накопичення Aβ в гіпокампі (Craig et al., 2011). Фермент AChE відповідає за розпад ацетилхоліну в нейрональному синапсі і відіграє важливу роль у синаптичній передачі. Блокування активності цього ферменту було першим підходом для полегшення дефіциту пам’яті при БА (Martorana et al., 2010). У нашому дослідженні мілдронат впливав на рівень AChE лише в зоні CA1 у мишей, які отримували M50, але не в групі M100. Однак це корелює із покращеним пізнанням у цій групі порівняно з групою М100. Зменшення експресії AChE в зоні CA1, ймовірно, спричиняє більш високий рівень ацетилхоліну, а отже, і кращого функціонування області CA1 у просторовому навчанні та пам’яті, на що вказує суттєво покращена робота у водному лабіринті у групі M50. Подібним чином, раніше у крис, оброблених мілдронатом, було виявлено зменшену кількість AChE-позитивних нервових волокон, що покращило їх ефективність у тесті на умовну реакцію уникання (CAR) (Klusa et al., 2013).
В якості альтернативи можна уявити, що мілдронат діє за допомогою інших шляхів для поліпшення когнітивних здібностей у мишей-моделей AD. Однією з можливостей є те, що мілдронат посилює мозковий кровотік, і таким чином покращує розчинний розчин Aβ з мозку. На підтвердження цієї концепції служать дані Sjakste et al. (2005), які припускають, що ефекти мілдронату на ЦНС можуть бути опосередковані стимулюванням вироблення NO в судинному ендотелії шляхом модифікації γ-бутиробетаїну та його ефірних пулів.
Інша можливість полягає в тому, що мілдронат впливає на вітамінну мережу. Нещодавно було продемонстровано, що L-карнітин та його метаболіт ацетил-L-карнітин є нейропротекторними завдяки активації горметичних шляхів, включаючи вітагени (Calabrese et al., 2012). Ми вказуємо на структурну схожість карнітину та мілдронату, змушуючи розглядати останні як аналог карнітину. Крім того, варто відзначити здатність мілдронату стимулювати експресію HSP70 у стриатумі 6-OHDA та чорній речовині (Isajevs et al., 2011). Vita-гени кодують білки теплового шоку, і нейропротекторну дію можна пояснити, принаймні частково, через активацію стресової реакції та горметичних шляхів. Однак ми не маємо даних про те, (чи як) мілдронат регулює систему HSP у тварин моделі AD, але можна очікувати подібного ефекту, викликаного ацетил-L-карнітином, який підвищує регуляцію HSP та захищає нейрони кори від окислювача, опосередкованого Aβ42. стрес та нейротоксичність (Абдул та ін., 2006).
Враховуючи результати поточного дослідження, ми припускаємо, що доза 50 мг/кг є більш ефективною для поліпшення пізнання та зниження патології, пов'язаної з АД, у наших мишей на AD-моделі. У більшості наборів даних поточного дослідження виявляється, що М50 має більш позитивний результат, ніж група М100, що вказує на те, що доза М100 може бути занадто високою і мати небажані побічні ефекти. Ці наслідки можуть бути пов'язані з видами; було показано, що дози до 200 мг/кг у щурів мають захисний ефект на моделях інсульту щурів (Svalbe et al., 2011).
Дані показують, що мілдронат має кілька позитивних ефектів у мишей з AD-моделлю, включаючи поліпшення соціального визнання та просторового навчання у водному лабіринті та зменшення навантаження на β. Крім того, мікроглія активується у мишей, оброблених мілдронатом, і експресія AChE знижується в зоні CA1. Разом ці висновки вказують на те, що мілдронат може мати терапевтичну користь як препарат, що модифікує захворювання у пацієнтів з АД. Наші миші AD-моделі у цьому віці не мають патології тау, тому в наступних дослідженнях буде важливо оцінити, чи матиме лікування мілдронатом на моделях мишей AD з патологією тау подібні ефекти. Крім того, необхідні майбутні дослідження доклінічних моделей АД, щоб краще зрозуміти молекулярні механізми, за допомогою яких мілдронат діє для поліпшення пізнання та зменшення патології.
Подяка
Спонсор грантового контракту: Американський фонд свободи Балтії; Спонсор грантового контракту: NIH, номер грантового контракту: P30 NS47466.
Автори не мають заявляти про конфлікт інтересів.
- Метаболічна хвороба кісток у дитинчат левів у Лондонському зоопарку в 1889 році оригінальна тваринна модель рахіту
- Непротеїнова добавка калорій покращує дотримання дієти з низьким вмістом білка та корисні вправи
- Харчування покращує роботу легенів у підлітків із надмірною вагою, що страждають ожирінням та страждають на астму
- Добавка фукоксантину з морських водоростей покращує показники ожиріння у японських суб’єктів з легким ожирінням
- Моніторинг захворювань жирової печінки за допомогою МРТ після баріатричної хірургії Перспективний, подвійний центр