MicroRNA-17-5p посилює індуковане ліпополісахаридами пошкодження клітин епітелію носа, націлюючи Smad7
Анотація
Передумови
У всьому світі риніт є одним з найпоширеніших хронічних розладів. Незважаючи на наявність ліків для лікування симптоматики риніту, дослідники все ще зосереджуються на визначенні нових молекулярних цілей для кращого лікування. МікроРНК беруть участь у багатьох біологічних та патологічних процесах. Однак роль miR-17-5p у риніті залишається невивченою. Це дослідження мало на меті дослідити роль miR-17-5p у пошкодженні клітин RPMI2650 носового епітелію, спричиненого ліпополісахаридами (LPS), та з'ясувати можливий основний молекулярний механізм.
Результати
LPS пошкоджував клітини RPMI2650, пригнічуючи проліферацію клітин, сприяючи апоптозу та стимулюючи вивільнення запальних цитокінів. Експресія miR-17-5p була значно збільшена в клітинах RPMI2650 після обробки LPS. Крім того, було встановлено, що надмірна експресія miR-17-5p призвела до загострення пошкодження, спричиненого LPS. miR-17-5p негативно регульована експресія Smad7; надмірна експресія Smad7 захищала клітини RPMI2650 шляхом інактивації шляхів NF-κB та Wnt/β-катеніну і навпаки.
Висновки
Надмірна експресія miR-17-5p погіршує LPS-індуковану шкоду клітин RPMI2650. Вираз Smad7 негативно регулювався miR-17-5p; Експресія Smad7 інактивована шляхами NF-κB та Wnt/β-катеніну.
Передумови
Риніт - одне з найпоширеніших запальних розладів верхніх дихальних шляхів [1]. Цей стан викликається впливом клітин слизової оболонки носа на алергени. Сучасна статистика свідчить, що приблизно 15% підлітків страждають на алергічний риніт у всьому світі [1, 2]. Окрім закладеності носа, відчуття свербежу та частого чхання, риніт також є однією з важливих причин порушеного сну [1]. Цей стан важко діагностується у маленьких дітей [3]. Визначення можливих факторів генетичної та екологічної мутагенності, з’ясування молекулярних шляхів, пов’язаних із патогенезом риніту, визначення нових цільових препаратів та вдосконалення сучасних стратегій лікування, залишаються основною метою досліджень риніту [1,2,3].
МікроРНК (miRNAs або miRs) належать до сімейства некодуючих РНК, як випливає з їх назви, вони менших розмірів і складаються з 22-25 нуклеотидів. miРНК зв’язуються з 3’-UTR (неперекладеною областю) відповідної мРНК і спричиняють посттрансляційне інгібування цих мРНК [4]. Відомо, що мікроРНК широко експресуються в людському організмі, і вони модулюють різноманітні фізіологічні та патологічні процеси, такі як розвиток органів, проліферація клітин, диференціація клітин, пухлини та апоптоз [5]. Дослідження вже встановили роль декількох miРНК у риніті, включаючи miR-21, miR-30-5p, miR-199b-3p, miR-874, miR-28-3p, miR-203, miR-875-5p тощо. . [6,7,8]. Деякі з вищезазначених мікроРНК мають високу експресію, а деякі - низьку експресію [6,7,8].
Кілька досліджень досліджували роль miR-17-5p у різних видах раку [9,10,11,12]. Наприклад, miR-17-5p опосередковує індуковану гіпоксією аутофагію та інгібує апоптоз у клітинах гладких м’язів судин [13]. Підвищена експресія miR-17-5p індукувала проліферацію та інгібувала апоптоз клітин раку легенів, водночас знижуючи чутливість клітин раку легенів до гефітинібу [14]. Крім того, miR-17-5p розглядали як потенційну терапевтичну мішень для атеросклеротичних уражень [15], запалення сітківки [16], нетравматичного остеонекрозу головки стегнової кістки [17] та жирової печінки [18]. Однак жодне дослідження не проводилось для вивчення ролі miR-17-5p у риніті.
Ліпополісахарид (LPS), агоніст рецептора 4, що називається платним, є основним компонентом клітинної стінки грамнегативних бактерій. Її основною функцією є підтримка структурної цілісності бактеріальної клітини [19]. LPS також діє як ендотоксин, який виробляє сильну імунну відповідь та запалення [20]. Дослідження вже використовували LPS-індуковане пошкодження носових епітеліальних клітин як модель риніту [19]. У цьому дослідженні ми досліджували роль miR-17-5p у LPS-індукованому пошкодженні носових епітеліальних клітин, а також намагалися дослідити основні молекулярні шляхи та мішені.
Методи
Культура клітин та лікування
Клітинна лінія носових епітеліальних клітин людини (RPMI2650) була придбана у American Type Culture Collection (ATCC, Rockville, MD, USA). Клітини RPMI2650 регулярно культивували в RPMI 1640 (Invitrogen, Carlsbad, CA, US) з доповненням 10% фетальної бичачої сироватки (FBS; Sigma, St. Louis, MO, USA) у присутності пеніциліну/стрептоміцину (Sigma, St. Louis, MO, США) при 37 ° C у зволоженій камері з 5% CO2. Клітини обробляли LPS (5 мкг/мл) протягом 12 годин.
трансфекція міРНК
Scramble, imNic siNC, si-miR-17-5p та miR-17-5p були синтезовані GenePharma Co (Шанхай, Китай). Трансфекцію клітин проводили з використанням реагенту Lipofectamine 3000 (Invitrogen) відповідно до протоколу виробника.
Кількісна ПЛР у реальному часі (RT-PCR)
РНК з культивованих клітин екстрагували за допомогою чистого набору для швидкої екстракції РНК (Bioteke Corporation, Пекін, Китай) відповідно до інструкцій виробника. Для зворотної транскрипції міРНК одностадійний синтез кДНК здійснювали додаванням полі (А) хвоста до 3 ′ кінця міРНК за допомогою праймера-адаптера оліго (dT) та зворотної транскриптази Super M-MLV (Bioteke Corporation, Пекін, Китай). Для мРНК загальні РНК були зворотно транскрибовані в реакційній системі, що містить випадкові праймери та зворотну транскриптазу M-MLV. Згодом продукти зворотної транскрипції (кДНК) ампліфікували за допомогою ланцюгової реакції полімерази в реальному часі (RT-PCR) із SYBR green Master Mix; RT-PCR проводили в кількісному тепловому блоці Exicycler 96 у реальному часі (BIONEER, Daejeon, Південна Корея). U6 використовували як внутрішній контроль для аналізу експресії міРНК, тоді як GAPDH використовували як внутрішній контроль для визначення рівнів експресії мРНК. Умови RT-PCR були такими: початкова інкубація 10 хв при 95 ° C, потім 40 циклів при 95 ° C протягом 10 с, при 60 ° C протягом 20 с і при 72 ° C протягом 30 с, після чого 5 хв. інкубація при 4 ° С. Відносний кількісний аналіз проводили за допомогою методу 2 - - △ КТ. Кожен зразок аналізували у трьох примірниках, і всі експерименти проводили тричі незалежно.
Трансфекція та генерація стабільно трансфікованих клітинних ліній
Повномірні послідовності Smad7 та РНК з короткими шпильками, спрямовані проти Smad7, були сконструйовані у плазмідах pEX-2 та U6/GFP/Neo (GenePharma) відповідно. Їх називали pEX- Smad7 та sh- Smad7, відповідно. Реагент ліпофектамін 3000 (Life Technologies Corporation, Карлсбад, Каліфорнія, США) був використаний для трансфекції клітин відповідно до інструкцій виробника. Плазміду, несучу нецільову послідовність, використовували як негативний контроль (NC) sh-Smad7, званий sh-NC. Стабільно трансфіковані клітини відбирали за допомогою культурального середовища, що містить 0,5 мг/мл G418 (Sigma-Aldrich, Сент-Луїс, Міссурі, США). Приблизно через 4 тижні були встановлені стійкі до G418 клони клітин.
Аналіз CCK-8
Клітини висівали в 96-лунковий планшет з 5000 клітинами/лунку. Життєздатність клітин оцінювали за допомогою комплекту для підрахунку клітин-8 (CCK-8, Dojindo Molecular Technologies, Gaithersburg, MD). Коротко, після стимуляції, розчин CCK-8 додавали до культурального середовища, і культури інкубували протягом 1 години при 37 ° С у зволоженому 95% повітрі та 5% СО2. Поглинання вимірювали при 450 нм за допомогою зчитувача мікропланшетів (Bio-Rad, Hercules, CA).
Аналіз апоптозу
Аналіз апоптозу проводили для ідентифікації та кількісної оцінки апоптотичних клітин за допомогою набору для виявлення апоптозу Annexin V-FITC/PI (Beijing Biosea Biotechnology, Пекін, Китай). Клітини (100 000 клітин/лунку) висівали в 6 лункових планшетів. Оброблені клітини двічі промивали холодним PBS і ресуспендували в буфері. Приклеєні та плаваючі клітини об'єднували та обробляли згідно з інструкцією виробника та вимірювали проточним цитометром (Бекман Коултер, США) для диференціації апоптотичних клітин (позитивні до Анексину-V та ПІ-негативні) від некротичних клітин (Анексин-V та ПІ-позитивні ).
Еліза
Супернатант культури збирали з 24-лункових планшетів і вимірювали концентрації запальних цитокінів за допомогою імуноферментного аналізу (Elisa) з використанням протоколів, наданих виробником (R&D Systems, Абінгдон, Великобританія).
Аналіз цитотоксичності
Цитотоксичність перевіряли за допомогою набору для аналізу цитотоксичності LDH (Beyotime, Шанхай, Китай). Коротше кажучи, клітини висівали в 96-лунковий планшет з 5000 клітинами на лунку та зростали до 80
90% злиття. Супернатант кожної лунки (50 мкл) переносили у прозорий 96-лунковий планшет і в кожну лунку додавали 100 мкл реакційної суміші. Через 30 хв інкубації при кімнатній температурі поглинання на довжині хвилі 450 нм визначали за допомогою приладу Elisa.
Аналіз подвійної активності люциферази
Цільовий сайт 3’UTR генерували за допомогою ПЛР, а конструкції репортерів люциферази за допомогою Smad7 3’UTR, що несуть передбачуваний сайт зв’язування miR-17-5p у вектор звіту pMiR, посилювали за допомогою ПЛР. Клітини ко-трансфікували з репортерною конструкцією, контрольним вектором та miR-17-5p або скремблюванням, використовуючи Lipofectamine 3000 (Life Technologies, США). Репортерські аналізи проводили за допомогою системи аналізу подвійної люциферази (Promega) відповідно до інформації виробника.
Вестерн-блот
Статистичний аналіз
Всі експерименти повторювали тричі. Результати багаторазових експериментів представлені як середнє значення ± стандартне відхилення (SD). Статистичний аналіз проводили за допомогою статистичного програмного забезпечення Graphpad (GraphPad Software, Сан-Дієго, Каліфорнія). P-значення розраховували за допомогою одностороннього дисперсійного аналізу (ANOVA). Р-значення
Результати
LPS індукував пошкодження клітин та підвищував експресію запальних цитокінів у клітинах RPMI2650
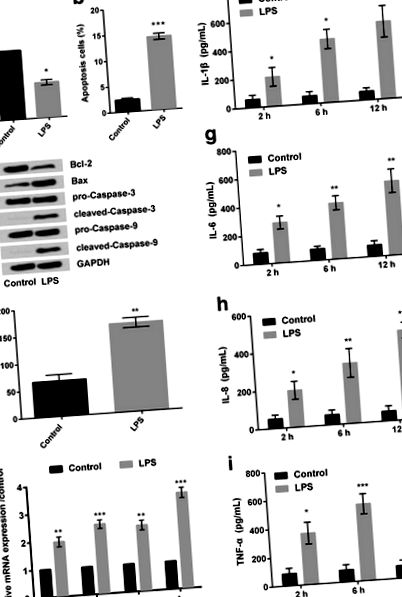
Аналіз CCK-8 показав, що після обробки клітин RPMI2650 LPS (5 мкг/мл); відсоток життєздатних клітин значно зменшився (P Рис. 1
Далі, RT-PCR показала, що відносна експресія мРНК різних запальних цитокінів, включаючи IL-1β, IL-6, IL-8 та TNF-α, була збільшена в клітинах, оброблених LPS (рис. 1д), порівняно з контрольна група клітин. Подібним чином, фактична оцінка вищезазначених запальних цитокінів (зроблена Елісою) також виявила ті самі результати (рис. 1f-i). Крім того, здається, що ЛПС покращував вивільнення запальних цитокінів залежно від часу. Враховуючи, що 12 год LPS індукували найбільш помітне збільшення вивільнення запального цитокіна, 12 год було обрано як LPS-стимулюючий стан для використання в наступних дослідженнях.
Індукована LPS експресія miR-17-5p
Відносна експресія РНК miR-17-5p (зроблена за допомогою RT-PCR) показала, що експресія miR-17-5p була значно збільшена (P Рис.2
Надмірна експресія та придушення miR-17-5p у клітинах RPMI2650
Після трансфекції клітин RPMI2650 за допомогою скремблювання, імітації siNC, si-miR-17-5p та miR-17-5p, RT-PCR проводили для оцінки відносної експресії РНК miR-17-5p. Було виявлено, що експресія miR-17-5p була значно збільшена в мімічній групі клітин miR-17-5p порівняно з групою клітин, що скремблюють. Подібним чином, експресія miR-17-5p була значно зменшена в групі клітин si-miR-17-5p порівняно з групою клітин siNC (P Рис.3
Надмірна експресія miR-17-5p, що посилюється LPS-індукованою травмою клітин і вивільненням запальних цитокінів
Аналіз CCK-8 показав, що відсоток життєздатних клітин значно зменшився (P Рис.4
Таким чином було встановлено, що надмірна експресія miR-17-5p посилює LPS-індуковане пошкодження клітин RPMI2650 шляхом придушення клітинної проліферації, сприяння апоптозу та сприяння вивільненню медіаторів запалення.
miR-17-5p негативно регульована експресія Smad7
Відносна експресія мРНК Smad7 була значно знижена (P Рис.5
Придушення miR-17-5p зменшило травмування клітин шляхом надмірної експресії Smad7
RT-PCR виявила, що відносна експресія мРНК Smad7 була значно збільшена (P Рис.6
Таким чином, було встановлено, що miR-17-5p погіршує LPS-індуковане пошкодження клітин RPMI2650 шляхом придушення експресії Smad7.
Надмірна експресія Smad7 полегшила LPS-індуковану травму клітин
Клітини RPMI2650, оброблені LPS, надмірно експресуючи Smad7, як у (група клітин LPS + pEX-Smad7), виявили значне збільшення (P Рис.7
Отже, можна сказати, що Smad7 захищав клітини RPMI2650 від пошкодження, спричиненого LPS.
Надмірна експресія Smad7 та придушення miR-17-5p полегшували LPS-індуковану травму клітин шляхом інактивації шляхів NF-κB та Wnt/β-катеніну
Вестерн-блот показав, що надмірна експресія Smad7, як у (група клітин LPS + pEX-Smad7), призводила до інактивації як шляхів NF-κB, так і Wnt/β-катеніну (рис. 8a-b). Оскільки спостерігалося зменшення експресії білків, пов’язаних із шляхами NF-κB, а саме фосфорильованого p65 (p-p65) та фосфорильованого INKα (p- INKα) у групі клітин LPS + pEX-Smad7 (рис. 8а) порівняно з клітинами з пригнічена експресія Smad7 (група клітин LPS + sh-Smad7). Подібним чином, білки, пов'язані з Wnt/β-катеніном, такі як Wnt3a, Wnt 5a та β-катенін, також були зменшені в клітинах з надмірною експресією Smad7, як у групі клітин pEX-Smad7 (рис. 8b), порівняно з клітинами з пригніченою експресією Smad7 (LPS + sh-Smad7 група клітин). Навпаки, надмірна експресія miR-17-5p (імітація LPS + miR-17-5p) призвела до активації шляхів NF-κB та Wnt/β-катеніну, тоді як придушення miR-17-5p (LPS + si-miR-17-5p група клітин) інактивували ці два шляхи (рис. 8в-г).
Надмірна експресія Smad7 та придушення miR-17-5p полегшували індуковане LPS пошкодження клітин шляхом інактивації шляхів NF-κB та Wnt/β-катеніну. Надмірна експресія Smad7 призвела до інактивації обох a NF-κB, та b Шляхи Wnt/β-катеніну. Придушення miR-17-5p призвело до інактивації обох c NF-κB, та d Шляхи Wnt/β-катеніну
Обговорення
Риніт, одне з найпоширеніших хронічних захворювань верхніх дихальних шляхів, досить поширений у всьому світі [1,2,3]. Накопичувальні дані демонструють, що міРНК причетні до патогенезу та біологічних процесів багатьох захворювань [4]. miR-17-5p - одна з широко досліджуваних міРНК; однак більшість досліджень досліджували його роль у раку [9, 10]. Знову ж таки, кілька досліджень обговорювали роль мікроРНК у патогенезі риніту [6, 7]; однак роль miR-17-5p у патогенезі риніту залишається незрозумілою. У цьому дослідженні ми досліджували роль miR-17-5p у патогенезі риніту та з'ясовували основний молекулярний механізм за допомогою клітинної лінії RPMI2650. RPMI2650 - це клітинна лінія носового епітелію людини, що має особливості, що нагадують клітини нормального носового епітелію [21].
Smad7 - це білок, кодований SMAD7 ген [29]. У кількох дослідженнях описана захисна роль Smad7 при запальних захворюваннях [29, 30]. Лю GX та його колеги описали, що Smad7 захищав нирки від опосередкованого ангіотензином II запалення на мишачій моделі [31]. Тим часом нещодавні дослідження повідомили, що Smad7 може посилити диференціацію м’язів і відігравати важливу роль у запобіганні метастазуванню ракових клітин [32, 33]. Однак чи брав участь Smad7 у регуляції індукованого LPS пошкодження клітин при риніті, залишається незрозумілим. У нашому дослідженні ми виявили, що придушення експресії Smad7 призвело до посилення індукованої LPS травми клітин, тоді як надмірна експресія Smad7 полегшила LPS-індуковану травму клітин RPMI2650.
NF-κB шлях розглядається як прототип прозапального шляху головним чином через його роль у експресії цитокінів та хемокінів [34]. Подібно до наших висновків, Fei XJ та його колеги показали у своєму дослідженні, що Acanthopanax senticosus, загальноприйнята в східній медицині медицина захищала клітини легенів миші від пошкодження, спричиненого LPS, через інактивацію шляху NF-κB [35]. Крім того, було встановлено, що захисна дія Smad7 проти LPS-індукованого пошкодження клітин опосередковується інактивацією шляху NF-κB, як оцінюється вестерн-блот. Подібно до наших висновків, Wang J, et al. описав, що Smad7 інактивував шлях NF-κB і захистив мишей від гепатокарциногенезу [36].
Шлях Wnt/βкатеніну є одним із еволюційно збережених шляхів. Він відіграє важливу роль як у біологічних процесах, так і в захворюваннях [37]. LI B та його колеги продемонстрували, що мезенхімальні стовбурові клітини захищали альвеолярні макрофаги від LPS-індукованого апоптозу шляхом інгібування шляху Wnt/β-катеніну [38]. Ву та ін. виявили, що Smad7 регулює зниження експресії Wnt4, Wnt5a, Wnt7a та Wnt10a при остеоартрозі [39]. Подібно до цих попередніх досліджень, наші результати продемонстрували, що Smad7 захищав клітини RPMI2650 від LPS-індукованого пошкодження шляхом інактивації шляху Wnt/β-катеніну. Що ще цікавіше, попередні дослідження пропонували перехресну регуляцію між шляхами NF-κB та Wnt/β-катеніну [40, 41]. Cho et al., Вказали, що диклофенак пригнічував передачу сигналів Wnt/β-катеніну в клітинах раку товстої кишки шляхом активації NF-κB [42]. Однак, чи існує кореляція між опосередкованим Smad7 сигналом Wnt/β-катеніну та сигналами NF-κB все ще потрібно розкрити.
Висновки
Таким чином, з нашого дослідження можна зробити висновок, що надмірна експресія miR-17-5p погіршує LPS-індуковане пошкодження клітин RPMI2650 шляхом негативного регулювання експресії Smad7, який захищає клітини RPMI2650 через інактивацію шляху NF-κB та Wnt/β-катеніну.
- Як ракові клітини живуть на голодній дієті MIT News Массачусетський технологічний інститут
- Ось; s Дієта Пол Джордж відзначає своє чудове повернення після того жахливого ушкодження ніг
- JCI - кетогенез запобігає індукованому дієтою пошкодженню печінки та гіперглікемії
- Виправте свою травму цілющою їжею АКТИВНО
- Низький рівень міді пов'язаний з жирними жировими клітинами