Метаболічні біомаркери в сироватці крові відрізняють здорових людей із ожирінням, що страждають на метаболізм, від здорових людей із центральним ожирінням
Анотація
Передумови
Аномалії обміну речовин більше пов'язані з центральним ожирінням, ніж периферичним ожирінням, але основні механізми в основному невідомі. Це дослідження мало виявити сироваткові метаболічні біомаркери, які відрізняють метаболічно нездорових людей із центральним ожирінням (MUCO) від здорових із периферичним ожирінням (MHPO).
Методи
Було застосовано двоступеневий дизайн дослідження «випадок-контроль». На стадії відкриття було включено 20 особин (10 MHPO та 10 MUCO), а на наступній стадії перевірки було використано 79 особин (20 нормальної ваги (NW), 30 MHPO, 29 MUCO). Дослідницькі групи були підібрані за віком, статтю, фізичною активністю та загальним споживанням дієтичних калорій за MHPO та MUCO, додатково підібраними для ІМТ. Порушення метаболізму визначали як: 1) HOMA-IR> 4,27 (90-й процентиль), 2) холестерин ліпопротеїнів високої щільності 102 см у чоловіків та> 88 см у жінок. Особи MUCO мали всі ці аномалії, тоді як особи MHPO та NW не мали жодного з них. Цілеспрямований підхід до метаболоміки проводили на зразках сироватки натще, які можуть одночасно ідентифікувати та кількісно визначити 186 метаболітів.
Результати
На стадії виявлення виявлено, що вміст лейцину в сироватці крові, ізолейцину, тирозину, валіну, фенілаланіну, альфа-аміноадипінової кислоти, метіонінсульфоксиду та пропіонілкарнітину був значно вищим у MUCO порівняно з групою MHPO після багаторазового коригування тесту. Суттєві зміни п'яти метаболітів (лейцину, ізолейцину, валіну, альфа-аміноадипінової кислоти, пропіонілкарнітину) були підтверджені на етапі перевірки.
Висновки
Значно вищі рівні сироваткового лейцину, ізолейцину, валіну, альфа-аміноадипінової кислоти, пропіонілкарнітину характерні для пацієнтів із центральним ожирінням, метаболічно нездоровими. Отримані дані дають нові уявлення про патогенез метаболічних відхилень при ожирінні.
Передумови
Метаболоміка визначається як технологія «оміки», характерна для високопродуктивної ідентифікації та кількісного визначення малих молекул (
Методи
Заява про етику
Це дослідження отримало етичне схвалення від Управління етики медичних досліджень Медичного факультету Меморіального університету, Сент-Джонс, Ньюфаундленд, Канада, [з ідентифікаційним кодом проекту № 10.33 (остання дата затвердження: 11 лютого 2016 р.)]. Письмова інформована згода була отримана від усіх добровольців.
Навчання населення
Ми використовували двоступеневу схему дослідження «випадок-контроль», а саме фази виявлення та перевірки. Особи для обох фаз були відібрані з поточного дослідження КОДУВАННЯ (Складні захворювання в популяції Ньюфаундленду: довкілля та генетика) [25–29]. Критеріями включення для дослідження КОДУВАННЯ є: 1) щонайменше третє покоління ньюфаундлендера, 2) у віці від 20 до 79 років, 3) не вагітна на момент навчання. Метаболічні характеристики, що використовуються для класифікації суб'єктів, які є метаболічно нездоровими або здоровими, є наступними:
Метаболічно нездорове центральне ожиріння (MUCO) - 1) оцінка моделі гомеостазу на інсулінорезистентність (HOMA-IR)> 4,27 (90-й процентиль) [9, 11], 2) рівень холестерину ліпопротеїдів високої щільності (HDL-C) 102 см в чоловіки і> 88 см у жінок [9, 11];
Метаболічно здорове периферичне ожиріння (MHPO) - 1) HOMA-IR 2). Суб'єкти двох груп відповідали віку, ІМТ, загальному харчуванню калорій та рівню фізичної активності.
На наступному етапі валідації були відібрані нормальна вага (НЗ, 20 суб'єктів) та дві групи ожиріння (29 суб'єктів для групи MUCO та 30 суб'єктів для групи MHPO). Метаболічні характеристики, які використовувались для розрізнення двох ожиріних груп, були такими ж, як і на етапі відкриття, за винятком ІМТ, який був розширений до рівня вище 27,2 через труднощі в ідентифікації зразків, що відповідають суворим критеріям досліджуваних груп. Метаболічні характеристики групи NW були однаковими з групою MHPO, за винятком того, що 18 90% становить глюкоза). Процедури аналізу набору, а також номенклатура метаболітів були детально описані раніше [23, 24].
Статистичний аналіз
Дані загальних характеристик учасників дослідження представлені як середні значення ± SD. Відмінності в антропометрії, дієтичному споживанні та фізичній активності оцінювали за допомогою Стьюдента т-тест. Співвідношення статей було проаналізовано хі-квадрат тести. Для цих аналізів було використано програмне забезпечення SPSS версії 19.0 (SPSS Inc, Чикаго, Іллінойс, США). Всі тести були двосторонніми і a стор-значення менше 0,05 вважалося статистично значущим.
На наступному етапі валідації аналізували нормальний розподіл 8 статистично значущих метаболітів, що вижили після дослідження. Логарифмічне перетворення використовувалось для змінних, які не показували нормального розподілу. Одностороння ANOVA з подальшим Тукі тест був використаний для аналізу суттєвої різниці між групами за допомогою програмного забезпечення SPSS версії 19.0. Метод Бонферроні був використаний для корекції багаторазового тестування. A стор-значення ≤ 0,005 вважали статистично значущим.
Результати
Демографічні та метаболічні характеристики учасників
Двадцять людей із ожирінням були включені в стадію відкриття. Загальні характеристики суб'єктів на стадії відкриття показані в таблиці 1. Не було значущих відмінностей за віком, ІМТ, співвідношенням статі, BF%, TF%, AF%, систолічним артеріальним тиском (SBP), діастолічним артеріальним тиском (DBP) ), дієтичне споживання їжі та фізична активність між цими двома групами. Окружність талії, маса вісцерального жиру, VF%, вміст TG в сироватці крові, глюкоза, рівень інсуліну та значення HOMA-IR у групі MUCO були значно вищими, ніж у групі MHPO (стор Таблиця 1 Характеристика учасників дослідження на стадії відкриття
Загальні характеристики суб'єктів на етапі перевірки наведені в таблиці 2. Суттєвих відмінностей у віці, співвідношенні статі, споживанні дієтичних продуктів харчування та фізичній активності серед трьох груп не було. ІМТ, окружність талії, BF%, TF%, AF%, вісцеральна маса жиру були значно нижчими у групі ПЗ у порівнянні з двома групами ожиріння (стор Таблиця 2 Характеристика учасників дослідження на етапі перевірки
Визначені метаболіти в сироватці крові учасника
Понад 95% метаболітів (178/186) були успішно визначені в кожній пробі. Сюди входили 40 ацилкарнітинів (включаючи вільний карнітин), 21 амінокислота, 12 біогенних амінів, 89 гліцерофосфоліпідів (14 лізоПК, 75 ПК), 15 сфінгомієлінів та гексози (> 90% становить глюкоза), як показано в додатковому файлі 1: Таблиця S1.
Зміни профілів метаболоміки в групах MHPO та MUCO на стадії відкриття
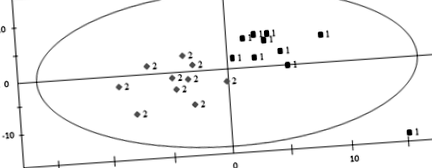
Результати PLS-DA були представлені на рис. 1. У побудованій моделі PLS-DA R2X = 0,422, R2Y = 0,801 та хороший параметр прогнозування Q2 (cum) = 0,571. Метаболіти з VIP> 1 вважалися важливими у класифікації двох груп. Значущі метаболіти були додатково оцінені за допомогою тесту Крускала-Уолліса з порогом стор 1 і стор Рис. 1
Графічні показники PLS-DA груп MUCO та MHPO. "1" представляє здорову метаболічно групу периферичного ожиріння (MHPO); «2» представляють нездорову метаболічну групу ожиріння (MUCO)
Порівняно з групою MHPO, у групі MUCO було успішно виявлено 39 метаболітів. 11 амінокислот (аланін, глутамін, гістидин, ізолейцин, лейцин, лізин, метіонін, фенілаланін, пролін, тирозин, валін), 4 біогенні аміни (альфа-ААА, Met-SO, кінуренін, саркозин), вільний карнітин (C0) плюс 13 ацилкарнітини (C3, C3DC (C4OH), C4, C4: 1, C5, C5: 1, C5-DC (C6-OH), C6 (C4: 1-DC), C6: 1, C10: 1, C10: 2, C16, C16OH) та гексози (> 90% становить глюкоза) були значно вищими та 9 гліцерофосфоліпідів (lysoPC C28: 1, PC aa C40: 2, PC ae C34: 2/C36: 3/C36: 4/C38: 4/C38: 5/C38: 6/C42: 0) були значно нижчими у групі MUCO.
У той час як після багаторазового коригування тестування гексоза, лейцин, ізолейцин, тирозин, валін, фенілаланін, альфаААА, Met-SO та C3 все ще мали статистично суттєві відмінності між цими двома групами. Однак на глюкозу припадає 90% гексози в підході до метаболоміки, отже, підвищення рівня гексози у суб'єктів MUCO, ймовірно, пов'язане з високим рівнем глюкози натще. Отже, всі ці метаболіти, крім гексози, були визначені ключовими метаболітами, що розрізняють групи MUCO та MHPO, і були додатково вивчені на етапі валідації.
Зміни профілів метаболоміки між групами на етапі перевірки
Значні відмінності 8 метаболітів були додатково вивчені на етапі перевірки. П’ять метаболітів були визначені як статистично значущі серед трьох груп. Як показано в таблиці 4, рівні лейцину в сироватці крові, ізолейцину, валіну, альфаААА, С3 були значно вищими в групі MUCO порівняно з групами NM або MHPO після багаторазового коригування тесту (стор Таблиця 4 Метаболіти зі значною різницею між групами на етапі перевірки
Обговорення
Наскільки нам відомо, це дослідження першим виявило сироваткові метаболічні біомаркери в MUCO, зосередившись на факторах розподілу жиру та використовуючи технологію метаболоміки. Ми виявили значне збільшення 5 сироваткових метаболітів (лейцин, ізолейцин, валін, альфаААА та С3 ацилкарнітин), які відрізняли метаболічно нездоровий центральний ожиріння від здорових пацієнтів із ожирінням із периферичним ожирінням.
Ожиріння є одним із основних факторів ризику розвитку діабету та інших обмінних процесів [2]. Однак парадоксально, що значна частина людей з ожирінням у загальній популяції може виявляти фенотип, вільний від метаболічних відхилень [6, 9, 10]. Отже, останні дослідження показали, що диференціація метаболічного стану здоров’я серед людей із ожирінням частково зумовлена різним розподілом жиру [38]. В даний час відомо, як накопичується жир у черевній порожнині живота або центральне ожиріння, є ключовим фактором ризику, який пов’язує з метаболічними порушеннями ожиріння [6, 10, 11]. По суті, пацієнти з центральним ожирінням мають значно вищий ризик виникнення однієї або декількох відхилень, пов’язаних з ліпідами, інсуліном, глюкозою, кров’яним тиском та запаленням, ніж пацієнти із ожирінням із периферичним захворюванням [4, 5, 8]. Однак специфічні метаболічні характеристики та молекулярні механізми, що відрізняють метаболічно нездоровий фенотип ожиріння від метаболічно здорового ожиріння, залишаються недостатньо вивченими.
Ацилкарнітини утворюються внутрішньоклітинно з карнітину під час метаболізму довголанцюгових жирних кислот та ВСАА [62, 63]. У нашому дослідженні ми виявили, що ацилкарнітин C3 у сироватці крові (пропіонілкарнітин) був значно вищим у осіб MUCO. С3 є продуктом катаболізму мітохондріальних ВСАА, особливо катаболізму ізолейцину та валіну [14]. Підвищення рівня С3 у сироватці крові також спостерігалося у пацієнтів із ожирінням або цукровим діабетом раніше [14, 64–66], а посилена деградація BCAA в м’язовій тканині або печінці, пов’язана із підвищенням рівня BCAA в сироватці крові, розглядалася як потенційна причина [14].
Біогенні аміни - це біоактивні речовини, що містять одну або кілька груп амінів. Вони є основними азотистими сполуками, що утворюються в основному шляхом декарбоксилювання амінокислот або амінування та трансамінування альдегідів та кетонів. Серед біогенних амінів, виміряних у поточному дослідженні, лише сироваткова альфа-аміноадипінова кислота (альфаААА) суттєво відрізнялася серед груп. AlphaAAA є продуктом деградації лізину у ссавців [67, 68], який був визначений як біомаркер для розвитку T2DM та потенційний модулятор гомеостазу глюкози у людей [69, 70]. Повідомлення про зміни рівня альфа-ААА у сироватці крові при ожирінні трапляються рідко, тоді як дослідження з Кореї описувало значно вищий рівень альфа-ААА у сироватці крові у дітей із ожирінням [71]. Загальновідомо, що ожиріння, особливо центральне ожиріння, є основним фактором ризику розвитку ІР та діабету [6, 10–12]. Однак фактори, що пов'язують ожиріння та діабет, в основному невідомі. У цьому дослідженні пацієнти чітко визначились із центральним ожирінням. Наші висновки твердо свідчать про те, що альфаААА є принаймні одним із важливих факторів, що опосередковує центральне ожиріння та діабет.
Це дослідження мало ряд обмежень, на які слід звернути увагу. По-перше, це перехресне дослідження випадок-контроль. Послідовні спостереження, зроблені в перспективі, могли б надати більше корисної інформації. По-друге, хоча цілеспрямований підхід до метаболоміки досліджував 186 метаболітів, ми могли пропустити важливі метаболіти, яких група не має. Нарешті, хоча HOMA-IR є загальновизнаним показником IR, техніка гіперінсулінемічного еуглікемічного затиску вважається більш точним методом вимірювання IR [72].
Висновки
Це перше дослідження з використанням цілеспрямованого підходу до метаболоміки та двоступеневої схеми дослідження для виявлення відмінностей між метаболітами сироватки крові між здоровими метаболічно периферичними ожиріннями та нездоровими людьми із центральним ожирінням. Ми виявили значно вищий рівень сироваткових амінокислот з розгалуженим ланцюгом (лейцин, ізолейцин, валін), пропіонілкарнітин (С3 ацилкарнітин) та альфаААА, щоб відрізнити метаболічно нездорове центральне ожиріння від метаболічно здорового периферичного ожиріння. Виявлені метаболіти дають нові уявлення про метаболічні характеристики та патогенез метаболічних відхилень при центральному ожирінні. Подальші дослідження є необхідними для подальшої перевірки відповідності цих нових метаболітів, пов’язаних із центральним ожирінням, та з’ясування основних біохімічних механізмів.
- Батьки дітей, що страждають ожирінням, повинні отримувати путівки на здорову їжу, вважають експерти з ожиріння The Guardian
- Доказ того; Індекс маси тіла; марно чверть тих, хто класифікується як ожиріння, насправді здорові
- Провісники метаболічно здорового ожиріння у догляді за дітьми при цукровому діабеті
- Короткочасний вплив жувальної гумки на ситість та споживання післяобідніх закусок при здоровій вазі та ожирінні
- ПРОГНОЗУВАННЯ БАЗОВОГО МЕТАБОЛІТНОГО РОЗМІРУ ДІТЕЙ, ЩО ВІДВИЧАЮТЬСЯ Журнал Американського коледжу з питань харчування Vol.