Механізми, що лежать в основі обмеження калорій та регулювання тривалості життя: наслідки для старіння судин
Золтан Унгварі
1 Кафедра фізіології, Нью-Йоркський медичний коледж, Вальхалла, штат Нью-Йорк 10595
Крістіна Паррадо-Фернандес
2 Лабораторія експериментальної геронтології, Національний інститут старіння, Національний інститут охорони здоров'я, 5600 Nathan Shock dr. Балтимор, доктор медицини 21224
3 Laboratorio de Biología Celular, Університет Кордови
Анна Чішар
1 Кафедра фізіології, Нью-Йоркський медичний коледж, Вальхалла, штат Нью-Йорк 10595
Рафаель де Кабо
2 Лабораторія експериментальної геронтології, Національний інститут старіння, Національний інститут охорони здоров'я, 5600 Nathan Shock dr. Балтимор, доктор медицини 21224
Анотація
Цей огляд зосереджується на нових доказах того, що послаблення продукції активних форм кисню (АФК) та пригнічення запальних шляхів відіграють центральну роль у протистарінні серцево-судинних ефектах обмеження калорій (CR). Особливий наголос робиться на потенційній ролі окислювально-відновної системи плазматичної мембрани в CR-індукованих шляхах, відповідальних за відчуття окисного стресу та підвищення стійкості клітинного окислювального стресу. Ми припускаємо, що КР підвищує біодоступність NO, зменшує генерування судин АФК, активує шлях Nrf2/ARE, індукуючи системи детоксикації АФК, надає протизапальну дію і, таким чином, пригнічує ініціацію/прогресування судинних захворювань, що супроводжують старіння.
Історична перспектива
Майже століття тому Морескі та Рус окремо опублікували свої спостереження щодо впливу недогодованих лабораторних тварин на трансплантовані та індуковані пухлини 1, 2. Через два десятиліття Маккей та його колеги вперше спостерігали продовження тривалості життя у лабораторних щурів, які дотримувались КР дієти. З тих пір CR інтенсивно вивчався, і постійні результати показували його сприятливий вплив на довголіття, вікові захворювання, ослаблення функціональних відхилень та канцерогенез у широкому спектрі видів та дієтичних рецептур 4 - 5. Незважаючи на ці спостереження, точний (і) механізм (и), що лежить в основі ефектів захисту КР та продовження тривалості життя, залишається невідомим. Можна з упевненістю сказати, що обмеження калорій зменшує швидкість метаболізму та окислювальну шкоду, покращує маркери діабету, такі як чутливість до інсуліну.
CR зменшує частоту серцево-судинних захворювань, і було показано, що він змінює нейроендокринну та симпатичну нервову систему у лабораторних тварин, і деякі з них повторюються в даний час у дослідженнях на людях. Зокрема, Національний інститут старіння через свою програму CALERIE (Всебічна оцінка довгострокових ефектів зменшення споживання енергії, започаткована в 2002 р.) Намагається фінансувати клінічні випробування з метою доцільності використання КР як терапевтичного інструменту, а також його наслідків та механізми профілактики захворювань. Дослідження CALERIE вивчають затримку супутніх захворювань, пов'язаних зі старінням, особливо тих, що пов'язані зі швидкістю метаболізму та біомаркерами старіння, вивчаючи ті, які прогнозують вікові захворювання, такі як серцево-судинні захворювання та діабет 2 типу 6-13 .
Окислювальний стрес, старіння та плазматична мембрана
Мітохондрії є основним джерелом виробництва АТФ. Під час окисного фосфорилювання мітохондрій утворюються активні форми кисню [АФК]. АФК пов'язані з пошкодженням ДНК, ліпідів та білків 14-16. Патологія старіння та вікових захворювань включає окислювальний стрес як ранній етап у своєму розвитку 17 - 19, що підтверджується зниженням антиоксидантного захисту та збільшенням окислювального ураження 20, 21. Старіння також пов'язане зі зміною рівнів антиоксидантної здатності та окислювальних пошкоджень, які нібито призводять до порушення мітохондрій. Ці зміни були пов’язані із збільшенням окисного пошкодження ДНК 22 - 25, ліпідів 26, 27 та білків 23, 28 - 30. Накопичення мутацій мітохондріальної ДНК, зазвичай ідентифікованих при вікових захворюваннях, індукує порушення мітохондріальних комплексів 31 - 33, включаючи активність мітохондріального комплексу III у віці серця 34. Порушення функції мітохондрій спричиняє дефіцит надходження АТФ, що призводить до подальших проблем у біохімічних шляхах 31 .
Теорія вільних радикалів старіння 35, 36 викликала значний інтерес щодо пошуку можливих біохімічних основ процесів старіння. Багато минулих досліджень показали, що CR зменшує вироблення активних форм кисню (АФК), тим самим мінімізуючи окислювальну шкоду 37, 38. Ці дослідження в сукупності призвели до гіпотези, згідно з якою CR за рахунок зменшення окисного стресу продовжує тривалість життя. Мембрани мітохондрій 39 та плазми 40 є місцями активного та рясного утворення АФК, і тому вони мають високий ризик пошкодження АФК. Отже, з цього випливає, що центральний механізм дії CR може включати зміни мембрани, які або зменшують вироблення АФК, або протистоять окислювальним пошкодженням.
Було запропоновано, що тривалість життя обернено залежить від ступеня ненасиченості мембранних фосфоліпідів 41, 42, і що з'ясування цього зв'язку може дати уявлення про механізм продовження тривалості життя за допомогою CR 43. Однак модуляція сприйнятливості мембрани до перекисного окислення може бути занадто спрощеною, щоб пояснити процеси старіння, оскільки ця гіпотеза, здебільшого, не розглядає інші процеси, пов'язані з мембраною. Такі процеси включають зміни в клітинній сигналізації, витік протонів (та інших іонів) 44, вироблення АФК 39, індукцію апоптозу 45 та підтримку антиоксидантних систем 46 - 49. Індуковані мембраною зміни в будь-якому з цих процесів можуть мати серйозні наслідки, що впливають на окислювальний стрес і тривалість життя.
CR підвищує CoQ-залежні редуктази в плазматичних мембранах in vivo та in vitro
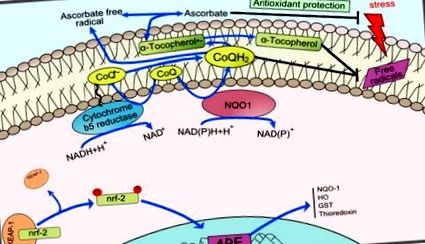
Коензим-Q (CoQ) сприяє стабілізації плазматичної мембрани, регенерує такі антиоксиданти, як аскорбат та α-токоферол, та регулює позаклітинний індукований керамідом залежний шлях апоптозу 49, 50. NAD (P) H-залежні редуктази діють на плазматичну мембрану для регенерації CoQH2, сприяючи збереженню її антиоксидантних властивостей. В цілому, як CoQ, так і його редуктази (рис. 1) складають транс-плазматичну мембранну антиоксидантну окисно-відновну систему, відповідальну за вищеописані функції 51 - 53 .
Схема окисно-відновної системи плазматичної мембрани. Окислювально-відновний цикл показаний синім кольором. CoQ, окислена форма коферменту Q; CoQ .-, напівхіноновий радикал; CoQH2, відновлена форма коферменту Q; NQO1, NADH-хінон-оксидоредуктаза. Змінено з Hyun et al. (2006а).
CR індукує рівні білка SIRT1 In vivo та in vitro
SIRT1 розподіляється у всіх досліджених тканинах ссавців та модулює клітинний та тканинний гомеостаз, взаємодіючи з метаболічними та стресовими реакційними білками та факторами. Наявні дані свідчать про те, що SIRT1 регулює енергетичний обмін, ендокринну сигналізацію та деякі реакції на стрес 83. SIRT1 також індукується широким спектром сигналів у відповідь на CR 79 або натощак 84, що свідчить про широку роль у фізіології ссавців. Стає очевидним, що сиртуїни регулюються стресом та станом поживності дріжджів, глистів, мух та ссавців 79, 85 - 87. Ендокринні та енергетичні шляхи метаболізму координують розвиток і фізіологію організму і є невід’ємними для таких патологій, як рак, нейродегенерація та діабет. Ці системи реагують на різноманітні зовнішні сигнали, такі різноманітні, як навколишнє середовище, стрес та поживні речовини. Sir2 протилежним чином регулює як реплікативну 88, так і хронологічну тривалість життя дріжджів 89. Додаткові копії генів сиртуїну подовжують тривалість життя багатоклітинних організмів, таких як черви, мухи та риби 86, 90, 91]. В принципі, розуміння того, як ці шляхи реагують на фактори навколишнього середовища та харчування, може допомогти нам краще зрозуміти розвиток успішних методів лікування.
SIRT1 регулює кілька факторів транскрипції, які регулюють реакції на стрес, енергетичний метаболізм та ендокринну сигналізацію, включаючи активований проліфератором пероксисоми рецептор γ (PPARγ), PPARγ-коактиватор 1α (PGC1-α), фактори транскрипції вилки (FOXO), LXR та p53 92 - 98. Існує все більше даних, що підтверджують, що SIRT1 регулює енергетичний обмін, ендокринну сигналізацію та деякі реакції на стрес 83, 99. Біологічні ефекти, виявлені для сиртуїнів, підживили припущення, що сиртуїни модулюють процеси, що впливають на тривалість життя, вікові захворювання, діабет та пухлину 100 .
Вазопротекторні ефекти CR
Показано, що CR послаблює атерогенез у гризунів 108. Серцево-судинні ефекти CR, що спостерігались дотепер, узгоджуються з думкою, що CR може надавати вазопротекцію людям, хоча наслідки CR на прогресування атеросклерозу та склад зубного нальоту у людей похилого віку або у вікових приматів 109 все ще недостатньо добре задокументовані. Загалом, CR може впливати на здоров’я судин як шляхом поліпшення системних факторів ризику ішемічної хвороби серця (ІХС) (наприклад, рівні ліпідів і глюкози в плазмі крові, кров’яний тиск), так і шляхом модуляції клітинних функцій та експресії генів в клітинах ендотелію та гладких м’язів, що створюють мікросередовище у судинній стінці, що не сприяє атерогенезу (наприклад, ослаблення продукції АФК, протизапальний ефект).
Обмеження калорій покращує серцево-судинний фактор ризику
CR підвищує біодоступність NO та покращує функцію ендотелію
Розширення у відповідь на збільшення ступеня внутрішньосвітлового потоку (панель A) або введення ацетилхоліну (панель B) в ізольованих, канюльованих артеріолах м'язів першого порядку (d:
100 мкм; під тиском до 80 мм рт.ст. 74) у віків (24 місяців) щурів F344, які харчуються за стандартною дієтою (SD), погіршується порівняно з молодими судинами. Довічне обмеження калорій (CR) зберігає функцію мікросудинного ендотелію. * P Рис. 2C – D). Незважаючи на те, що медіатор (и) судинних ефектів CR недостатньо зрозумілий, є дані, що CR може регулювати як активність eNOS, так і експресію за допомогою активації SIRT-1. Цікаве дослідження нещодавно повідомило, що SIRT1 та eNOS колокалізуються в ендотеліальних клітинах, а SIRT1 деацетилює eNOS, стимулюючи активність eNOS та збільшуючи ендотеліальний оксид азоту 123. Більше того, CR у мишей призводить до деацетилювання eNOS 123, тоді як було показано, що надмірна експресія SIRT1 або активатори SIRT1 індукують експресію eNOS в ендотеліальних клітинах 124. Потрібні подальші дослідження, щоб з'ясувати, чи призводить активація SIRT-1 до підвищеної біодоступності NO, що покращує ендотеліальну функцію у людей у віці з ХР.
CR може послабити запалення судин при старінні
CR послаблює окислювальний стрес у судинній системі
Nrf2: новий шлях захисту від судин
Висновки та перспективи
Подяка
Ця робота була підтримана Програмою внутрішніх досліджень Національного інституту старіння та грантами Американської асоціації серця (0430108N та 0435140N) та NIH (> HL077256 та HL43023 до ZU).
- Регулювання споживання енергії та механізми метаболічної адаптації або дезадаптації після калорійності
- Регулювання метаболічного здоров'я та старіння за допомогою чутливих до поживних речовин сигнальних шляхів
- Модуляція шкірного старіння з обмеженням калорій у щурів Fischer 344 - гістологічне дослідження -
- Поживні речовини Безкоштовно Повний текст Вплив обмеження калорій на роль аутофагії у втручанні у старіння
- Нові підказки, чому неправильне харчування в утробі матері призводить до ожиріння в подальшому житті - ScienceDaily