Ін’єкційний адиполіз: механізми, агенти та подальші напрямки
Шахраам Камальпур
дерматологічний університет штату Луїзіана, Новий Орлеан, Луїзіана;
Кіт Леблан, молодший.
дерматологічний університет штату Луїзіана, Новий Орлеан, Луїзіана;
b Центр хірургії шкіри, Metairie and Mandeville, Луїзіана
Анотація
ТУМЕСЦЕНТНА ЛІПОЗУКЦІЯ була розроблена дерматологом Джеффрі Кляйном у 1987 році і з тих пір стала золотим стандартом серед методів видалення підшкірної жирової тканини.1 З тих пір були розроблені численні неінвазивні та ліполітичні альтернативи ліпосакції, включаючи радіочастотне, високоінтенсивне сфокусоване ультразвукове дослідження (HIFU), кріоліполіз та нетепловий ультразвук.1,2
Серед найновіших методів лікування небажаних підшкірно-жирових відкладень - ін’єкційний адиполіз, який використовує продукти, що містять активний інгредієнт дезоксихолат натрію (SDC). Ця методика викликала інтерес через обмежений час простою та легкість підшкірного введення і надає можливість націлювати невеликі осередки жирової тканини, що не піддаються лікуванню іншими способами.2
Практика мезотерапії, придумана французьким лікарем Мішелем Пістором у 1950-х роках, стосується підшкірного введення речовин, призначених для поліпшення зовнішнього вигляду жирових тканин.3 Маджорі першим описав використання препаратів для мезотерапії, що містять фосфатидилхолін (ПК), розчинений у SDC .4 Незабаром після цього численні експериментальні дослідження повідомили про зменшення жирових тканин за допомогою цих ін’єкцій.
Найвідомішим із цих ранніх засобів був Lipostabil Endovena® (Aventis Pharma, Німеччина), внутрішньовенний засіб для лікування гіперліпідемії, жирових емболій, діабетичної ангіопатії, атеросклерозу та інших внутрішньосудинних аномалій ліпідів. повідомляли про позитивні ефекти цього в/в препарату на системні ліпідні профілі, що викликало дослідження як мезотерапевтичний засіб
Незважаючи на нестримне використання в Бразилії, коли тисячі пацієнтів шукали ін’єкції від целюліту, зворотних рулонів та грижі жирових відкладень нижньої повіки, у грудні 2002 року Lipostabil було заборонено для косметичного використання ANVISA, бразильським еквівалентом FDA, оскільки клінічних випробувань не було на підтримку ефективності або безпеки препарату. 12,13 Агентство з регулювання лікарських засобів та медичних товарів у Сполученому Королівстві та FDA згодом виступили з рішучими попередженнями проти їх використання.
Подальші дослідження з'ясували SDC як активний інгредієнт у цих мезотерапевтичних розчинах, що завершилось схваленням FDA ATX-101, що продається як Kybella® (Kythera Biopharmaceuticals, дочірня компанія Allergan, Westlake Village, Каліфорнія). Цей препарат дезоксихолату натрію 10 мг/мл був схвалений для естетичного поліпшення «середньої та важкої опуклості або повноти, пов’язаної з субментальним жиром у дорослих», і є першим схваленим FDA препаратом для ін’єкційного адиполізу14.
МЕХАНІЗМ ДІЙ І ГІСТОЛОГІЯ
Спочатку обговорювались ефекти підшкірної ін’єкції розчинів, що містять ПК та SDC, і було запропоновано, щоб вони спричинили розщеплення збережених тригліцеридів усередині адипоцитів та активованих внутрішньоклітинних ліпаз. Ця теорія, заснована на впливі ПК на системний рівень тригліцеридів, та його здатність емульгувати жири для транспортування, призвела до гіпотези про те, що ПК був активним інгредієнтом.10,12,15
Подальші дослідження Rotunda et al5 у 2004 році показали, що SDC, ймовірно, є активним інгредієнтом, діючи як біологічний миючий засіб та порушуючи життєздатність клітин. Лабораторні експерименти виявили дозозалежний клітинний лізис у культивованих клітинах, підданих дії SDC.4,5,7,16,17
Дослідники припустили, що SDC діє як миючий засіб, що призводить до компрометації фосфоліпідного двошару клітини та призводить до клітинного лізису. Солюбілізація фосфоліпідних бішарів у змішані міцели миючими засобами була вперше описана Ліхтенбергом в 1983 р. 18. Іонні детергенти, такі як SDC, порушують цілісність мембран, вводячи їх полярні гідроксильні групи в гідрофобне ядро двошару. Врешті-решт відбувається солюбілізація мембранно-асоційованих білків, і клітинна мембрана руйнується в змішані міцели фосфоліпідів та молекул миючих засобів19.
Експерименти, що використовують культуру клітин, метаболічні аналізи та гістологічну оцінку, незалежно підтвердили цю гіпотезу, протестувавши ізольовані сполуки SDC, які здатні викликати клітинний лізис та результуючий некроз у різних типах тканин. 3,7,16 Більшість клітин були знищені в межах 15 хвилин інкубації з розчинами in vitro (табл. 1) .7
Таблиця 1.
Час, необхідний для спричинення> 90 відсотків спостережуваної загибелі клітин, що підтверджено фарбуванням акридиновим оранжевим у клітинних популяціях, що зазнали дії сполук, що містять фосфатидилхолін, розчинений у дезоксихолаті натрію7
| 90 секунд | Преадипоцити |
| Шість хвилин | Клітини гладких м’язів судин, скелетні міотрубки, клітини ниркового епітелію |
| 15 хвилин | Незрілі адипоцити |
Ці експерименти також виявили, що зрілі адипоцити були більш стійкими до клітинного лізису, спричиненого миючими засобами, ніж інші типи клітин in vitro, ставлячи питання про те, наскільки ці агенти будуть безпечними, якщо ін'єкція випадково відбудеться поза жировим відділом.7 Подальші дослідження показали, що через спорідненість SDC до альбуміну, низька концентрація альбуміну та інших білків, що оточують жирові тканини, може пояснювати їх відносну сприйнятливість до цих сполук (табл. 2). Хвости миші, яким вводили SDC, виявили майже повне пошкодження м’язових шарів, дерми та епідермісу при гістологічному дослідженні, незважаючи на значний некроз та фіброз підшкірної жирової тканини.20
Таблиця 2.
Концентрація SDC, необхідна для індукції лізису культивованих адипоцитів in vitro
| Жоден | 0,045% |
| 0,7% | 0,075% |
| 1,3% | 0,100% |
Збільшення концентрації альбуміну збільшувало спостережуваний LD50 дозозалежно. 20
Випробування ізольованих розчинів ПК спочатку вважалося неможливим, оскільки він нерозчинний у водному розчині. У 2009 році, однак, Дункан та співавт. 17 використовували інертне мінеральне масло як розчинник, показуючи, що лише ПК не здатний спричинити клітинний лізис, який спостерігається із загальними розчинами ПК/SDC.
Фігура 1. (А) паннікуліт, індукований змішаною ін’єкцією розчину SDC/PC за 3 тижні до цього; рівномірно розподілений часточковий малюнок фіброзу; (B) Жирова ін’єкція 4,2% дезоксихолату через 4 тижні після ін’єкції SDC, демонструючи виражений фіброзуючий перегородковий паннікуліт. Рисунок адаптований за Duncan D, Rubin JP, Golitz L, et al. Уточнення техніки ін’єкційного ліполізу на основі наукових досліджень та клінічної оцінки.
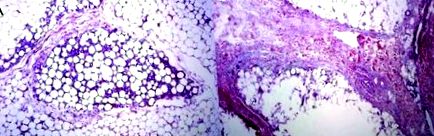
Малюнок 2. Дерма над жировою кліткою, оброблена змішаним розчином ПК/SDC. Пучки колагену не зазнають впливу. (B) Дерма над жировою кліткою, оброблена лише SDC, гомогенізація та склероз колагену. Рисунок адаптований за Duncan D, Rubin JP, Golitz L, et al. Уточнення техніки ін’єкційного ліполізу на основі наукових досліджень та клінічної оцінки.
Дослідження, мічені радіостанціями, показали, що введений SDC потрапляє в циркуляцію шлунково-кишкового тракту протягом декількох днів після ін’єкції, піддаючись елімінації калу, подібно до ендогенних жовчних кислот. Деякі вважають, що ПК може сприяти емульгуванню сміття, що утворюється після адиполізу, сприяючи лімфодренажу. Ця теорія залишається неперевіреною, і радіомаркетовані дослідження, що оцінюють долю цього багатого ліпідами клітинного сміття, можуть допомогти в подальшому окресленні ефектів тканин після ін’єкцій та подальших відмінностей з розчинами, що містять суміш обох інгредієнтів.
КЛІНІЧНІ ВИПРОБУВАННЯ
У багатьох дослідженнях розчинів мезотерапії, що містять ПК/SDC, використовували складові склади, подібні до Ліпостабілу, і не були затверджені FDA. У цих пілотних дослідженнях були випробувані різні місця ін’єкцій, включаючи грижу жирової прокладки нижньої кришки, ін’єкцію великого об’єму «целюліту» в глутеотрокантерну область, «зворотні рулони» та ліпоми.9,17,21–24
ATX-101 показав багатообіцяючі результати в перших клінічних випробуваннях розчину на основі SDC, схвалених FDA. У 2014 р. Було повідомлено про результати багатоцентрового дослідження 363 пацієнтів, які висловили невдоволення своєю субментальною областю. Пацієнтів рандомізували для прийому препарату або плацебо протягом 1-4 сеансів лікування.
З 241 пацієнта, що знаходився в лікарській групі, 19 припинили лікування достроково через несприятливі ефекти. Один із 122 пацієнтів контрольної групи припинив лікування. Про суттєве покращення повідомили 59,2 відсотка пацієнтів у групі нижчих доз, 65,3 відсотка у групі вищих доз та 23 відсотки пацієнтів у групі плацебо.
Дослідження REFINE-1, опубліковане в січні 2016 року, є найбільшим на сьогодні випробуванням, в якому взяли участь 506 досліджуваних. На додаток до візуальних результатів, це дослідження використовувало оцінку магнітно-резонансної томографії (МРТ) передплатизматичної жирової подушки у 224 пацієнтів. Автори встановили, що 46,3 відсотка учасників продемонстрували рентгенографічну відповідь у групі лікування, порівняно з 5,3 відсотка групи плацебо.
ПОБІЧНІ ПОДІЇ
Випробування фази 1 ATX-101 не виявили впливу на системні ліпідні профілі, СРБ або IL-6,27. У дослідженнях фази 3 90,8 відсотка групи лікування низькими дозами та 95 відсотків групи лікування високими дозами повідомили про побічні ефекти, оскільки порівняно з 50,8 відсотками пацієнтів з плацебо. Очікувались найчастіше повідомлявані побічні ефекти, які включали тимчасовий біль у місці ін’єкції, набряк, синці, ущільнення та оніміння. Середня тривалість болю становила одну добу, тоді як набряклість тривала 9-10 днів, а оніміння та ущільнення залишалися від 17 до 25 днів. нібито самостійно вирішується. Крайовий парез нижньощелепного нерва спостерігався у 4,3 відсотка пацієнтів із середньою тривалістю 31 день, а дисфагія - 1,6 відсотка учасників із середньою тривалістю чотири дні. Загалом, зафіксовано, що тяжкість побічних ефектів зменшується з кожним наступним сеансом ін’єкції.
У звітах про змішані сполуки, що містять ПК/SDC, перелічені побічні явища, включаючи біль та набряки, що тривають 48 годин, та утворення гематом протягом 10 днів. Невеликий відсоток пацієнтів повідомив про тимчасову постін'єкційну нудоту, запаморочення або запаморочення. 13,28,29 Також у літературі зазначаються випадкові випадки виразки шкіри в місцях ін'єкцій, одна з яких пов'язана з нерозкритою системною червоною вовчаком (СЧВ), а інший після того, як пацієнт під час ходьби мав післяін’єкційний контакт внутрішньої частини стегон.
Два повідомлення про кропив'янку після ін'єкції розчину ПК та SDC були зафіксовані у пацієнтів з нерозкритою соєвою алергією.28 В іншому повідомленні відзначалася локалізована втрата шкіри над задньою частиною стегна після ін'єкції ін'єктором-початківцем, який пройшов навчання лише за усними інструкціями. Цей пацієнт повідомляв про попередню агресивну ліпосакцію в зоні лікування, а область виразки оброблялася гіпербаричним киснем, розсмоктуючись з мінімальною нерівністю поверхні30.
Техніка ін’єкції видається важливою щодо побічних явищ; невеликі аликвоти 0,2 мл або менше дають найкращі результати, а інжектори повинні підтримувати відповідну глибину голки (приблизно 9-11 мм на більшості ділянок і близько 6 мм у шиї). 30,31 Зовнішнє стиснення протипоказано. У поєднанні з післяін'єкційним набряком компресія може спричинити компрометацію місцевого кровопостачання та призвести до некрозу верхньої дерми та епідермісу.
У порівнянні досліджень із змішаними розчинами ПК/SDC порівняно з SDC, профілі побічних ефектів порівнянні. Концентрації SDC повинні бути збільшені при одночасному застосуванні з ПК, оскільки ці два сполуки утворюють міцели в розчині, зменшуючи вільну частину миючого засобу.9,32 Дослідження Rotunda та співавт., Опубліковане в 2009 р.32, не показало різниці у частоті побічних ефектів або ефективність лікування при порівнянні змішаних розчинів ПК/SDC з окремими SDC. Однак попереднє дослідження, опубліковане Salti та співавторами9 у 2008 р., Показало, що пацієнти, як правило, мають більший ступінь тяжкості побічних ефектів і повільніше розсмоктування розчинами чистого SDC.9,32
У 2013 році Park et al33 повідомили про небажані ефекти після ін’єкції сполуки, подібної до Lipostabil endovena. Lipobean® (Ami Pharm Inc., Корея), змішаний розчин ПК та SDC, застосовували молодій жінці, яка бажала зменшення жиру в животі. Пацієнт мав стійкий навколопухирний вузол через шість місяців після лікування, незважаючи на три цикли інтралезійного триамцинолону. Цей вузлик видаляли шляхом ексцизійної біопсії та оцінювали гістологічно. Жирова тканина була замінена фіброзом із вираженою запальною інфільтрацією та утворенням мікроабсцесу в дермі. Септальний та часточковий паннікуліти відзначалися з густими волокнистими перегородками, некрозом жиру та утворенням мікрокісти.33 Як повідомляється, тривале утворення гранульоми та стійка індурація частіше виникають при використанні доз більше 0,2 мл та коли концентрації SDC занадто високі .34
У одному звіті з Німеччини у 2011 р. Повідомлялося про індуковану наркотиками дисфункцію печінки та тубулоінтерстиціальний нефрит, що вимагає тимчасового гемодіалізу після підшкірного застосування Ліпостабілу. Пацієнт видужав без тривалої втрати працездатності
ПОКАЗАННЯ
На сьогодні єдиним схваленим FDA показанням підшкірної ін’єкції SDC є опуклість середньої та важкої ступеня або повнота, пов’язана із субментальним жиром.14 Зареєстровані клінічні випробування, затверджені FDA, також оцінювали безпеку та ефективність ATX-101 при лікуванні ліпом, але жодних вказівок не надано. Потрібні подальші дослідження, щоб визначити, чи можуть розчини ПК/SDC також використовуватися для лікування надлишків жиру в інших областях тіла.
ВИСНОВОК
Ін’єкції розчинів, що містять ПК та SDC, широко використовуються в Південній Америці і можуть представляти життєздатну альтернативу для лікування невеликих кишень жирової тканини, що не піддаються іншим методам лікування. ATX-101 є першим схваленим FDA розчином SDC для підшкірних ін’єкцій, але потенційна порожнеча існує і для продуктів, що містять ПК. Поодинокі дослідження змішаних розчинів ПК/SDC проти SDC лише показали зменшення тривалості побічних ефектів із змішаним розчином, але подальші звіти не відзначали цієї різниці. Подальші дослідження показані і можуть призвести до більш стерпних методів лікування. 9,25,32
Ін’єкційні розчини адиполізу, що містять SDC, мають передбачуваний профіль несприятливих ефектів, очікуваний біль, набряк та оніміння протягом початкового періоду після ін’єкції та потенціал для невеликого відсотка пацієнтів проявляти післяін’єкційний парез крайового нижньощелепного нерва, або дисфагія. Усі ці побічні ефекти зникали спонтанно, хоча існують рідкісні повідомлення про стійке утворення гранульоми та виразки шкіри з утворенням рубців. Цей ризик можна дещо пом'якшити шляхом опитування пацієнтів про особисту історію захворюваності на кобнеризацію шкіри, захворювання сполучної тканини, попереднє хірургічне та нехірургічне лікування району та історію алергії на сою за допомогою розчинів, що містять соєвий ПК. Забезпечення того, щоб пацієнти не стискали область ін'єкції після процедури, може зменшити ризик розвитку виразок. 17,28,33
Безперечно, активним інгредієнтом цих препаратів є SDC, і механізм дії полягає в цитотоксичності адипоцитів, а не в результаті індукції внутрішньоклітинних ліпаз, як вважалося раніше. Однак серійні гістологічні дослідження показують, що SDC може переноситися краще і призвести до більш сприятливих з точки зору косметики моделей некрозу та фіброзу жиру при одночасному застосуванні з ПК.
Також повідомлялося про нудоту, запаморочення та запаморочення, пов’язані з ін’єкціями. Бажаний певний ступінь ін’єкційного фіброзу, який може покращити в’ялість шкіри після лікування, що призводить до поліпшення космезису, особливо в субментальній ділянці. 17,31
В даний час також розробляються майбутні ін’єкційні препарати, отримані з мезотерапевтичних засобів. Розробляються препарати, які активують внутрішньоклітинні ліпази через ефекти бета-адренергічної стимуляції адипоцитів, внаслідок чого тимчасова втрата жирового об’єму називається ін’єкційним ліполізом. Neothetics Corporation, раніше відома як Lithera, має два склади ін’єкційних препаратів на основі сальметеролу, які пройшли випробування FDA (LIPO-102 та LIPO-202) [Neothetics Corporation Pipeline. http://www.neothetics.com/what_we_do.html]. Вони можуть запропонувати більш безпечну альтернативу ін’єкційному лікуванню жирової тканини в майбутньому із зниженим ризиком спотворення побічних ефектів, хоча ранній досвід вказує, що результати є тимчасовими, і тахіфілаксія до бета-адренергічних препаратів швидко виникає в адипоцитах, коли не застосовується разом із кортикостероїдами .2,3,36
Ін’єкційні засоби на основі мезотерапевтичних препаратів представляють нову категорію препаратів, спрямованих на небажану жирову тканину. Випробування, схвалені FDA комбінованих розчинів ПК/SDC та бета-адренергічних засобів для ін’єкційного ліполізу, можуть призвести до більш безпечних та стабільних результатів, ніж минулі випробування, в яких використовувались власні внутрішньовенні склади, багатоагентні ін’єкції та складені препарати різних аптек та виробників. Тим часом ATX-101 здається безпечним та ефективним засобом для лікування відкладень жирових відкладень, коли перебуває в руках досвідченого ін’єктора.
Виноски
Розкриття інформації:Автори повідомляють про відсутність відповідних конфліктів інтересів.
- Ліпотропний храм для ін’єкцій, Кіллін, штат Техас, Центр схуднення
- Ін'єкція ліраглутиду (управління вагою)
- Механізми та застосування гіпертонічного сольового розчину
- Індолілові азаспірокеталеві основи Манніха є потужними антимікобактеріальними засобами із селективною мембраною
- Ін’єкційна терапія Блумінгтон М.Н. Природне полегшення болю