Короткочасне обмеження калорій посилює функцію стовбурових клітин скелетних м’язів
Массіміліано Серлетті
2 Відділ стовбурових клітин та регенеративної біології, Гарвардський університет, Гарвардський інститут стовбурових клітин, 7 Divinity Ave., Кембридж, Массачусетс 02138
3 Центр діабету Джослін, One Joslin Place, Бостон, Массачусетс 02215
Молодий К. Джанг
2 Відділ стовбурових клітин та регенеративної біології, Гарвардський університет, Гарвардський інститут стовбурових клітин, 7 Divinity Ave., Кембридж, Массачусетс 02138
3 Центр діабету Джослін, One Joslin Place, Бостон, Массачусетс 02215
Лідія В.С. Фінлі
4 Кафедра клітинної біології, Гарвардська медична школа, Бостон, Массачусетс 02115
Марсія К. Хейгіс
4 Кафедра клітинної біології, Гарвардська медична школа, Бостон, Массачусетс 02115
Емі Дж. Веджерс
1 Медичний інститут Говарда Хьюза
2 Відділ стовбурових клітин та регенеративної біології, Гарвардський університет, Гарвардський інститут стовбурових клітин, 7 Divinity Ave., Кембридж, Массачусетс 02138
3 Центр діабету Джослін, One Joslin Place, Бостон, Массачусетс 02215
Пов’язані дані
РЕЗЮМЕ
Обмеження калорій (CR) продовжує тривалість життя та покращує вікові патології у більшості досліджуваних видів; проте механізми, що лежать в основі цих ефектів, залишаються незрозумілими. Використовуючи скелетні м’язи миші як модель, ми показуємо, що CR частково діє, посилюючи функцію тканиноспецифічних стовбурових клітин. Навіть короткочасні CR значно покращують доступність та активність стовбурових клітин у м’язах молодих та старих тварин, спільно зі збільшенням кількості мітохондрій та індукцією збережених регуляторів метаболізму та довголіття. Більше того, покращений ендогенний відновлення м’язів та CR, ініційований у тварин-донорів або реципієнтів, покращили внесок донорських клітин у регенерацію м’язів після трансплантації. Ці дослідження вказують на те, що метаболічні фактори відіграють вирішальну роль у регулюванні функції стовбурових клітин і що ця регуляція може впливати на ефективність відновлення після травми та приживлення трансплантованих клітин.
Обмеження калорій (CR) - це дієтичне втручання, яке продовжує тривалість життя та затримує, запобігає або зменшує тяжкість вікових патологій у багатьох видів та тканин (Ahmet et al., 2005; Hursting et al., 2003; Russell and Kahn, 2007). Дійсно, тварини, що відповідають віку, які протягом усього життя дотримуються дієти зі зниженою калорійністю, виявляють менше злоякісних новоутворень, посилюють когнітивні та рухові функції та знижують частоту діабету в порівнянні з контрольними тваринами, яким дозволяється їжа за необхідністю. Попередні дослідження в системі кровотворення гризунів (Ertl et al., 2008) припускають, що обмеження калорій протягом усього життя може підтримувати функцію стовбурових клітин, яка, як правило, знижується з віком, але чи може короткочасна ХР у здорових молодих тварин посилити функцію стовбура тканини осередків не було адресовано. Більше того, вплив CR на тварин-реципієнтів на ефективність приживлення стовбурових клітин залишається невідомим. Відповіді на обидва ці запитання можуть допомогти поліпшити націлювання та трансплантацію стовбурових клітин для терапії та висвітлити нормальні метаболічні регулятори функції стовбурових клітин тканини та вікові фактори, які зазвичай погіршують цю функцію (Rossi et al., 2008).
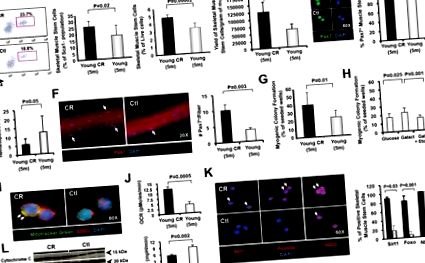
Щоб вивчити вплив CR на загальну частоту та міогенну активність стовбурових клітин скелетних м’язів, ми очистили ці клітини від молодих мишей C57BL/6, вирощених спочатку на контрольній дієті, а потім перейшли на CR у віці 2 місяців або у віці C57BL/6 мишей, у яких CR ініціювали у віці 18 місяців. В обох випадках, після 12 тижнів CR (1 тиждень при обмеженні 20% та 11 тижнів при 40% (рис. S1A), тварин жертвували для аналізу FACS та аналізів міогенезу для порівняння частоти та активності супутникових клітин у їх м’язах з тими, що Вражаюче, що як молоді, так і вікові тварини (тепер у віці 5 або 21 місяців відповідно), які зазнали короткочасного CR, демонстрували суттєво підвищену частоту експресії Pax7 (малюнки 1A, B та S2A, B) ( Рисунок 1D) супутникові клітини, виявлені за допомогою аналізу FACS. Загальний вихід супутникових клітин (на грам зібраного м’яза), який можна було відновити після сортування клітин, також був збільшений для CR м’язів (малюнки 1C та S2C). Частота супутникових клітин була підтверджена фарбуванням ядер Pax7 + на ізольованих міоволокнах, що продемонструвало
3-кратне збільшення кількості клітин Pax7 + на міоволокно у молодих мишей (n = 4, малюнок 1F) та
Збільшення у 2 рази у віці мишей (n = 4, малюнок S2E).
Супутникові клітини тварин, оброблених CR, також виявляли значно посилену міогенну функцію в аналізах колоніального формування ex vivo (
Збільшення кількості клітин, здатних ініціювати утворення міогенної колонії, на 50–60%, n = 7 (молоді) або n = 4 (у віці); Рисунки 1G та S2F). Як у молодих, так і у вікових мишей, які отримували CR, ця посилена міогенна функція супроводжувалася підвищеною часткою супутникових клітин, що виражали збережені тривалість життя/регулятори метаболізму Sirt1 та Foxo3a (малюнки 1K та S2G). Окрім цього, супутникові клітини, оброблені CR, у вікових мишей демонстрували відновлення сигналізації Notch, спричиненої активацією (малюнок S2G), критичного вікового детермінанта міогенної функції (Conboy et al., 2005; Conboy and Rando, 2002). Таким чином, короткочасна CR, ініційована або в молодості, або в літньому віці, справляє глибокий вплив на м'язові стовбурові клітини, змінюючи їх профіль експресії генів, підвищуючи їх ендогенну доступність і сприяючи їх міогенній активності.
Підвищена частота та функція супутникових клітин у м’язах тварин, які отримували CR, свідчить про те, що це просте дієтичне втручання може обіцяти підвищення терапевтичної ефективності м’язових стовбурових клітин в контексті м’язових захворювань або дисфункції. Щоб перевірити цю можливість, ми проаналізували регенеративну активність після пошкодження ендогенних клітин-супутників у CR або контрольних мишей, а також потенціал приживлення донорських клітин-супутників, зібраних із короткочасних CR або контрольованих мишей та трансплантованих в м'язи мишей-реципієнтів mdx, добре вивчена модель м’язової дистрофії Дюшенна (Sicinski et al., 1989). Що примітно, раніше поранені м’язи передньої гомілки (ТА) від мишей CR демонстрували покращену регенеративну здатність, що свідчить про більшу щільність новоутворених міоволокна порівняно з контрольними мишами через 7 днів після травми (n = 7 (CR) або n = 6 (Ctl ); Малюнок 2А). Більше того, трансплантація супутникових клітин від донорів, які отримували CR, призвела до майже вдвічі більшої кількості отриманих донорами (експресують дистрофін) міоволокон, ніж рівна кількість супутникових клітин від контрольних мишей (n = 4 (CR) або n = 3 (Ctl) реципієнта) 2B), що означає значне підвищення ефективності трансплантації та регенераційного потенціалу in vivo м'язових стовбурових клітин, отриманих від донорів, підданих короткочасному CR.
Експериментальний дизайн для кожного дослідження показаний зліва. (A) М'язи TA молодих мишей, які отримували CR або контрольних мишей C57BL/6, були піддані морозостійкості та зібрані для гістології через 7 днів після травми. Кількісно визначали регенерацію м’язів на зрізах тканин гематоксилін/еозин (H&E) як середнє число міоволокна з центральним ядром на мм 2 (n = 7 CR і n = 6 Ctl, середнє значення ± SD), і вказують на
15% збільшення кількості новоутворених волокон у регенерованій тканині мишей CR. Ці висновки узгоджуються з іншими дослідженнями (McCarthy et al., 2011; Murphy et al., 2011), що вказують на корелятивний, але не обов’язково кількісний зв’язок між ендогенним вмістом клітин м’язових супутників (збільшення
В 4 рази більший приживлення міоволокна (n = 4 миші на групу, малюнок 2C), що демонструє посилений внесок трансплантованих клітин у регенерацію м’язів в умовах CR. Ми припускаємо, що сприятливий вплив CR на господаря для приживлення супутникових клітин принаймні частково пов’язаний з протизапальною дією CR. Відповідно до попередніх досліджень, що свідчать про зменшення запалення у тварин, які отримували CR (оглянуто в (Fontana, 2009)), миші CR у наших експериментах демонстрували значне зниження частоти запальних клітин у м’язах порівняно з контролем (рис. 1E та S2D). Цікаво, що було продемонстровано, що трансплантація клітин у м’язи імунокомпетентних тварин часто призводить до гострої загибелі клітин. У разі трансплантації міобластів 95–99% перенесених клітин можуть загинути протягом декількох днів після трансплантації, і, як пропонується, ця смерть є результатом вродженої імунної/запальної реакції, встановленої господарем (Tremblay and Guerette, 1997)). Таким чином, ми прогнозуємо, що посилення приживлення, яке спостерігається у реципієнтів CR, може бути пояснене поліпшенням виживання трансплантованих клітин у CR-м'язі на відміну від контрольного м'яза через зменшення запальної реакції, спричинене CR-процесом.
ОСОБЛИВОСТІ
CR збільшує частоту стовбурових клітин скелетних м’язів у молодих та літніх мишей.
М’язові стовбурові клітини мишей, оброблених CR, демонструють підвищену кількість мітохондрій.
- Поживні речовини Безкоштовно Повний текст Вплив обмеження калорій на роль аутофагії у втручанні у старіння
- Метаболічна адаптація до обмеження калорій Наукова сигналізація
- Модуляція шкірного старіння з обмеженням калорій у щурів Fischer 344 - гістологічне дослідження -
- Короткотермінове втручання з низьким вмістом калорій знижує рівень сироваткових продуктів, покращених для глікації, здоровими
- MUSCLE MILK® 100 Калорійний білковий порошковий м’язове молоко ©