Очний токсокароз: клінічні особливості, діагностика, лікування та профілактика
Сон Джун Ан
1 відділення офтальмології лікарні Бунданг Сеульського національного університету, Медичний коледж Сеульського національного університету, Соннам 463-707, Корея.
2 відділення офтальмології столичної лікарні збройних сил, Соннам 463-040, Корея.
Na-Kyung Ryoo
1 відділення офтальмології лікарні Бунданг Сеульського національного університету, Медичний коледж Сеульського національного університету, Соннам 463-707, Корея.
Се Джун Ву
1 відділення офтальмології лікарні Бунданг Сеульського національного університету, Медичний коледж Сеульського національного університету, Соннам 463-707, Корея.
Анотація
ТОКСОКАРІАЗ, ОКУЛЯРНИЙ ТОКСОКАРІАЗ
Токсокароз є однією з найпоширеніших зоонозних інфекцій у всьому світі, в основному спричиненою Toxocara canis і рідше іншими аскаридами, такими як Toxocara cati [1, 2]. Географічний розподіл токсокарозу поширений у всьому світі, а серопозитивність антитіл до токсокари коливається від 2,4% [3] до 76,6% [4]. Історично склалося, що в 1952 р. Бівер та ін. [5] виявив етіологічний агент, личинки T. canis, в еозинофільних гранульомах у біопсіях печінки, взятих у трьох дітей. Через чотири роки Ніколс [6] продемонстрував наявність личинок другої стадії T. canis у гістологічних зрізах 24 очей, енуклейованих під підозрою на внутрішньоочні злоякісні пухлини. Ці висновки призвели до загальної етіології системних та очних захворювань, токсокарозу людини.
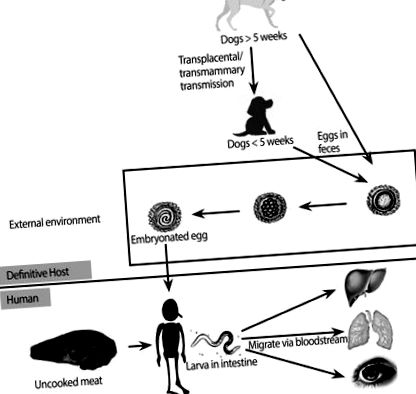
Особи заражаються токсокарою, коли ненавмисно проковтують зароджені яйця або личинки, які випали у фекаліях інфікованих тварин або необроблених паратеничних господарів (рис. 1) [1, 2, 7]. Після того, як людина проковтне яйцеклітини, інфекційні личинки вивільняються в тонкому кишечнику, а згодом вони проникають у стінки кишечника, потрапляють в кровообіг і мігрують до органів, де вони викликають запальні реакції та симптоми [1, 2]. Клінічний спектр токсокарозу у людей варіюється від безсимптомної інфекції до важкої травми органу, залежно від навантаження паразитів, місць міграції личинок та запальної реакції господаря [1]. Зокрема, залежно від ураженого органу, можуть виникати два чітко визначені клінічні синдроми: системний токсокароз (також відомий як вісцеральна личинка мігранта) та очний токсокароз (ОТ) [1].
Спрощена фігура, що показує життєвий цикл Toxocara canis та його шлях передачі та міграцію у людини.
Оскільки ОТ залишається відносно невідомим для громадськості, а також клініцистів, тут розглядаються клінічні особливості, діагностика, лікування та профілактика ОТ з акцентом на нових розробках серологічної діагностики та нових результатах клінічних досліджень у літературі.
КЛІНІЧНІ ОСОБЛИВОСТІ
Вік у пацієнта з ОТ може бути різним - від одного до 77 років [9, 16, 17]. Більшість попередніх досліджень повідомляли, що це частіше зустрічається у чоловіків, оскільки співвідношення чоловіків і жінок зазвичай перевищує 1: 1 [8, 12, 18, 19, 20, 21, 22], до 4,5: 1 [23 ]. Більшість випадків були односторонніми, а двосторонні - менше 40% [20] у літературі. Його клінічні прояви можна класифікувати за однією з чотирьох форм: гранульома заднього полюса, периферична гранульома, ендофтальміт нематоди та атипові прояви [16].
Гранульома заднього полюса (рис. 2), вогнищева, білувата субретинальна або інтраретинальна запальна маса, як правило, менше 1 діаметру диска з пігментацією або без неї, присутня в задньому полюсі з ознаками гострого запалення або без туманного склоподібного тіла [16]. Уілкінсон та Уелч [24] показали, що ця форма є найпоширенішою формою клінічного прояву, що складається з 44% випадків ЗТ. Ураження жовтої плями, найімовірніше, є симптоматичним і, отже, спонукає пацієнтів звернутися за медичною допомогою, що, можливо, пояснює схильність до гранульоми заднього полюса.
Фотографії очного дна гранульоми сітківки у пацієнтів чоловічої статі (В) та 31-річного віку (В) з очним токсокарозом. (А) Гранульома заднього полюса виглядає як овальне біле ураження заднього полюса сітківки. (B) Периферична гранульома представлена аморфною білуватою масою з тракційною мембраною та відшаруванням сітківки.
Периферична гранульома (рис. 2), вогнищевий, піднесений, білий вузол на периферії сітківки, може мати різний ступінь оточуючих мембран та пігментні зміни [16]. У деяких пацієнтів з периферичною гранулемою запалення може бути дифузним і виглядати як "сніговий нагромадження" [10]. Можуть спостерігатися фіброклітинні смуги, що йдуть у напрямку до задньої сітківки або зорового нерва, іноді утворюючи складку сітківки. Локалізоване витягування на сітківці може також призвести до тракційного відшарування сітківки або регматогенного відшарування сітківки шляхом утворення отворів або розривів сітківки.
Ендофтальміт нематоди - це тип панувеїту, що проявляється як червоне, болюче око з дифузним внутрішньоочним запаленням [16]. Гіпопіон і щільний клітинний інфільтрат у склоподібному тілі можуть спостерігатися у важких випадках. Гранульома сітківки може спостерігатись через помутніння склоподібного тіла, коли непрозорість склоподібного тіла очищається [24]; тому ретельне зусилля для виявлення гранульоми сітківки є важливим для диференціальної діагностики. Пацієнти з ендофтальмітом нематод, як правило, трохи молодші за пацієнтів з локалізованою гранулемою.
Нетипові прояви включають запалення та набряк головки зорового нерва (що проявляється як неврит зорового нерва), рухливі субретинальні личинки та дифузний хоріоретиніт [1, 7, 10]. Також можуть спостерігатися знахідки переднього сегмента, такі як кон’юнктивіт, кератит, іридоцикліт, вогнищеві вузлики райдужки та катаракта [1]. У нашому недавньому звіті в очах з ОТ спостерігали невелику, круглу, білу гранулемоподібну помутніння, що рухається в підкапсулярному рівні кришталика [25].
На додаток до очного запалення та асоційованих з гранулемою форм, супутні захворювання в очах з ОТ вимагають ретельного розгляду, оскільки вони можуть бути іншими джерелами втрати зору і можуть прогресувати, якщо їх не лікувати. До таких супутніх захворювань вітреоретиналу при ОТ належать епіретинальна мембрана, помутніння склоподібного тіла, тракційне/регматогенне відшарування сітківки, набряк жовтої плями, катаракта та макулярний отвір [9, 10]. Хоча типова форма ОТ, гранульома із внутрішньоочним запаленням може лікуватися медично, випадки поєднаних супутніх захворювань вітреоретину іноді вимагають хірургічного лікування для анатомічного та зорового відновлення.
У кількох звітах пропонуються причини втрати зору у пацієнтів з ОТ. Стюарт та ін. [10] повідомляв, що вітрит є найпоширенішою причиною втрати зору при ОТ, за яким слідують цистоїдний макулярний набряк, тракційне відшарування сітківки та епіретинальна мембрана. Крім того, в очах з макулярною гранулемою сама гранульома може призвести до значної втрати зору, оскільки пошкоджує зачеплену сітківку ока та фоторецептори [9]. Таким чином, причини втрати зору в очах при ОТ можна згрупувати за 3 категоріями: пошкодження сітківки, спричинені самою гранулемою, супутні захворювання сітківки та внутрішньоочне запалення. У нашому випадку серії ОТ середня найкраще виправлена гострота зору становила 20/64 еквівалента Снеллена на початковому рівні, що було порівняно з 20/56 еквівалентом Снеллена під час останнього візиту, коли внутрішньоочне запалення в основному стихало [9]. Це вказує на те, що у випадках зниження зору під час клінічного обстеження у пацієнтів з ОТ слід враховувати та ретельно оцінювати інші причини, такі як пошкодження сітківки гранулемою чи іншими супутніми захворюваннями.
Примітно, що унікальною особливістю ОТ, порівняно з іншими запальними захворюваннями або захворюваннями сітківки, є внутрішньоочна міграція (рис. 3) [9, 26, 27]. Два повідомлення про випадки індивідуально продемонстрували внутрішньоочну міграцію гранульоми [26, 27]. Існувало два типи внутрішньоочної міграції, безперервна (гранульома мігрувала поруч із спочатку спостережуваним місцем розташування) або переривчаста (нова гранульома далеко від вихідного місця) [9]. Під час клінічного перебігу безперервна та неперервна міграція гранульоми спостерігалась у 12,9% та 4,3% очей з ОТ відповідно [9]. Оскільки мігруюча гранульома є патогномонічною для ОТ, ця унікальна особливість може бути корисною для диференціації ОТ від інших захворювань сітківки, таких як очний токсоплазмоз, саркоїдоз, туберкульоз та грибкові інфекції [9].
Дві моделі міграції гранульоми Toxocara: безперервна (A) та переривчаста (B). (A) Гранульома рухається в скроневу сторону через місяць після першого відвідування (A, ліворуч). Пунктирна лінія на панелі A позначає контрольну лінію, що з'єднує дві опорні точки. (B) Порівняно з початковим рівнем, дві нові гранульоми з’являються в макулі та позатемпоральній сітківці.
ДІАГНОСТИКА
Остаточний діагноз очного токсокарозу можна отримати шляхом гістологічної демонстрації личинки токсокари або її фрагментів при біопсії інфікованої тканини. Однак збір відповідного біопсійного матеріалу є ризикованим та складним для очей при ОТ і рідко виправданий з клінічних причин. Таким чином, поточний діагноз ОТ ставиться клінічно шляхом виявлення типових офтальмологічних ознак та наявності сироваткових антитіл до личинок Toxocara [1, 7, 16].
Як згадувалося вище, клінічна картина локалізованої гранульоми в задньому полюсі або периферії сітківки є типовою для постановки передбачуваного діагнозу ОТ. У випадках ендофтальміту нематод, при якому огляд очного дна неможливий через помутніння склоподібного тіла, специфічні допоміжні тести, такі як ультрасонографія (зображення високовідбивальної маси з або без склоподібної смуги) можуть бути корисними для диференціальної діагностики, і наявність гранульоми сітківки слід повторно -оцінюється для встановлення точного діагнозу, коли склоподібне тіло стає прозорим [1, 24].
Як допоміжний тест було визначено роль виявлення антитіл до імуноглобуліну Е (IgE) у пацієнтів з токсокарозом людини [7, 34]. Щодо ролі ОТ, наша серія випадків ОТ показала, що 69,6% клінічно та серологічно діагностованих пацієнтів показали підвищений рівень IgE, що свідчить про те, що IgE може надати додаткову роль для діагностики ОТ [9]. Крім того, рівні IgE демонстрували зниження після лікування токсокарозу людини, що вказує на те, що він може бути корисним для контролю терапевтичного ефекту. Це вимагає подальшого дослідження ролі антитіл IgE серед пацієнтів з ОТ.
Хоча системна еозинофілія є важливою особливістю системного токсокарозу [14, 35, 36, 37, 38], кількість еозинофілів зазвичай не підвищена у пацієнтів із ЗТ. Наприклад, наша серія випадків показала лише 11,6% (10 з 86) пацієнтів з ОТ мали еозинофілію [9]. Таким чином, кількість еозинофілів може бути не настільки корисною, як тест ELISA або загальний рівень IgE; однак еозинофілія може вказувати на можливість одночасного виникнення системного та очного токсокарозу [1, 34], що вимагає системної оцінки та відповідного лікування.
Кілька авторів припустили, що поліпшення чутливості можна досягти за допомогою ІФА-аналізу внутрішньоочних рідин [17, 33, 39]. Однак, використовуючи одне і те ж граничне значення з антитілами до сироватки крові, позитивні показники ІФА на склоподібній рідині становили лише 33% серед пацієнтів з ОТ, що вимагає подальшого дослідження відповідного граничного значення для виявлення ОТ [9]. У випадках хірургічного лікування залишки організмів Toxocara іноді виявляють у зразках вітректомії, отриманих під час хірургічного втручання, які надають прямі докази внутрішньоочного зараження личинки Toxocara [40]. Цитологічне дослідження водянистої вологи або зразків склоподібного тіла також може бути корисним для підтвердження діагнозу ОТ. Однак наразі відсутні доступні дані щодо швидкості виявлення цитології склоподібного тіла або біопсії серед очей з ОТ, отже, цитологія та біопсія можуть бути зарезервовані для пацієнтів із підозрою на ОТ, попередньо заплановану на хірургію вітреоретину.
ЛІКУВАННЯ
Очі з ОТ можна лікувати медикаментозно або хірургічно, залежно від тяжкості внутрішньоочного запалення та супутніх захворювань. По-перше, медичну терапію слід розглядати у випадках активного запалення. Сучасним стандартним методом лікування очного токсокарозу є введення кортикостероїдів пацієнтам з активним внутрішньоочним запаленням. Місцеві та системні кортикостероїди корисні для лікування внутрішньоочного запалення та можуть зменшити помутніння склоподібного тіла та утворення мембран [9, 24, 39, 41, 42].
Роль антигельмінтної терапії при ОТ залишається суперечливою, оскільки не було рандомізованих контрольованих досліджень щодо використання антигельмінтних засобів для ОТ. Опубліковані результати лише кількох контрольованих випробувань протиглистових препаратів проти системного токсокарозу [43, 44]. Оскільки паразитологічне лікування неможливо точно оцінити, результатом, використаним в опублікованих дослідженнях, було просто покращення клінічних ознак та симптомів. Альбендазол (400 мг двічі на день протягом 7-14 днів) є рекомендованим стандартним препаратом для системного токсокарозу і, схоже, перевершує тіабендазол (дається по 50 мг/кг/день протягом 3-7 днів) [43], який також сильно стримує міграцію личинок [45]. Діетилкарбамазин (дається по 3-4 мг/кг/день протягом 21 дня, починаючи з 25 мг/день для кожного дорослого пацієнта і поступово збільшуючи дозу) також виявляється ефективним для лікування системного токсокарозу [44].
Існує також повідомлення, в якому рухлива личинка субретину, знищена за допомогою фотокоагуляції, також існує [46]. В іншому звіті інтравітреальний ранібізумаб виявився ефективним для лікування неоваскуляризації хоріоїдної залози, вторинної після ОТ [47].
Медична терапія системним або місцевим кортикостероїдом ефективна для зменшення внутрішньоочного запалення та поліпшення симптомів, пов’язаних із запаленням, але має обмежену ефективність для вирішення структурних ускладнень на сітківці. Відшарування сітківки, епіретинальна мембрана та стійке помутніння склоподібного тіла є загальними хірургічними показаннями для хірургічного втручання на вітреоретиналі, що проводиться на очах з ОТ, і кілька авторів повідомляють про результат хірургічного лікування. Джуліарі та ін. [48] повідомили про хороші анатомічні та функціональні результати хірургічного лікування у 45 пацієнтів з ОТ. У нашому випадку 32 із 101 пацієнта (31,7%) потребували хірургічного лікування, кожне з приводу епіретинальної мембрани (n = 19), помутніння склоподібного тіла (n = 9) та/або відшарування сітківки (n = 2). Успішний хірургічний результат був досягнутий у 68,4%, 88,9% та 50% пацієнтів з епіретинальною мембраною, помутнінням склоподібного тіла та відшаруванням сітківки відповідно [9]. Забезпечуючи структурну модифікацію, тобто пілінг мембрани, усунення помутніння склоподібного тіла або повторне кріплення сітківки, операція при ОТ може призвести до стабільності або поліпшення зорової функції.
ПРОФІЛАКТИКА
За відсутності достатньої обізнаності про ЗТ підвищення рівня обізнаності громадськості щодо токсокарозу та зменшення впливу людей на види Toxocara є важливими для профілактики захворювання. Щоб зменшити ризик зараження, спочатку слід зрозуміти джерело передачі.
Попередні дослідження встановили право власності на собаку чи кота як фактор ризику зараження токсокарою. Прямий контакт з нелікованими, зараженими цуценятами вважається важливим джерелом передачі. Однак, загальнонаціональне опитування, проведене в Сполучених Штатах, показало, що відсоток володіння домашніми тваринами серед пацієнтів із ЗТ становив менше 50% (45% для собак і 26% для котів), припускаючи, що вплив необроблених, заражених цуценят може недостатньо пояснити джерела передачі . Випадкове проковтування зароджених яєць геофагією також було запропоновано в якості іншого важливого джерела передачі [1, 2, 7]. Оскільки захворювання зазвичай трапляється у дітей, слід наголосити на належних гігієнічних практиках, таких як миття рук, особливо після впливу на зони підвищеного ризику, такі як пісочниці, відкритий парк та дитячі майданчики. Дійсно, пісочниці, відкриті парки та дитячі майданчики можуть бути сильно забруднені зародженими яйцями токсокари, оскільки люди регулярно вигулюють своїх домашніх тварин у цих місцях [2, 49, 50, 51, 52], а в теплих умовах зароджені яйця можуть залишатися життєздатними роками [53]. Також власникам домашніх тварин слід порадити негайно утилізувати фекалії домашніх тварин, часто прибирати житлову зону свого вихованця та везти своїх домашніх тварин до ветеринара для регулярної дегельмінтизації [16].
У дорослих пацієнтів джерело передачі може дещо відрізнятися від джерела передачі у дітей, оскільки випадкове проковтування зароджених яєць рідше трапляється. Нещодавно повідомлялося про зв’язок між сирим м’ясом, особливо сирої коров’ячої печінки, і токсокарозом серед дорослого населення [9, 14]. У деяких азіатських країнах м'ясне сировина вживають переважно дорослі, що може збільшити кількість дорослих хворих на токсокароз [15]. У Кореї анамнез прийому коров’ячої печінки в анамнезі був виявлений у 60-90% хворих на системний токсокароз та у 80,8% ОТ. Співвідношення шансів ОТ становило 14,9 для прийому сирої печінки корови та 2,28 для прийому сирого м’яса [9]. Це вказує на те, що джерело зараження токсокарозом та демографічні особливості пацієнтів можуть відрізнятися залежно від географічних та поведінкових (особливо харчових звичок) моделей. Практикуючий у галузі охорони здоров’я повинен враховувати місцевий культурний контекст при виявленні ймовірних джерел інфекції у хворих на токсокароз і навчати людей не їсти сире м’ясо, щоб запобігти зараженню токсокарою.
ВИСНОВКИ
Наші сучасні уявлення про діагностику, лікування та профілактику токсокарозу людини та ураження очей обмежені, хоча це одна з найпоширеніших зоонозних інфекцій у всьому світі. ОТ може бути клінічно діагностовано за певними ознаками. Однак серологічний діагноз, який забезпечує докази інфекції Toxocara, може суттєво підтримати діагноз у пацієнтів із передбачуваним ОТ. Таким чином, подальше поліпшення діагностики необхідне для кращого виявлення та швидкої діагностики ОТ. Зокрема, майбутні дослідження повинні дослідити потенційні джерела інфекції та стандартизувати медичне та хірургічне лікування ЗТ, щоб мінімізувати анатомічні та функціональні наслідки. Громадська освіта та кампанія щодо запобігання перетравленню сирої тваринної їжі, особливо печінки, також можуть зменшити захворюваність на токсокароз та ОТ.
- Силікоз Симптоми, причини, діагностика, лікування, профілактика
- Ожиріння у дорослих - симптоми, діагностика та лікування BMJ Best Practice
- Фізична активність у профілактиці та лікуванні гіпертонії у людей із ожирінням - PubMed
- Травма слинної залози Огляд діагностики та лікування
- Ожиріння печінки, ніж для лікування Ожиріння печінки симптоми, лікування та профілактика